甘肃不同区域党参多糖含量的提取方法与生物活性研究
徐美蓉 李晓蓉 丁文姣 陶海霞 漆永红 李婷
摘要:通过正交试验优化了党参中醇溶性多糖的提取工艺,并对其生物活性进行了研究。最佳提取条件固液比为1∶20,提取温度为65 ℃,提取时间为4.5 h,为超声波辅助提取,提取次数为2次,在这些条件下,党参多糖的产率为26.25±1.02%。分析表明,党参多糖中,总糖、蛋白质、糖醛酸含量分别为805、31~66、2.1 g/kg。体外抗氧化实验结果表明,在浓度为2 mg/mL时,党参多糖对ABTS+、DPPH、和HO-具有良好的清除作用。对不同区域党参多糖进行含量比较,认为降水量充足、冷凉的气候、较高的海拔有利于糖分積累。
关键词:党参多糖;提取工艺;优化;生物活性
中图分类号:S567.5 文献标志码:A 文章编号:1001-1463(2021)11-0004-08
doi:10.3969/j.issn.1001-1463.2021.11.002
Extraction Method and Biological Activity of Polysaccharides from Codonopsis pilosula in Different Regions of Gansu
XU Meirong 1, 2, LI Xiaorong 1, 2, DING Wenjiao 1, 2, TAO Haixia 1, 2, QI Yonghong 3, LI Ting 1, 2
(1. Institute of Agricultural Quality Standards and Testing Technology, Gansu Academy of Agricultural Sciences, Lanzhou Gansu 730070, China; 2. Animal Husbandary, Pasture and Green Agriculture Institute, Gansu Academy of Agricultrual Sciences, Lanzhou Gansu 730070, China; 3. Institute of Plant Protection, Gansu Academy of Agricultural Sciences, Lanzhou Gansu 730070, China)
Abstract:The extraction process of alcohol-soluble polysaccharide on Codonopsis pilosula was optimized by orthogonal tests, and its biological activity was studied. The optimal extraction conditions were the ratio of solid-to-liquid was 1∶20 g/mL, temperature 65 ℃, extraction time 4.5 h, and ultrasonic assisted extraction cofactor and extraction number was two times, polysaccharide yield reached 26.25±1.02%. Chemical composition analysis showed that the total sugar, protein and glyuronate content of Codonopsis pilosula polysaccharide were 805 g/kg, 31~66 g/kg and 2.1 g/kg, respectively. In vitro antioxidant assays demonstrated that Codonopsis pilosula polysaccharide had good clearance on ABTS+, DPPH and HO- at a concentration of 2 mg/mL. By comparing the content of codonopsis pilotica polysaccharide in different regions, sufficient rainfall, cold climate and high altitude were conducive to polysaccharide accumulation.
Key words:Codonopsis pilosula polysaccharide;Extraction process;Optimization;Biological activity
党参[Codonopsis pilosula(Franch.) Nannf.]适宜在土层深厚、质地疏松、肥沃的凉爽湿润环境中种植,主产于甘肃、山西、陕西、四川、湖北等省[1 ],有潞党、台党、凤党、纹党、条党及东党等[2 - 3 ]。除临床上使用于中药饮片外,民间还常用于保健,用来炖肉、煲汤。作为药食同源的中药材,党参所含的成分主要有多糖、皂苷、甾醇、三萜、生物碱、倍半萜及香豆素类等,其中多糖含量最多[2 - 8 ]。多糖通过提高抗氧化酶活性或清除有机体中的自由基从而表现出抗氧化、抗肿瘤和免疫调节活性的功能[9 - 11 ],因此人们越来越关注天然植物多糖的提取和优化,以获得更高的产量和更强的生物活性,如连续提取[12 - 13 ]、纤维素酶辅助提取和超声—微波协同提取[12 ] 。目前普遍采用的多糖提取方法主要是水提和乙醇沉淀[14 ],但这种方法会损失部分醇溶性多糖。
党参在甘肃属于大宗中药材。我们采用岷县、渭源县、西和县3个不同區域、不同年间所产的党参样品,从中提取和纯化醇溶性多糖(党参多糖),并用单个条件优化提取过程试验和正交试验设计,进行了党参多糖在体外的抗菌和抗氧化活性的研究,以期为其实际应用提供参考。
1 材料和方法
1.1 材料
供试党参采自甘肃省岷县麻子川镇、渭源县会川镇、西和县洛峪镇。抗坏血酸(Vc)、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)购自Sigma-Aldrich(St.Louis,MO USA)。其他试剂均为分析纯。
1.2 党参多糖(CDP)的制备
将党参低温抽真空干燥并粉碎获得均匀样品。每种预处理样品(5.0 g)用指定的固液比,提取温度和提取时间(表1)。提取后,使用真空旋转蒸发器在60 ℃浓缩上清液,并在4 ℃下加入4倍体积乙醇沉淀8 h以上,弃去沉淀物,除去乙醇收集上清液。经透析(截流分子量,MWCO,600 Da)、超滤(MWCO,10 kDa)后的液体用真空冷冻干燥器冻干以获得党参粗多糖。党参多糖产率计算公式如下:
CDP =(M1/M2)×100%
式中,CDP为多糖产率,M1为党参多糖重量(g),M2为党参称样量(g)。
1.3 单因素试验设计
固液比、提取时间、提取温度用党参预处理粉末进行党参多糖产量和时间单因素试验设计。每个因素都为当其他因素保持不变时进行优化。测定这些因子的初始常数值为固液比为1∶20(g/mL)、提取时间为3.0 h、提取温度为70 ℃,提取次数为3次。每个试验做3个平行。
1.4 党参多糖提取的优化
使用正交L9(4)3测试设计研究党参多糖的最佳提取条件实验。在目前的研究优化方案中增加了辅助因子,包括微波辅助、热水和超声波辅助提取。因此,提取实验分为4个因子和3个等级(表1),即固液比,提取温度,提取时间和辅助因子。党参多糖的产率是因变量。
1.5 党参多糖的化学成分分析
用以葡萄糖为标准的苯酚-硫酸法测定总糖含量,用考马斯亮蓝法测定蛋白质含量,用咔唑-硫酸法测定糖醛酸的含量[15 - 18 ]。
1.6 体外抗氧化活性
党参多糖对DPPH自由基的清除活性根据张培等[19 ]的报告进行评估。根据陈林 等[20 ]的方法,ABTS可用作评估党参多糖抗氧化活性。通过Fen-ton反应对羟自由基清除活性进行评估[21 ]。将1.2制备的党参多糖分别配制成浓度为2、4、6、8、10 mg/mL溶液,备用。
1.6.1 清除DPPH自由基能力的测定 称取一定量的DPPH,用无水乙醇配制成0.04 mg/mL的DPPH溶液。分别取2 mL不同浓度(2,4,6,8 mg/mL)的多糖溶液,加入2 mL DPPH溶液,混合均匀。室温放置30 min后,5 000 r/min离心10 min。取上清液于517 nm处测吸光值。用Vc作为阳性对照。样品对DPPH自由基的清除率用以下公式计算:
DPPH清除率=[1-(A1-A2)/A0]×100%
式中,A0为2 mL无水乙醇+2 mL DPPH溶液的吸光值;A1为2 mL多糖溶液+2 mL DPPH溶液的吸光值;A2为2 mL多糖溶液+ 2 mL无水乙醇的吸光值。
1.6.2 清除ABTS自由基能力的测定 将 7 mmol/L ABTS溶液与 4.8 mmol/L 亚硫酸钾溶液等体积混合,在室温下避光放置 12~16 h,即得 ABTS 自由基储备液。把ABTS自由基储备液稀释到734 nm 处的吸光度(A734)为 0.700±0.001,作为工作液。浓度为2、4、6、8、10 mg/mL多糖溶液分别稀释为0.2、0.4、0.6、0.8、1.0 mg/mL,在10 mL 具塞试管中分别吸取稀释后的粗多糖溶液 0.2 mL, 加入 3.8 mL ABTS 工作液, 摇匀后于室温静置 6 min,然后测定溶液的 A734值。通过下式计算粗多糖样品对 ABTS 自由基的清除率,绘制 ABTS 自由基清除率(Y)与样品质量浓度(X)的关系曲线.
Y=[1-(B1-B2)/B0]X×100%
式中,B1为加入粗多糖溶液时的吸光度;B2 为等体积的蒸馏水代替 ABTS 溶液时的吸光度;B0为等体积的蒸馏水代替粗多糖溶液时的吸光度。
1.6.3 总还原能力的测定 在10 mL具塞试管中加入 0.2 mol/L 磷酸盐缓冲液(PBS,pH 6.6)1.0 mL、1%(质量分数)铁氰化钾溶液1.0 mL、分别加入0.2、0.4、0.6、0.8、1.0 mg/mL的粗多糖溶液 0.25 mL, 混匀后在 50 ℃下反应 20 min,再加入10%(质量分数)三氯乙酸溶液 1.0 mL, 振荡混匀,4 000 r/min 离心 10 min。取上清 2.5 mL,再加入 2.5 mL 蒸馏水和 0.1%(质量分数)氯化铁溶液 0.5 mL,静置 10 min, 待溶液由黄色变为蓝色后测定 700 nm 处的吸光度(A700)[22 ]。空白组以等体积蒸馏水代替粗多糖溶液。
利用 线 性 回 归 方 程 y=0. 054x+0.044(R2=0.997)计算在上述测定方法下 A700= 0.485 时对应的样品质量浓度,以此表示还原能力[19, 23 ]。
1.6.4 对 O2-清除能力的测定 参照陈林 等[20 ]的方法并作一定调整。分别准确吸取1.0 mL不同浓度的多糖溶液(0.2、0.4、0.6、0.8、1.0 mg/mL),加入9 mmol/L硫酸亚铁溶液和水杨酸-乙醇溶液各1.0 mL,再加入8.8 mmol/L过氧化氢(H2O2)溶液1.0 mL,混匀后在37 ℃下反应1 h,于510 nm处测定吸光度。通过以下公式计算粗多糖样品对羟自由基的清除率, 绘制羟自由基清除率 (Y) 与样品质量浓度(X) 的关系曲线。
Y=[1-(A1-A2)/A0]X×100%
式中:A0为样品空白组吸光值;A1为样品组吸光值;A2为对照组吸光值。
1.7 统计分析
所有值均表示为三个取样地平均值±标准偏差(±标准差)。 用单因素方差分析(ANOVA)分析差异的显著性。 通过t检验进行比较,置信水平P < 0.01为极显著。
1.8 甘肃不同地区党参多糖含量的比较
将2017 — 2019年采自岷县麻子川镇、渭源县会川镇、西和县洛峪镇的党参粉末各称取1.000 g,加入已编号的具塞试管中,按照正交试验筛选出的提取工艺提取党参多糖,进行含量测定和数据分析。
2 结果与分析
2.1 单因素实验分析
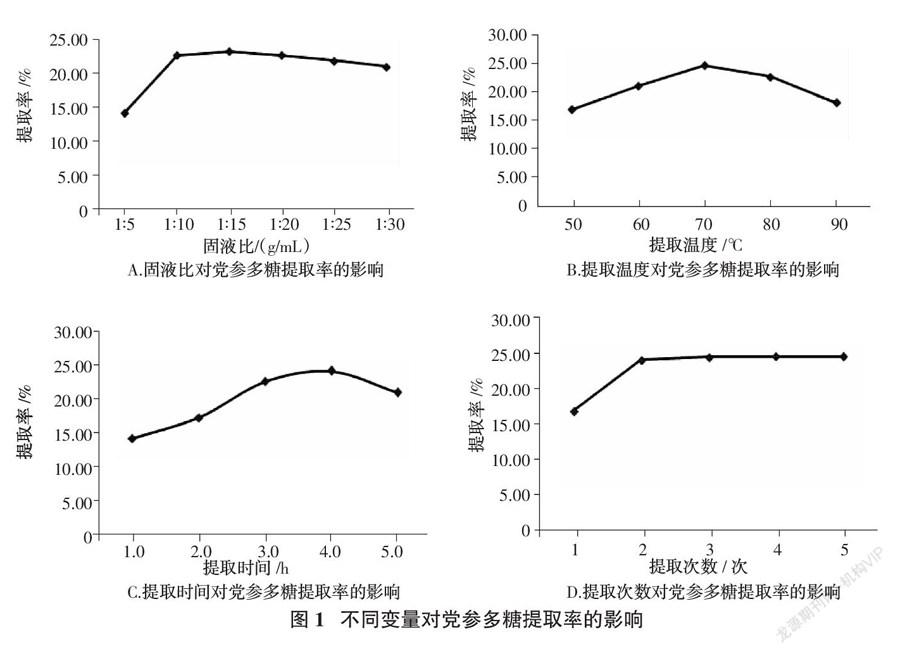
试验对党参多糖得率的固液比、提取时间、提取温度和提取次数等关键参数进行优化分析。如图1 A所示,固液比对党参多糖得率的影响为1∶5~1∶30(g/mL),提取时间为3.0 h,提取温度为70 ℃、提取次数为2次时,固液比从1∶5增加到1∶15,党参多糖的提取率显著提高,但从1∶15增加到1∶30时,提取率逐渐降低。这可以解释为较大的固液比有利于更多目标组分浸出到水中,可以提高提取率。然而,大量的提取溶剂会导致能量浪费,工作量增加和多糖的损失。因此,选择1∶15为最佳固液比,用于下一步试验。
提取温度是影响多糖提取率的重要因素之一[15 ]。设定固液比为1∶15 g/mL,提取时间3.0 h、提取次数2次的条件下,研究了提取温度从50 ℃升高到90 ℃时对党参多糖产率的影响。图1 B表明,当提取温度从50 ℃升高到70 ℃时,党参多糖的产率迅速增加,而在70 ℃以上时党参多糖的产率开始下降。有研究证明,高提取温度可以提高多糖的溶解度和加速水溶性多糖的质量传递,而过高的温度可能导致多糖的氧化和热降解,也是降低党参多糖产量的主要因素。因此,试验确定的最佳提取温度为70 ℃。
提取时间是影响多糖提取率的另一个参数。在固液比为1∶15 g/mL、提取温度70 ℃、提取次数2次的条件下,研究了不同提取时间对多糖产率的影响。如图1 C所示,党参多糖的产量在4.0 h时达到峰值,然后随着提取时间的延长而降低。这是因为过度延长的提取时间会导致多糖的热不稳定或水解,这会降低多糖的产率[24 ]。因此,选择4.0 h作为随后党参多糖优化的最佳提取时间。
在固液比为1∶15 g/mL,提取温度为70 ℃和提取时间3.0 h的条件下,测试了不同提取次数的多糖提取率,如图1 D所示。随着提取次数的增加,党参多糖的提取率急剧增加,然后趋于平缓。考虑提取率和试剂损耗,选择提取2次为最佳提取次数。
2.2 正交试验优化党参多糖萃取分析
热水提取是最基本和广泛使用的多糖提取方法。微波可以快速提高萃取温度,提供更高的离子运动,这可能会显著影响萃取效率,因此高效率的微波辅助提取也已被用于从各种植物材料中提取多糖[25 ]。超声波辅助萃取利用空化气泡的破裂会导致植物细胞壁的破坏,从而加速物质从植物溶解到液体溶液中。与传统的提取方法相比,可以在相同的提取时间和能量消耗下获得更多的化合物,已被广泛应用于从植物材料中提取制备各种生物活性化合物[10 ]。
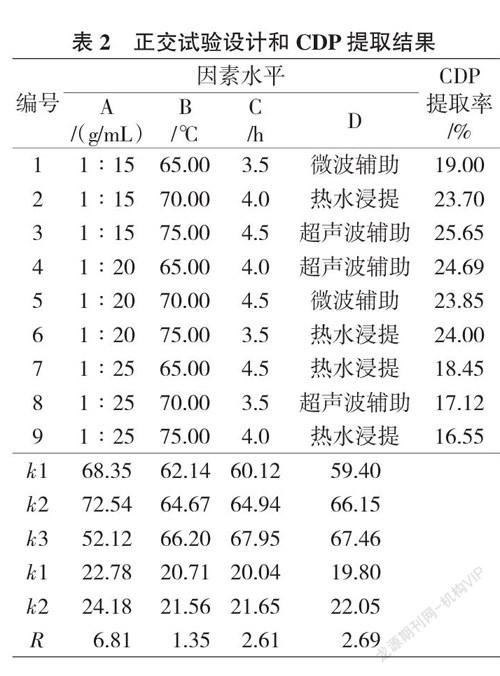
黨参多糖提取的优化结果见表2,党参多糖的产率范围为16.55%(A3B3C2D1)至25.65%(A1B3C3D3)。ki是每个因子的i水平下的测试结果的平均值,R是ki的范围。R值与该因子对党参多糖产率的影响呈正相关,可以看出固液比对党参多糖提取结果的影响最大。最大值ki表明i是提取条件的最佳水平。在本研究中,党参多糖提取的最佳组合为A2B3C3D3(固液比为1∶20 g/mL)、提取温度75 ℃、提取时间4.5 h、辅助因子为超声辅助提取的),在这些条件下,得出党参多糖的产率为(26.25±1.02)%(N=3),高于A1B3C3D3的25.65%。
2.3 正交结果的方差分析
从方差分析结果可知(表3),提取过程中重要的因素是辅助因素、提取温度、提取时间,固液比在党参多糖上具有非显著的相互作用,这与以前的数据一致。
2.4 党参多糖的理化特性
纯化后,党参多糖中总糖、蛋白质、糖醛酸的含量分别为805、31~66、2.1 g/kg,表明党参多糖是含有少量蛋白质和糖醛酸的中性多糖。
2.5 党参多糖的抗氧化活性
从试验结果可知,2 mg/mL的党参多糖对ABTS+、DPPH、HO-的清除率分别为61.2%、90.3%、49.2%,而Vc作为阳性对照,在相同浓度下的ABTS+、DPPH、HO-清除率分别为99.8%、98.7%、83.2%。表明党参多糖在体外具有优异的抗氧化活性,并可在未来作为自由基抑制剂或清除剂。
DPPH是一种稳定的自由基,一般用于评估各种生物活性化合物的抗氧化活性[26 ],以及ABTS自由基[19 ]。活性氧(ROS)包括超氧阴离子和羟基自由基衍生自氧化代谢,主要产生于线粒体[19 ]。ROS通过在正常情况下参与各种信号转导可以调节细胞生长,增殖和分化等,但ROS的过量产生会导致氧化应激并引起各种疾病[27 ]。而抗氧化剂在清除自由基和防止由它们引起的损害方面发挥重要作用,目前需要进行广泛研究。
2.6 甘肃省不同产地党参多糖的含量比较
从表4可知,3个不同产地党参多糖含量从大到小依次为岷县麻子川镇、渭源县会川镇、西和县洛峪镇;取样时间为2017、2018、2019年。其中2017年降水较多,全年不同产地降水量为400~600 mm,2018、2019年各地降水量均少于2017年。
从表4可知,2017 — 2019年间,3个产地的党参多糖含量差异较大,2017年产自岷县麻子川的党参多糖含量最高,为365 g/kg,2018年西和县洛峪镇最低,为287 g/kg。在3 a平均降水量下,可明显看到岷县麻子川的党参多糖含量相比其他地区较高,都在330 g/kg以上,渭源县会川镇次之,西和县洛峪镇相对较低。这可能是由于光照、土壤、降水量以及海拔等条件不同造成的。渭源县会川镇、岷县麻子川镇气候条件相对西和县洛峪镇冷凉,且土壤含有丰富的矿物质,降水量足,冷凉的气候及较高的海拔可能有利于糖分积累[28 - 31 ]。2017 — 2019年,降水量充足的年份多糖含量比降水量少的年份偏高。
3 结论
本研究通过单因素试验和正交试验设计优化党参多糖提取工艺,并对党参多糖理化特性及抗氧化活性进行了研究。 党参多糖提取的最优试验条件为固液比为1∶20 g/mL,提取温度为75 ℃,提取时间为4.5 h,超声辅助提取的辅助因子和提取次数为2次。在这些条件下,党参多糖的产率为26.25±1.02%。化学成分分析表明,党参多糖中总糖、蛋白质和糖醛酸含量分别为805、31~66、2.1 g/kg。体外抗氧化试验结果表明,在浓度为2 mg/mL时,党参多糖对ABTS+、DPPH、HO-的清除率分别为61.2%、90.3%、49.2%,具有良好的清除作用。说明党参多糖可以作为食品和医药行业的抗肿瘤和抗氧化剂补充剂。
研究还表明,土壤含有丰富的矿物质、降水量充足、冷凉的气候及较高的海拔可能有利于党参的糖分积累。
参考文献:
[1] 王 艳. 甘肃省党参病害种类调查及病原鉴定[J]. 山西农业科学,2011,39(8):866-868;871.
[2] 刘恩荔,秦雪梅. 党参研究进展[J]. 山西医科大学学报,2002,33(6):567-569.
[3] 朱恩圆,贺 庆,王峥涛,等. 党参化学成分研究[J]. 中国药科大学学报,2001,32(2):94-95.
[4] 王晓华,单铁英,侯永超,等. 枸杞多糖增强效应 T 细胞增殖和杀瘤活性机制的研究[J]. 中国实验诊断学,2010(12):699-701.
[5] 杜小燕,侯 颖,覃 华,等. 绞股蓝多糖的抗肿瘤作用及其机制研究[J]. 科学技术与工程,2009(20):5968-5972.
[6] 孙文平,罗 红,杨 光,等. 当归多糖激发免疫反应的特征研究[J]. 大连医科大学学报,2009(3):262-264.
[7] 吴 彦,吴甘霖. 半枝莲多糖抗补体活性研究[J]. 中国实验方剂学杂志,2009(5):49-52.
[8] 许爱霞,张振明,葛 斌,等. 党参多糖抗衰老作用机制的实验研究[J]. 中国现代应用药学杂志,2006,23(8):729-731.
[9] 張晓君,祝晨蔯,胡 黎,等. 党参多糖对小鼠免疫和造血功能的影响[J]. 中药新药与临床药理,2003,14(3):174-176.
[10] 张 涛,杨婉羚,曹 喻,等. 党参多糖的分离纯化及抗衰老作用研究[J]. 江苏农业科学,2018,46(23):235-237.
[11] BAI R B,LI W Y,LI Y D,et al. Cytotoxicity of two water-soluble polysaccharides from Codonopsis pilosula Nannf. var. modesta(Nannf.)L. T. Shen against human hepatocellular carcinoma HepG2 cells and its mechanism[J]. Int. J. Biol. Macromole,2018,120:1544-1550.
[12] 姜丽娜,于洪波,于洪波. 百日草的体外提取[J]. 国际生物大分子杂志,2005,37(4):195-199 .
[13] 刘美霞,戚 进,余伯阳. 党参药理作用研究进展[J]. 海峡药学,2018,30(11):36-39.
[14] 秦 楠,崔 政,刘丽君,等. 党参多糖提取工艺优化及其保健醋饮料的研制[J]. 食品工业科技,2018,39(12):210.
[15] 王晓霞,庄鹏宇,陈金铭,等. 党参化学成分的研究[J]. 中草药,2017,48(9):1719-1723.
[16] 于 玲,范罗嫡,胡明华,等. 甘肃不同产地党参 HPLC 指纹图谱研究[J]. 海峡药学,2018,30(10):38-40.
[17] KIM E Y,KIM J A,JEON H J,et al. Chemical fingerprinting of Codonopsis pilosula and simultaneous analysis of its major components by HPLC-UV[J]. Arch. Pharm. Res.,2014,37(9):1148-1158.
[18] 白瑞斌,马玉玲,张 培,等. 苯酚-硫酸法结合校正因子法测定含半乳糖醛酸的多糖中的糖含量[J]. 中国药房,2017,28(21):2974-2978.
[19] 张 培,郑晓萍,马玉玲,等. 党参多糖单糖组成与其对 HepG2 细胞毒活性的相关分 析[J]. 中草药,2016,47(15):2684-2692.
[20] 陈 林,孟瑞丽,周 浓,等. 山西潞党参皂苷提取工艺 优化及抗氧化活性分析[J]. 黑龙江畜牧兽医,2017(1):42-46.
[21] 黄积武,李创军,杨敬芝,等. 三七叶的化学成分及其抗氧化活性研究[J]. 中草药,2017,48(21):4381-4386.
[22] 李启艳,祝清芬,刘春霖,等. 党参多糖分离纯化及抗氧化活性研究[J]. 中草药,2017,
48(5):907-912.
[23] 胡建燃,郭 阳,李 平. 潞党参多糖的提取及其抗氧化活性分析[J]. 中国食品添加剂,2016(7):93-96.
[24] 冯亚静,王晓霞,庄鹏宇,等. 党参的化学成分研究[J]. 中国中药杂志,2017,42(1):135-139.
[25] 任丽靖,张 静,刘志存,等. 党参多糖的分离纯化及其结构研究[J]. 中成药,2008,
39(7):986-989.
[26] 马 铭,白瑞斌,刘景龙,等. 3 种党参提取物体外抗氧化活性探究[J]. 中成药,2020,
42(9):2514-2517.
[27] 张立军,王国祥,蔡子平,等. 不同产地党参主要有效成分研究综述[J]. 甘肃农业科技,2020(12):65-69.
[28] 李成义,刘书斌,李 硕,等. 甘肃党参栽培现状调查分析[J]. 中国现代中药,2016,
18(1):102-105.
[29] 吴洁荣,尹文仲,吴瑞云. 恩施板桥党参的质量特征与产地自然条件[J]. 中南民族大学学报(自然科学版),2009,28(2):57-60.
[30] 吴晓俊,张小波,郭兰萍,等. 党参药材分布区划研究[J]. 中国中药杂志,2017,42(22):4368-4372.
[31] 栾 青,郭建平,马雅丽,等. 晋东南潞党参生态气候适生种植区劃[J]. 生态学杂志,2020,39(9):2953-2962.
(本文责编:陈 珩)
收稿日期:2021 - 09 - 08
基金项目:国家重点研发项目(2018YFD0201100);甘肃省重点人才项目(2019RCXM072);甘肃省农业科学院重点研发计划(2020GAAS30、2020 GAAS25)。
作者简介:徐美蓉(1978 — ),女,甘肃临夏人,实验师,硕士,主要从事农产品质量安全检测研究工作。Email:547101748qq.com。
通信作者:李晓蓉(1964 — ),女,甘肃景泰人,副研究员,主要从事农产品质量安全检测研究工作。Email:lxr870906@sina.com。

