脂多糖预处理的牙囊细胞外泌体对牙周炎牙周膜细胞成骨分化的影响
石维薇, 丁一, 田卫东, 郭淑娟
1.口腔转化医学教育部工程研究中心四川大学,四川成都(610041); 2.口腔再生医学国家地方联合工程实验室四川大学华西口腔医院,四川成都(610041); 3. 口腔疾病研究国家重点实验室国家口腔疾病临床医学研究中心四川大学华西口腔医院牙周病科,四川成都(610041); 4. 口腔疾病研究国家重点实验室国家口腔疾病临床医学研究中心四川大学华西口腔医学院创伤与整形外科,四川成都(610041)
牙周炎是以牙周支持组织炎症和破坏为特征的感染性疾病。牙周治疗终目的是牙周支持组织的再生与功能重建。牙囊细胞(dental folic cells,DFCs)自我增殖能力强,具有多向分化的潜能,可分化为成骨细胞、成牙骨质细胞、牙周膜细胞(periodontal ligament cells,PDLCs),利于牙周软硬组织的再生与重建,是牙周组织再生工程中研究较为广泛的种子细胞[1]。本课题组前期研究发现牙龈卟啉单胞菌来源的脂多糖(lipopolysaccharide,LPS)对DFCs 以及PDLCs 的分化作用是不同的。当LPS预处理DFCs 24 h 后,DFCs 膜片能够上调成骨、成纤维相关基因如碱性磷酸酶、骨钙素、Ⅲ型胶原(Collagen Ⅲ,Col Ⅲ)的表达,同时对黏附相关基因骨膜蛋白的表达无影响;然而,经LPS 刺激后的PDLCs 膜片则表现为成纤维、成骨以及黏附相关基因表达的下调,不利于牙周组织再生。因此,DFCs相较于PDLCs 具有抵抗LPS 刺激调节炎性微环境的能力,利于分化形成完整的牙周组织结构[2]。然而,LPS 预处理后的DFCs 促进牙周组织再生的机制尚不明确。外泌体是由细胞分泌的胞外囊泡,直径为30~100 nm,主要以内出芽的形式产生[3]。与细胞分泌的生长因子不同的是外泌体包裹着丰富的来源细胞的蛋白质、核糖核酸、微小核糖核[4],具有靶向性,并且这些重要组份使外泌体在疾病的免疫调控[5]、组织损伤修复[6]以及临床疾病检测与诊断[7]等过程中发挥重要作用。近期研究发现,间充质干细胞(mesenchymal stem cells,MSCs)可以通过旁分泌机制分泌外泌体替代MSCs 发挥促进组织缺损修复及骨再生的作用[8]。本实验旨在探究LPS 预处理DFCs 分泌的外泌体(LPS pretreated DFCs derived exosomes,L-Exos)浓度在10 μg/mL 以及100 μg/mL 时对牙周炎患者的牙周膜细胞(periodontal ligament cells of periodontitis,p-PDLCs)成骨分化功能的影响。为L-Exos 作为替代细胞疗法用于牙周组织再生提供实验基础。
1 材料和方法
1.1 主要材料和试剂
胎牛血清(Gibco,美国);α-MEM 完全培养液(GE Healthcare Life Sciences,美国);青链霉素(Solarbio,中国);胰蛋白酶(Millipore,美国);I 型胶原酶(Sigma,美国);Trizol(Invitrogen,美国);茜素红(Sigma,美国);CD31、CD34、CD73、CD90、CD106、CD146 和Actin 抗体(Abcam,美国);CD63 和Alix 抗体(正能,中国);超滤管(Millipore,美国);外泌体提取试剂盒(Invitrogen,美国);扫描透镜(HT7700 TEM,日本);纳米粒度及Zeta 电位分析仪(Malvern Instruments,英国);高速离心机(Backman,美国);Thermo Micro 21R 台式冷冻离心机(Eppendorf,德国)。本研究获得四川大学华西口腔医院伦理委员会批准,患者知情同意。
1.2 细胞培养与鉴定
1.2.1 DFCs 组织块酶消化法培养 取12~20 岁健康受试者需要拔除的未发育完全的智齿。收取包裹于牙冠的牙囊组织,置于10%双抗磷酸缓冲液(phosphate buffer saline,PBS)中洗净,剪成0.5~1.0 mm 的细碎组织块,Ⅰ型胶原酶消化30 min,离心,弃上清,用含10%胎牛血清(fetal bovine serum,FBS)以及2%双抗的α-MEM 完全培养基洗涤,重悬。将组织平铺于T25 小瓶中,滴加少量含15%FBS 的α-MEM 培养基,置细胞孵箱中(5%CO2,37 ℃),24 h 后将培养基加至2 mL。每3 d 换液1次,应用倒置显微镜观察细胞状态,当细胞生长至60%~80%时用0.25%的胰蛋白酶消化传代,取第5代用于后续实验。
1.2.2 p-PDLCs组织块酶消化法培养 取40~60岁被诊断为慢性牙周炎的患者需要拔除的牙(牙周探诊深度大于4 mm,探诊出血且存在附着丧失),患者知情同意。拔除后置于10%含双抗的PBS 中,洗净。刮取收集根中1/3牙周膜组织于I型胶原酶中消化20~30 min,离心,用α-MEM 培养基洗涤,重悬,均匀平铺于小皿中,滴加少量15%FBS 的α-MEM 培养基,置细胞孵箱中(5%CO2,37 ℃),24 h 后将培养基缓慢加至2 mL。当细胞生长至80%时用0.25%的胰蛋白酶消化传代,取第3代用于后续实验。
1.2.3 DFCs 细胞表型鉴定 选用P3 代的DFCs,计数,细胞悬液分装至1.5 mL 的EP 管中,浓度为2 × 105个/200 μL,含2%FBS 的PBS 洗涤2 次后,每个离心管中加入2 μL 的CD31、CD34、CD73、CD90、CD106 和CD146 抗体在4 ℃下避光孵育1 h,含2%FBS 的PBS 洗涤2 遍。细胞悬液通过200 目的细胞筛,流式细胞仪检测。
1.3 LPS 刺激DFCs 并提取外泌体进行鉴定
P5 代的DFCs 置于T75 大瓶中培养至80%时,加入250 ng/mL LPS 24 h,PBS 清洗2 遍后,加入无血清培养48 h,收取细胞上清于50 mL 离心管中。于3 000 g 离心30 min,接着采用0.22 μm 的滤器过滤收集的上清,将过滤后的上清(分子粒径< 220 nm)置于100 KD 的超滤管中,5 000 g/min 离心30 min,得到分子粒径为30~220 nm 的上清浓缩液,并置于-80 ℃冰箱备用。浓缩液按2∶1 的体积加入外泌体提取试剂,充分混匀,4 ℃孵育过夜,10 000 g/min 离心60 min,沉淀即为L-Exos。将离心后得到的白色沉淀溶于生理盐水后,2%戊二醛固定1 h,进行透射电子显微镜(transmission electron microscope,TEM)观察外泌体的结构;纳米颗粒追踪分析(nanoparticle tracking analysis,NTA)技术分析外泌体粒径分布范围;蛋白印迹(Western Bolt)法检测其表面标记物。
外泌体溶解在RIPA裂解缓冲液中,通过BCA方法计算蛋白总量后,将裂解液与蛋白缓冲液按比例混合,最终将浓度调至为1 μg/μL[9]。将封闭后的膜分别与CD63(1∶1 000,Zen Bioscience,China,615509)、Alix(1∶1 000,Zen Bioscience,China,341000)和Actin(1∶1 000,Abcam,ab3280)的一抗在4 ℃过夜,然后在室温下二抗孵育1 h,进行检测。
1.4 经LPS 刺激DFCs 后的外泌体对p-PDLCs 的分化影响
1.4.1 RT-PCR P3 代的p-PDLCs 以5 × 105个细胞/孔的细胞数接种至12 孔板,待细胞贴壁至60%约24 h 后,将L-Exos 重悬于培养基中分别以10、100 μg/mL 的浓度加入p-PDLCs 中(对照组加入相应剂量的PBS),在诱导7 d 后,每孔加入500 μL Trizol 裂解液,分离提取RNA,并逆转录为cDNA[10]。利用RT-PCR 仪进行荧光定量检测分化相关基因:Periostin、Ⅰ型胶原(Collagen Ⅰ,Col Ⅰ)、Col Ⅲ、转化生长因子-化(transforming growth factorβ1,TGF-β1),引物序列见表1。

表1 引物序列Table 1 Primer sequence
1.4.2 L-Exos对p-PDLCs成骨的影响 将P3代的p-PDLCs 分别以5×105个细胞/孔接种于12孔板中,待细胞贴壁至60%约24 h后,将L-Exos重悬于成骨诱导培养基中分别以10、100 μg/mL的浓度加入p-PDLCs中。7 d 后,弃上清,PBS 洗涤,4%多聚甲醛固定15 min,按参照文献方法[11]进行茜素红染色、矿化结节的观察以及半定量分析。其中成骨诱导液为含5 mmol/L β-甘油磷酸钠、50 μg/mL 维生素C、100 mmol/L 地塞米松、10%FBS 的α-MEM 培养液。
1.5 统计学方法
采用SPSS 26.0 软件进行统计学分析,多组均值的比较采用单因素方差分析,组间比较运用Bonferroni 法进行两两比较,检验水准α=0.05。
2 结 果
2.1 DFCs 与p-PDLCs 的培养
在DFCs 分离培养3 d 后,细胞开始从组织块中缓慢爬出,爬出的细胞以组织为中心呈放射状向周围排列,长梭形,胞体饱满,偶有散在上皮团从组织块分离,10 d 后多处组织块中大部分的细胞已分离爬出,细胞生长汇合达培养瓶的60%~70%(图1a)。p-PDLCs分离培养4~7 d后开始有少量p-PDLCs 迁移出组织块,无序排列,为典型的成纤维样。15~20 d 后爬出的细胞增多,呈旋涡状或放射状细胞簇散在铺于培养皿(图1b)。

Figure 1 The cell culture of DFCs and p-PDLCs图1 牙囊细胞和牙周炎患者的牙周膜细胞原代培养
2.2 DFCs 的鉴定
DFCs 的表面标记物CD73、CD90、CD146 阳性表达,并且CD31、CD106、CD34 显示阴性,因此分离培养的DFCs 来源于间充质干细胞,并非造血干细胞来源(图2)。

Figure 2 Flow cytometry analysis for DFCs图2 DFCs 的流式细胞术分析
2.3 外泌体的鉴定
L-Exos 是直径为30~100 nm 的囊泡样结构,囊泡周缘可观察到脂质双分子层(图3a)。将白色沉淀溶于生理盐水后,纳米颗粒追踪分析结果如图3b 示,所提取的L-Exos 直径大小的峰值主要分布在100 nm 左右。运用Western Blot 检测囊泡表面标记物CD63 、外泌体特有标记物ALG-2 相互作用蛋白X(ALG-2-interacting protein X,Alix)以及细胞的表面标记物肌动蛋白水平,结果显示提取物强阳性表达CD63 和Alix,不表达细胞表面标记物Actin,而对照组细胞的结果则与之相反(图3c)。进而证明,该方法提取的分离物为外泌体。
2.4 L-Exos 对p-PDLCs 成骨向分化的影响
RT-PCR检测Periostin、Col Ⅰ、Col Ⅲ、TGF-β1的表达,10、100 μg/mL L-Exos组中Periostin和Col Ⅰ的表达均高于对照组(P<0.05),且浓度为100 μg/mL时的表达量更高;Col Ⅲ在100 μg/mL 外泌体组的表达为对照组以及10 μg/mL 外泌体组的2 倍(P <0.01),而TGF-β1 的表达则在10 μg/mL 外泌体组呈现出最高的表达量(P<0.01,图4)。
细胞茜素红染色结果显示,与对照组比较,10、100 μg/mL 浓度的外泌体组均可见到茜素红染料标记的阳性矿化结节(F=237.761,P<0.01),且100 μg/mL 外泌体组钙结节数量多于10 μg/mL 组(P<0.01,图5)。
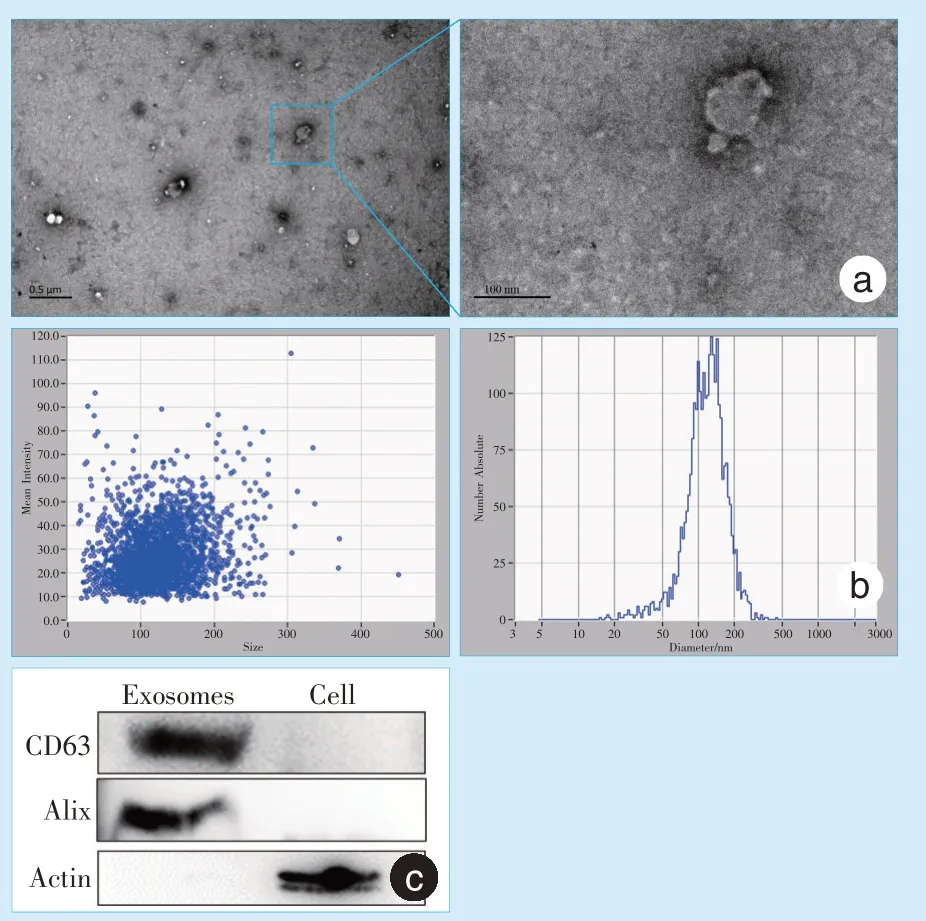
Figure 3 Identification of exosomes图3 外泌体的鉴定

Figure 4 The expression of L-Exos-induced p-PDLC osteogenic and adhesion-related genes was detected by RT-PCR图4 RT-PCR 检测L-Exos 对p-PDLCs 成骨相关基因表达
3 讨 论

Figure 5 Alizarin red staining and quantitative analysis of L-exos-induced p-PDLC osteogenesis induction after 7 d图5 L-Exos 对p-PDLCs 成骨诱导7 d 茜素红染色及半定量分析
越来越多的研究表明MSCs 除了通过自我增殖分化加速组织修复外,还可通过其分泌外泌体等调节内源性干细胞分化、增殖从而促进受损的组织的愈合[12]。基于目前的研究,外泌体的提取方法主要为蔗糖-密度梯度离心法、超速离心法、超滤法以及商品化试剂盒法(类似于聚合物沉淀)等[13]。由于目前外泌体提纯技术的局限性,无论是超速离心法还是试剂盒法提取的外泌体均可能含有小的细胞外囊泡或其他成分,如同等大小的脂质体、蛋白质等,而不是单纯的外泌体[14]。因此针对提取方法的选择问题,国际细胞外囊泡协会指出提取方法的选择应以所需的囊泡纯度和浓度为指导[13]。本实验旨在初步探究牙囊细胞外泌体对p-PDLCs 的作用,因此选用商品化的试剂盒作为本实验外泌体的提取方法。在本研究中,透射电镜结果显示外泌体形态大小不一,直径在30~100 nm 之间,具有脂质双分子层结构,NTA 检测外泌体粒径分布发现外泌体样本大小峰值在100 nm,这些特性同先前文献结果是一致的[15]。此外,根据蛋白质组学研究,与细胞相比,外泌体特异性表达四跨膜蛋白,如CD63、肿瘤易感基因101 蛋白(tumor susceptibility gene 101,TSG101)、Alix 等[15]。本实验Western Blot 结果显示提取的外泌体样本高表达CD63、Alix 而不表达Actin,由此认为通过本实验方法提取的是牙囊细胞外泌体。
DFCs在牙发育过程中分化形成牙骨质、牙周膜以及牙槽骨,是形成牙周组织的前体细胞,取材方便,增殖分化能力强,是牙周组织工程中常用的一种种子细胞[1]。同时本课题组的前期研究将牙龈卟啉单胞菌来源的LPS 预处理DFCs 24 h 后其细胞膜片表现出较PDLCs更强的成骨、成胶原能力,更有利于牙周组织再生[2]。然而,LPS 预处理后的DFCs 分泌的外泌体对牙周组织作用的机制尚不明确。
研究表明,MSC 分泌的外泌体可促进组织内源性细胞增殖和分化能力。而目前外泌体对于牙周组织再生的研究是局限的。Jiang 等[16]发现乳鼠切牙MSCs 外泌体在浓度为10 μg/mL 时能明显升高上皮细胞碱性磷酸酶活性,牙本质涎蛋白表达,促进矿化物质形成,效果优于浓度为0.1 μg/mL、1 μg/mL 的MSCs 外泌体。Chew 等[17]将40 μg MSCs外泌体载入胶原海绵中治疗大鼠牙周缺损发现,MSCs 外泌体通过增强PDLCs 的增殖分化功能促进牙周缺损的骨修复,但结果中的牙槽骨的再生效果不佳,而高浓度的外泌体对细胞分化影响尚不明确,如何提高外泌体的效能是急需解决的问题。本研究发现100 μg/mL L-Exos 上调p-PDLCs 成骨相关基因ColⅠ、Col Ⅲ的表达以及黏附相关基因Periostin 的表达。Periostin 是一种基质细胞蛋白,可调节细胞迁移、募集、黏附,表达于各种组织的愈合区域[18],在牙周组织及其周围骨的再生中起重要作用[19]。ColⅠ是最早发现的成骨细胞标志物之一,它在成骨前体细胞中表达上调并沉积为细胞外基质,是早期成骨细胞分化的标志[20]。Col Ⅲ对胶原弹性有重要作用,在组织修复初期Col Ⅲ含量较高,随后逐渐被ColⅠ替代[21]。这些基因的表达水平上调均能调控牙周骨组织再生,增强p-PDLCs的成骨能力。研究表明,TGF-β1 对间充质细胞和某些其他特定细胞类型如牙周膜细胞、成纤维细胞,和成骨细胞等具有增强细胞活性,促进细胞生长的能力[22]。在本实验中,TGF-β1 基因在10 μg/mL L-Exos 组相对表达量明显高于100 μg/mL L-Exos组,这表明在诱导7 d 后,10 μg/mL L-Exos 组p-PDLCs 增殖活性较强,而100 μg/mL L-Exos 组p-PDLCs 成骨向分化能力较强,进而证明100 μg/mL L-Exos 较10 μg/mL L-Exos 具有更强的促进p-PDLCs成骨向分化能力,益于牙周组织再生。
综上所述,本研究发现LPS预处理后的牙囊细胞外泌体具有促进p-PDLCs的成骨向分化能力,并且当外泌体浓度为100 μg/mL时较10 μg/mL效果更佳,为后期实验对外泌体浓度的选择提供研究依据。但仍有很多问题需要后续进一步研究,如动物体内研究以及L-Exos促进p-PDLCs可能存在的机制。
【Author contributions】Shi WW processed and analyzed the data,wrote the article. Ding Y,Tian WD revised the article. Guo SJ designed the study,guided the writing of the article. All authors read and approved the final manuscript as submitted.

