ARNT调控低氧通路促进小鼠骨骼肌再生的实验研究
李玢,张誉腾,鲁峰
南方医科大学南方医院整形美容外科,广州 510515
骨骼肌的损伤修复是临床治疗的一大难题,研究证实低氧通路活性与骨骼肌再生能力密切相关[1]。低氧诱导因子(hypoxia inducible factor,HIF)以及血管内皮细胞生长因子A(vascular endothelial growth factor-A,VEGF-A)等被认为是促进肌肉再生的重要因素[2,3]。当外界氧气含量下降时,活性HIF-1α转移到胞核内,与HIF-1β结合形成特定的低氧应答元件,可以激活下游对血管生成、红细胞生成等重要基因的表达,从而恢复机体微环境的氧代谢平衡[4]。HIF-1α和HIF-2α进入细胞核的过程,以及异二聚体结合诱导缺氧相关基因的表达都是需要与芳基烃受体核转运子(aryl hydrocarbon receptor nuclear translocator,ARNT)相结合的。ARNT即HIF-1β,属于碱性螺旋环螺旋helix-loop-helix(bHLH)-Per-ARNT-Sim家族[5]。ARNT作为一个重要的转录调节器,已经被证实参与器官发生,神经发育,以及胎儿生长受限中的血管化受损,并与癌、糖尿病、黑色素瘤等疾病密切相关[6,7]。但在骨骼肌再生过程中,ARNT的作用尚未得到评估。本课题围绕ARNT在骨骼肌老化及再生过程中的作用及机制进行深入研究,探索改善骨骼肌再生能力的方法。
1 材料和方法
1.1 材料
1.1.1 实验动物 幼龄组C57BL/6小鼠48只(8~10周、雌雄各半),老龄组C57BL/6小鼠48只(22~24个月、雌雄各半)。环境恒温、恒湿,每笼饲养小鼠不超过5只,12 h昼夜规律交替,小鼠可随意取食、饮水。
本实验使用了可诱导的Cre-lox小鼠品系。ARNTfl/fl小鼠曾被用作高效敲除组织特异性的ARNT相关实验的动物模型[8]。首先,将转基因的老鼠品系ARNTfl/fl小鼠与可调控的、其骨骼肌中表达含人骨骼肌肌动蛋白α-actin(HSA)-Cre ER基因的Cre小鼠进行杂交,获得一个新的转基因小鼠品系。此转基因小鼠品系所培育出的后代中,不含Cre ER重组酶的ARNTfl/fl小鼠作为对照组,为ARNT野生型小鼠(ARNT wild type,ARNT WT);而所产生的α-actin(HSA)-Cre ERARNTfl/fl小鼠,为实验组转基因小鼠。实验组小鼠其Cre ER基因在接触三苯氧胺(Tamoxifen)后会被激活重组并导致骨骼肌细胞中ARNT基因表达的丢失,这种小鼠作为肌肉ARNT敲除小鼠(muscle ARNT knockout,ARNT mKO)。理论上此小鼠只在骨骼肌细胞中失去ARNT基因的表达,并不影响其它组织和器官中ARNT的表达及功能。新生小鼠3周时,取鼠尾血进行基因型检测并分笼饲养。待小鼠8~10周时,腹腔注射混合玉米油载体(10 μl/g)的三苯氧胺(0.1 mg/g)连续5 d进行基因激活,骨骼肌冰冻损伤实验在末次注射后1周开始。并于损伤后第5 d、第10 d取材检测(图1)。
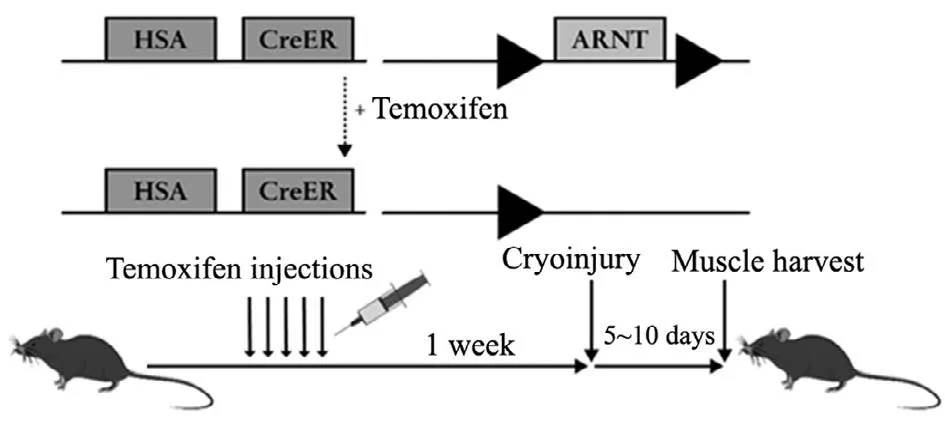
图1 转基因小鼠制备模式图Fig.1 The production model diagram of transgenic mice
1.1.2 主要试剂及仪器 ELISA试剂盒购于美国LS公司,qRT-PCR相关试剂购于美国Qiagen、BIO-RAD公司,Tamoxifen购于美国Sigma公司,ML228购于美国Tocris公司。
1.2 实验方法
1.2.1 小鼠骨骼肌冰冻损伤模型的构建 将异氟醚麻醉状态下的小鼠仰卧位置于手术台上,左后肢备皮,75%酒精消毒术区,铺无菌孔巾。使用无菌手术刀于小鼠左下肢内侧膝关节处做长约2 cm的纵向切口,切开皮肤和皮下组织,钝性分离肌膜,充分暴露胫骨前肌、股四头肌及腓肠肌。将在干冰中冷却的金属探针放置在目标肌肉上5 s,造成局部的低温损伤。损伤后立即使用4-0缝线原位缝合皮肤,之后对小鼠进行复苏。术后即刻予以皮下注射叔丁啡注射液0.03 mg/ml,并每12 h注射0.1 ml,连续3 d,以缓解实验动物术后的不适感。术后第5、10 d取材。
1.2.2 组织染色切片 4%多聚甲醛固定肌肉,行脱水、包埋等处理制作石蜡切片。苏木素-伊红(HE)染色后,将切片置于10倍视显微镜下观察,每个样本在整个再生区横截面上拍摄10张照片,使用Image J系统在每张图像上测量10个再生肌纤维(由其中心位置的细胞核进行识别)的面积。每个样本统计100个再生肌纤维面积,结果输入SPSS软件进行统计分析。
1.2.3 ELISA检测 使用Mouse HIF1 Alpha ELISA Kit、Mouse ARNT ELISA Kit试剂盒进行检测。将配制好的梯度标准液加入96孔板中,每孔100μl并至少设定两排复孔。每孔加入骨骼肌蛋白质样本100 μl,于37℃温箱中孵育1 h;加入配液A 100μl,37℃温箱中孵育1 h;清洗后加入配液B 100μl,37℃温箱中孵育1 h;清洗后加入TMB溶液90μl,于37℃温箱中孵育20 min后加入终止液50μl终止反应。使用分光光度仪检测并计算蛋白质含量。
1.2.4 qRT-PCR检测 使用RNeasy Mini Ki试剂盒进行骨骼肌RNA的提取,nano drop仪器检测RNA含量,Superscript IIIReverse Transcriptase Supermix Kit试剂盒进行逆转录获得cDNA。96孔板每孔依设计加入:cDNA 1.5μl;上游引物1μl;下游引物1μl;SYBR green supermix 12.5μl;去离子水9μl构成25μl反应体系,其中β-actin设定3个复孔。使用ABI StepOnePlus PCR扩增仪进行扩增,数据采用仪器自带软件分析(ABIPrism 7300 SDSSoftware)。所使用的引物序列如表1。

表1 引物序列Tab.1 Primer sequences
1.2.5 多普勒检测 小鼠异氟醚麻醉满意后,取俯卧位固定于检测区,设定检测仪以4 ms/pixel的速度测量左后肢LDPI平均通量强度。所得数据以平均通量强度表示。
1.3 统计方法
数据以平均值和标准差(Mean±SD)表示。正态分布数据的统计比较采用Student t检验进行统计评估;对两组以上数据进行比较的结果采用单因素方差分析(ANOVA)和Tukey多重比较检验,P<0.05有统计学意义。
2 结果
2.1 老龄鼠骨骼肌再生能力显著低于幼龄鼠
HE染色片中可见同一取材时间点,幼龄鼠的再生骨骼肌纤维面积显著大于老龄鼠,老龄鼠的骨骼肌再生区域内可见更多的炎性细胞,甚至出现局部坏死,提示衰老导致骨骼肌再生能力下降。ELISA、qRT-PCR、多普勒结果均提示,衰老导致胞质内ARNT含量下降,HIF-1α含量下降、骨骼肌再生相关基因(MyoD、Myogenin和Myf5)的表达以及血流灌注量也均有下调(图2)。

图2 幼龄鼠与老龄鼠骨骼肌再生对比A:再生肌纤维横截面积(HE染色)B:ELISA检测骨骼肌损伤前后细胞质与细胞核内ARNT蛋白质的表达含量 C:ELISA检测骨骼肌损伤前后细胞质与细胞核内HIF-1α蛋白质的表达含量 D:qRT-PCR检测再生骨骼肌相关肌生成基因的表达量 E:多普勒检测未损伤时左后肢血流 标尺=100μmFig.2 The comparison of muscle regeneration between young and old miceA:Cross-sectional areas of regenerated muscle fibers(HE staining);B:The expressions content of cytoplasmic and nuclear ARNT protein pre-and post-injury detected by ELISA;C:The expressions content of cytoplasmic and nuclear HIF-1αprotein preand post-injury detected by ELISA;D:The expression content of myogenesis genes detected by qRTPCR;E:The blood flow at the hindlimb pre-injury detected by Doppler test;Scale Bar=100μm
2.2 转基因小鼠模型的ARNT特异性敲除验证
选取野生型小鼠(ARNT WT)和转基因小鼠(ARNT mKO)各6只,规律注射三苯氧胺。1周后选取小鼠股四头肌及心、肝、肾和肺组织,qRT-PCR检测ARNT、HIF-1α,HIF-2α基因,结果显示转基因小鼠骨骼肌中的ARNT表达含量减少了约95%,HIF-1α、HIF-2α的表达含量无明显变化;在心、肝、肾和肺组织中的ARNT基因表达水平无差异,表明此转基因小鼠可以达到高效的、特异性的ARNT基因敲除(图3)。

图3 qRT-PCR检测野生型小鼠和转基因小鼠基因表达A:骨骼肌中ARNT基因的表达B:骨骼肌中HIF-1α,HIF-2α基因的表达C:心、肝、肾和肺组织中ARNT基因的表达水平Fig.3 The comparison of gene expression between ARNTWT and ARNT mKO mice detected by qRT-PCRA:The ARNT gene expression in skeletal muscle;B:The HIF-1αand HIF-2αgene expression in skeletal muscle;C:The ARNT gene expressionsin heart,lung,kidney,and liver
2.3 敲除ARNT基因使骨骼肌再生能力显著下降
HE染色片中可见同一取材时间点,转基因小鼠的骨骼肌再生肌纤维面积明显小于野生型小鼠,提示敲除ARNT基因会使骨骼肌再生能力显著下降。ELISA检测提示转基因小鼠细胞质内的ARNT表达受到抑制;细胞核内的ARNT含量无明显差别,但HIF-1α表达量明显下降。qrt-PCR检测提示转基因小鼠的肌再生相关基因表达量下降;二组小鼠下肢的血流量无统计学差异(图4)。

图4 野生型小鼠与转基因小鼠骨骼肌再生对比 A:再生肌纤维横截面积 B:ELISA检测骨骼肌损伤前后细胞质与细胞核内ARNT蛋白质的表达含量 C:ELISA检测骨骼肌损伤前后细胞质与细胞核内HIF-1α蛋白质的表达含量 D:qRTPCR检测再生骨骼肌相关肌生成基因的表达量E:多普勒检测未损伤时左后肢血流 标尺=100μmFig.4 Thecomparison of muscleregeneration between ARNTWTand ARNTmKOmiceA:Cross-sectional areas of regenerated muscle fibers;B:The expressions content of cytoplasmic and nuclear ARNT protein pre-and post-injury detected by ELISA;C:Theexpressionscontent of cytoplasmic and nuclear HIF-1αprotein pre-and post-injury detected by ELISA;D:The expressions content of myogenesis genes detected by qRT-PCR;E:The of blood flow at the hindlimb pre-injury detected by Doppler test;Scale Bar=100μm
2.4 ML228增强骨骼肌再生能力
目前没有简便的外源性ARNT添加方法,本实验使用一种小分子诱导物—ML228,此化合物可以增加HIF的核易位及促进DNA绑定。实验组小鼠,将1 mg ML228溶于32 ml二甲基亚砜(Dimethyl sulfoxide,DMSO)溶液中,腹腔注射0.1 ml/次/日,连续5 d;对照组小鼠注射等量的DMSO溶液。于第2次ML228注射之后对小鼠进行冰冻损伤处理,术后第5天、第10天取材(图5)。

图5 实验鼠制备模式图Fig.5 The production model diagram of mice
HE染色片显示老龄ML228组小鼠的骨骼肌再生肌纤维面积显著增加,提示ML228可以提高老龄鼠骨骼肌再生能力。且老龄ML228组小鼠肌内HIF-1α与肌生成基因表达含量升高;两组小鼠下肢血流量无统计学差异(图6)。
3 讨论
骨骼肌是维持人体正常活动、代谢以及保障个人生长发育和生活品质最重要的储备。一定范围内的骨骼肌损伤能够快速地进行自我修复和再生,但当缺损超过20%,则很难实现自身性的再生修复。本实验发现随着年龄的增长,骨骼肌的再生能力呈下降趋势。幼龄鼠细胞质内的ARNT表达含量显著高于老龄组,表明ARNT的表达含量也随着年龄的增长而逐渐降低。实验观察到老龄鼠与幼龄鼠细胞质内HIF-1α无差别而细胞核内差异明显,结合ARNT是低氧通路中HIF-1α向核内转移并转录多个下游低氧通路因子的关键因子,提示ARNT的丢失是导致HIF-1α核易位减少的关键因素。在特异性敲除骨骼肌ARNT基因后,细胞核内HIF-1α水平显著降低;添加低氧通路激活剂ML228后HIF-1α水平得到恢复。以上结果均验证了ARNT是低氧通路中的关键因子,是骨骼肌再生过程中的关键因子,而低氧通路与骨骼肌再生能力密切相关。
qRT-PCR检测结果表明,MyoD、Myogenin、Myf5这几个与骨骼肌再生相关的肌生成基因在老龄鼠组、转基因小鼠组、老龄DMSO组小鼠中的表达明显下降,这与骨骼肌再生能力下降的组织学结果相吻合。多普勒测量发现,老龄鼠左下肢中部的血流量与幼龄鼠相比降低约30%,提示骨骼肌再生能力的差异可能与年龄相关的血流量变化有关,然而在转基因小鼠与野生型小鼠、老龄ML228与老龄DMSO组小鼠中,左下肢血流量并无统计学差异,表明血流灌注不是造成骨骼肌再生能力改变的主要原因。因此,敲除ARNT基因会降低骨骼肌再生能力的机制,是由于ARNT基因沉默改变了缺氧信号,限制了低氧通路相关因子的转录和表达,进而对骨骼肌的再生产生了负性的影响。而添加ML228后,低氧信号得到激活,老龄鼠骨骼肌的再生能力得到改善。
ML228是Theriault等人[9]于2012年发现的一种小分子化合物,该化合物在结构上与目前已知的其它HIF激活剂有本质的不同。ML228在体外已被证明可以有效激活HIF及其下游靶点VEGF;且在体内可以促进低氧通路的活化,增加VEGF等相关促血管化因子的表达,达到促进脊髓损伤修复、诱导肿瘤再生等作用[10]。本实验结果提示ML228可以逆转受损的骨骼肌再生能力,且是由于ML228增强了低氧通路来实现的,也再一次验证了ARNT通过减少低氧通路抑制骨骼肌的再生能力。
综上所述,ARNT随年龄的增长而表达下降是造成老龄骨骼肌再生能力降低的主要原因,其机制是与年龄相关骨骼肌内低氧通路受到抑制。低氧信号的药理学激活剂有望改善受损骨骼肌的再生能力,以此为靶点的治疗方式为促进老龄人口骨骼肌的再生提供了新的思路。