增材制造医用多孔钛合金研究与应用现状
张永弟 王琮瑜 王琮玮 杨光


摘 要:钛合金具有良好的力学性能和生物相容性,被认为是一种理想的植入体材料。但致密钛合金的弹性模量较高,在植入人体后与骨之间存在应力遮挡现象,易引发植入体松动。采用增材制造技术制备的多孔钛合金能够很好地解决这一问题。从多孔结构的设计方法与增材制造的原理入手,综述了增材制造多孔钛合金在力学性能方面的研究现状以及在生物医疗领域的研究与应用进展,并对其未来的发展趋势进行了展望,指出今后可在以下4方面对医用多孔钛合金展开深入研究:1)研发更先进的成型设备以提高多孔钛合金的成型质量与成型效率;2)对多孔结构进行仿生化设计,将高力学性能与高生物性能有机结合;3)通过对Gibson-Ashby模型进行修正,可获得更为准确的力学性能预测结果;4)开发新型钛合金材料以提高多孔钛合金的生物相容性。
关键词:特种加工工艺;增材制造;多孔结构;钛合金;力学性能;生物性能
中图分类号:TG146.2 文献标识码:A
doi:10.7535/hbkd.2021yx06007
Research and application status of medical porous titanium alloy formed by additive manufacturing
ZHANG Yongdi,WANG Congyu,WANG Congwei,YANG Guang
(School of Mechanical Engineering,Hebei University of Science and Technology,Shijiazhuang,Hebei 050018,China)
Abstract:Titanium alloy is considered as an ideal implant material for its good mechanical properties and biocompatibility.However,due to the high elastic modulus of solid titanium alloy,there is stress shielding between the implant and human bone after implantation,which can easily trigger implant loosening.The porous titanium alloy formed by additive manufacturing technology can solve this problem well.Starting with the design method of porous structure and the principle of additive manufacturing,the research status of mechanical properties of additive manufacturing porous titanium alloy and the research and application progress in biomedical field are reviewed,and its future development trend is prospected.Further research on porous titanium alloys for medical can be carried out in the following aspects in the future.1) Developing more advanced forming equipment to improve the forming quality and efficiency of porous titanium alloy;2) Biomimetic design is carried out on the porous structure to combine high mechanical properties with high biological properties;3) The Gibson-Ashby model was modified to obtain more accurate prediction results of mechanical properties;4) Develop new titanium alloy materials to improve the biocompatibility of porous titanium alloys.
Keywords:
special processing technology;additive manufacturing technology;porous structure;titanium alloy;mechanical properties;biological properties
鈦合金因具有较高的比强度、良好的生物相容性以及耐腐蚀性等优点,在生物医疗领域有着广泛的应用,常作为骨科植入体材料[1-2],其中,Ti6Al4V合金是最为常用的一种钛合金。然而致密Ti6Al4V合金弹性模量为110 GPa,远高于人体骨弹性模量(0.02~20 GPa),植入人体后会产生应力遮挡现象[3-5],导致骨吸收、皮质骨逐渐变薄,甚至发生植入体松动[6]。
多孔结构具有体密度小、比表面积大、能量吸收性好等特点,应用前景广泛,近年来广受国内外学者的关注[7-8]。多孔钛合金结合了钛合金与多孔结构优良的物理、化学特性,具有功能结构一体化的特点[9],可用来模拟人体骨小梁结构,达到降低致密钛合金弹性模量的目的。对其支杆直径和单元尺寸进行参数化设计可获得所需的孔隙率与孔径,实现对力学性能的调控[10],可为骨科疾病患者带来福音。
增材制造技术又称3D打印技术,是一种以离散、堆积为基本原理,以数字化模型为基础的变革性技术,具有成型自由度高、成型速度快、成型件质量好等特点[11-12]。根据成型工艺不同,金属增材制造技术主要分为激光选区熔化(selective laser melting,SLM)技术、激光选区烧结(selective laser sintering,SLS)技术、電子束选区熔化(selective electron beam melting,SEBM)技术、激光熔覆(laser cladding,LC)技术和电弧增材制造(wire and arc additive manufacture,WAAM)技术等。其中SLM技术和SEBM技术制造精度相对较高,在医疗领域常用于成型多孔钛合金。现阶段,设计并制造出满足力学性能、生物相容性要求的多孔钛合金已成为国内外研究的热点[13]。
1 增材制造多孔钛合金原理
1.1 增材制造技术成型原理
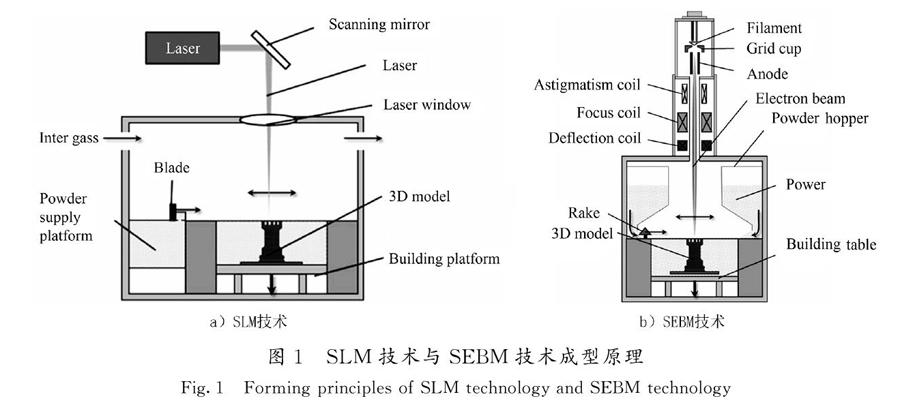
SLM技术和SEBM技术的成型原理如图1所示[14]。SLM技术以金属粉末作为材料,通过振镜偏转使高能量的激光选择性地照射在金属粉末上,金属粉末迅速熔凝,与固体金属达到冶金结合[15]。当一层扫描完成后,成型平台下降、供粉平台上升一个层厚的高度,刮刀移动将粉末材料铺在上一层表面,通过重复此过程最终得到所需的三维实体[16]。SEBM技术成型原理与SLM技术相似,不同的是SEBM技术使用能量更高的电子束作为热源,通过电磁偏转线圈控制电子束射出的方向,实现对金属粉末选择性地熔化[17-18]。表1为2种技术的对比[19-25]。由于国外对增材制造技术的研究起步较早,如美国3D System、英国Renishaw、德国Concept Laser、瑞典Arcam等公司,其研发的设备相对成熟。在中国,增材制造设备的研发主要由高校、企业等完成,其中走在前列的主要有华中科技大学、华南理工大学、西安铂力特公司等。
与传统制造技术相比,采用增材制造技术成型多孔钛合金主要具有以下优势:
1)成型自由度高 传统的粉末冶金法[26]、浆料发泡法等[27]虽也能够制备多孔钛合金,但无法控制其孔隙的形状和尺寸,因此不能很好地满足医疗领域的需求。增材制造技术可根据设计出的数字模型进行成型,因此可对多孔钛合金的几何参数、几何形态等实现精确控制。
2)成型速度快 与传统制造技术的多道工序逐步加工相比,增材制造技术可实现对零件的一次性直接成型[28],大大缩短零件的成型周期,具有较快的成型速度。
3)成型件力学性能好 由于在增材制造技术成型的过程中金属粉末熔凝速度快,因此成型零件的组织细小且均匀,在强度上通常高于传统铸造、锻造技术制备的钛合金[12,29]。
1.2 多孔结构设计方法
多孔结构的几何参数、几何形态对其力学性能与生物性能有着很大的影响,常用来评价多孔结构的几何参数有单元尺寸L、杆径S、孔径D及孔隙率P,如图2所示。P为多孔结构孔隙体积占单元体积的比例。目前国内外常用的多孔结构设计方法主要有计算机辅助设计(computer aided design,CAD)法、三周期极小曲面法、Voronoi图法、拓扑优化法等。表2为4种设计方法的特点及所设计出多孔结构的几何形态[30-36]。
2 增材制造多孔钛合金力学性能研究
2.1 几何形态与几何参数对力学性能的影响
作为植入体,多孔钛合金的力学性能至关重要,必须具有足够的力学强度,以保证植入后不会发生变形破坏,且应与人体骨弹性模量接近,以避免发生应力遮挡[37]。目前国内外学者主要通过压缩试验和有限元仿真对多孔钛合金的力学性能进行研究。诸多研究表明,多孔结构的几何形态、几何参数对其力学性能有着很重要的影响。杨立军等[38]对方形孔、圆形孔和蜂窝孔3种结构进行了有限元分析,发现当孔径相同时,3种结构中蜂窝孔的弹性模量最高,其次为圆形孔,方形孔的弹性模量最低,并且当孔隙率为78.4%~89.6%时,其弹性模量为21.25~13.04 GPa,与人体股骨力学性能相近。MOLINARI等[39]研究了SLM技术成型的10种不同几何形态、孔隙率在47.8%~82.6%范围内的多孔钛合金。结果表明,当多孔结构中无沿载荷施加方向排列的支杆时,其强度通常较低,且所有试件的抗压强度为10~250 MPa,弹性模量为1~20 GPa,与人体皮质骨的弹性模型非常相似。上述研究为后续学者在多孔结构的几何形态设计方面提供了参考,未来研究应在满足人体骨力学性能的基础上设计与天然骨小梁结构更为接近的孔形态,使其具有更好的仿生性。
ZAHARIN等[40]采用SLM技术制备了孔隙率为57.48%~79.36%的多孔钛合金,发现当其孔隙率约为70%时具有与天然骨相近的力学性能。ZHANG等[41]采用SEBM技术制备了孔隙率为61.444%~79.665%的多孔钛合金,发现其弹性模量比致密钛合金降低了91%~96%,总体上与人体骨弹性模量相近。李卿等[42]研究了SLM技术制备的多孔钛合金的力学性能。结果表明,当孔隙率从58.0%下降到45.2%时,抗压强度从223.1 MPa提升至351.6 MPa,弹性模量从15.1 MPa提升至25.7 GPa。EPASTO等[43]研究了单元尺寸为2,3,6 mm多孔钛合金的压缩性能,发现随着单元尺寸的减小,试件的抗压强度逐渐增强。LEARY等[44]在研究中也发现,当孔隙率不变时,多孔结构的抗压强度和弹性模量随着单元尺寸的增加而降低,这是因为单元尺寸大的结构支杆长度较长,因此更容易发生屈曲,导致力学性能下降。目前,对于多孔钛合金力学性能的研究大都集中在压缩性能方面,后续研究应对其拉伸性能进行关注,以实现对其性能更全面地掌握。
由以上研究可以看出,虽然不同几何形态、几何参数下的多孔钛合金在力学性能上差异较大,但存在一个规律,即多孔钛合金的抗压强度和弹性模量与其孔隙率成反比,随着孔隙率的上升二者通常会下降。因此,由支杆组成的多孔结构更有利于获得预期的力学性能,可在支杆直径一定时对单元尺寸进行调节,或在单元尺寸一定时对支杆直径进行调节,使得结构的孔隙率发生改变,实现对力学性能的调控。此外,由于多孔结构的孔隙率与支杆的总体积有关,因此可在孔隙率一定时,通过改变与载荷垂直方向、增加沿载荷施加方向上的支杆数量,改变结构抵抗变形的能力,使力学性能达到预期值。
2.2 基于Gibson-Ashby模型的力学性能预测
由于多孔钛合金的力学性能至关重要,因此对其力学性能预测吸引着国内外学者的兴趣。通过模型理论对力学性能进行预测是一种常用方法,其中,Gibson-Ashby模型是多孔材料领域中最具有代表意义的经典模型,该模型基于立方构架连接的简化结构[45],根据该模型可推导出多孔结构相对密度、抗压强度及弹性模量的数学关系如下[46]:
EEs=C1ρρsn1,(1)
σσs=C2ρρsn2,(2)
式中:E,Es,σ,σs,ρ,ρs分别为多孔材料与致密材料的弹性模量、抗压强度、相对密度;C1,C2,n1,n2均为所求常数,取决于材料属性与多孔结构的几何形态。由于Gibson-Ashby模型并未对材料属性与多孔结构的几何形态做出明确规定,因此其在多孔材料的力学性能预测方面有着良好的适用性。
YANG等[47]根据Gibson-Ashby模型对所设计孔钛合金的相对密度与弹性模量、抗压强度仿真值间的关系进行拟合,并采用SLM技术制备压缩试件进行验证。研究结果表明,模型可较为准确地预测其孔隙率与力学性能间的关系,可通过对孔隙率进行设计实现多孔钛合金力学性能的调控。CHEN等[48]采用SLM技术制备了不同孔隙率的多孔钛合金,并对其相对密度与力学性能间的拟合关系进行了研究。结果表明,拟合方程在总体上具有较好的预测效果。但通过对比发现,相对密度较低试件的抗压强度试验值与预测模型的拟合曲线偏差较大,因此应注意,当多孔结构的孔隙率较高时,在强度方面可能无法通过Gibson-Ashby模型获得准确的预测值。XU等[49]对SLM成型不同单元尺寸多孔钛合金的动态弹性模量与相对密度之间的关系进行了研究,发现在单元尺寸较小时,由于支杆间几乎相互接触导致结构的抗变形能力提高,因此n2值随着单元尺寸的减小而减小。针对单元尺寸对动态弹性模量的影响,作者提出了以特征参数F(L)来代替n2,获得的拟合方程相关系数R2为0.993 7,表明通过该模型对动态弹性模量进行预测时具有较高的精度。
上述研究表明,在使用Gibson-Ashby模型对多孔钛合金的力学性能进行预测时,总体上能够达到令人满意的效果,但由于结构孔隙率过高、单元尺寸过小等原因,预测值与试验值间会存在偏差。有学者认为产生偏差的原因可能与试件存在残余应力、试件表面黏附未熔粉末以及试件的体积在支杆相交处容易被重复计算等有关[50]。因此,未来应对如何消除预测值的偏差进行深入研究,实现对多孔钛合金力学性能更精准的预测。
3 增材制造多孔钛合金在生物医疗领域的研究与应用
3.1 促骨长成性能研究
多孔结构与人体骨的微观结构极为相似,其孔隙为细胞的黏附、扩散及分化等过程创造了条件,相互联通的结构也有利于氧气与营养物质的循环,可很好地促进骨组织的生长[51]。大量研究表明,多孔钛合金的孔径、孔隙率等几何参数对其促骨长成能力有着重要的影响,但关于最优的几何参数目前尚无统一的定论。KARAGEORGIOU等[52]建议使用大于300 μm的孔径;FUKUDA等[53]通过试验发现,当孔径在500~1 200 μm时,500 μm的孔径具有最优的成骨诱导作用;NUNE等[54]指出,孔径在5~15 μm时只适合纤维细胞的长入,10~120 μm的孔径适合软骨细胞的生长,而100~400 μm的孔径更适合成骨细胞的生长;邓珍波等[55]认为,理想的孔径、孔隙率分别在300~900 μm和60%~95%之间。
TANIGUCHI等[56]采用SLM技术制备了孔隙率为65%、孔径分别为300,600,900 μm的板状与柱状多孔钛合金支架(如圖3所示)[56],并将支架分别植入到日本白兔的胫骨与股骨处,在植入后第2,4,8周时进行了与骨分离的力学试验以评估其结合强度。结果表明,孔径为600 μm的支架与骨结合强度明显高于其他2种孔径,且具有良好的与骨结合能力和较快的骨长入速度,是一种适用于植入体的多孔结构。该研究可为后续学者在多孔钛合金促骨长成性能方面提供孔径尺寸的参考,未来研究可对此孔径区间进行细化,以探索更为理想的孔径值。
r
刘路坦等[57]采用SEBM技术制备出孔隙率分别为35%,55%,75%的3组多孔钛合金支架,分别植入在新西兰白兔的股骨干处,并在术后第16周取出进行组织学观察,如图4所示。3组支架中孔隙率为35%的骨长入效果最差,孔隙率为55%的稍好,孔隙率为75%的最佳。对其原因进行分析,可能是75%的孔隙率能够为骨细胞的生长提供足够的空间,而35%的孔隙率则会影响孔隙形成有效联通,导致新生组织被挡在孔隙外而无法很好地长入。该研究结果可加深后续学者对孔隙率与骨长入效果之间关系的认知,未来研究应注意多孔钛合金的孔隙率不宜过低,避免其对组织的生长造成限制。
然而也并非孔径越大、孔隙率越高时骨长入效果越好。NUNE等[51]采用SEBM技术制备了3种孔径在700~1 500 μm的多孔钛合金支架,对应孔隙率在76%~90%。通过将成骨细胞接种在多孔钛合金支架上,发现随着多孔结构孔隙率的增加,接种效率明显降低。刘邦定等[58]认为当孔径过大时多孔钛合金无法起到良好的支架作用,导致孔隙中心的骨生长速度减缓,影响局部骨缺损修复的效果。因此应当注意,在对多孔钛合金进行设计、制造时,其孔径、孔隙率应在合理的范围内,这是保证多孔钛合金具有良好促骨长成性能的前提。
3.2 在植入体中的应用
目前采用增材制造技术制备的多孔钛合金植入体在人体不同部位的修复和置换中有着不同程度的研究与应用,针对个体之间的差异性,多孔植入体也逐渐向个性化发展。
3.2.1 口腔颌面植入体
在口腔颌面外科方面,增材制造技术在多孔种植体、植入体中的应用在总体上仍处于研究阶段,国内外相关的动物试验和临床研究相对较少,也尚无产品通过食品药品监督管理局的注册批准[59]。但从现有研究不难看出,其在口腔颌面外科中具有良好的应用前景。
WALLY等[60]对采用增材制造技术制备的多孔钛合金在齿科种植体中的应用进行了分析,认为其孔径大小与形态可控,且具有良好的生物相容性,因此有望替代传统种植体。随后,WALLY等[61]又采用SLM技术制备了孔隙为梯度且可控的多孔钛合金支架,通过进行力学性能测试与细胞培养测试,评估其用于齿科种植体的可能性。结果表明,其抗压强度在松质骨的范围内,并且能够很好地支持骨细胞的生长。秦风利等[62]针对传统牙根种植体存在的弹性模量高、生物活性低等问题,设计了单根型、多根联合型、多根分根型3种不同结构的个性化多孔钛合金种植体,采用SLM技术进行制备,如图5所示。所制得的个性化多孔种植体在形态上与正常牙根高度相似,可确保植入初期的稳定性。通过将种植体植入在比格犬的颌骨处进行验证,证实了其能够在生物体内与骨组织达到良好的结合效果。以上研究表明,增材制造技术适合用于齿科种植体的制造,与传统制造技术相比,其更具有生物性能和个性化方面的优势。
LEE等[63]针对一位下颌骨缺损的患者采用SEBM技术制备了多孔钛合金植入体,成功地恢复了患者下颌的功能与美观。SUSKA等[64]采用个性化设计方法为一位切除左下颌的患者设计了个性化植入体,将其两端与骨结合处设计成为多孔结构以促进骨组织的长入。
采用SEBM技术制备的钛合金植入体在术后3个月的随访中表现出了良好的稳定性,并且外观也令患者满意。YAN等[65]基于一名颌骨全缺损志愿者的CT数据,设计并采用SEBM技术制备了个性化多孔钛合金下颌(如图6所示)进行植入,术后患者恢复良好,无松动和排斥反应。此外,作者还对12只下颌骨缺损的犬类进行了移植验证,在植入后其下颌骨均恢复良好,且在术后12个月时的相关参数均与正常下颌骨接近。以上研究证明了使用个性化多孔钛合金植入体对下颌骨进行修复是可行的。此外,在使用患者的CT数据进行模型重建时,应注意数据格式转换时模型的精度问题,保证设计出的植入体可与患者精确匹配。
3.2.2 脊柱植入体
椎间融合器是治疗脊柱疾病常用的植入体,可恢复椎间盘高度并实现骨融合[66]。
目前国外已有多家公司,如美国Stryker,Nexxt Spine公司和德国Joimax公司等,其采用增材制造技术生产的多孔钛合金融合器产品获得了相关部门的上市批准,并逐渐应用于临床。在中国,北京大学第三骨科医院刘忠军教授团队与北京爱康医疗公司走在了融合器研发的前列,其在2016年合作研制的增材制造多孔钛合金融合器产品获得了国家食品药品监督管理总局(China food and drug administration,CFDA)的注册批准。刘忠军教授团队也成功完成了世界首例增材制造多孔融合器的置换手术,患者手术后恢复效果良好[67]。但目前关于多孔融合器临床应用效果的报道还相对较少[68],大多数研究还处于设计与制造阶段。图7所示为伊明扬[69]设计并采用SLM技术制备的多孔钛合金融合器[69]。
舒启航等[70]对所设计的多孔融合器进行了有限元分析,通过与传统融合器进行对比发现,多孔融合器在不同工况下的峰值应力均有显著下降,可有效避免应力集中现象,降低植入体下沉风险。MOUSSA等[71]对人体在做6种动作时融合器的受力进行了有限元分析,根据分析结果对融合器的多孔结构进行梯度密度优化。与传统融合器的对比结果表明,该梯度多孔融合器在做相同动作时的最大应力值降低了11.0%~14.0%,有效降低了骨-植入体的接触应力,有利于提高植入后的长期稳定性。以上研究可为具有更优生物性能椎间融合器的设计提供参考,后续研究应进行优化后融合器的力学试验和体外生物试验,进一步推动其在临床应用中的进展。
3.2.3 髋关节植入体
全髋关节置换术在股骨头坏死、股骨颈骨折等疾病的治疗中有着广泛的应用,是开展最为广泛的人工关节置换术之一[72],髋臼杯是常用的髋关节植入体。目前国外获得注册批准的增材制造多孔钛合金髋臼杯产品相对较多,国内北京爱康医疗公司和天津嘉思特医疗公司的产品分别在2015年、2019年获得了CFDA的注册批准。图8所示为意大利Lima公司采用SEBM技术制备的多孔钛合金髋臼杯产品。目前增材制造多孔钛合金髋臼杯已广泛应用在髋关节手术中,临床效果良好。
GENG等[74]对90位初次使用多孔钛合金髋臼杯进行全髋关节置换的患者在术后2~6年进行了随访,结果显示其平均Harris髋关节评分从术前(45.2±4.8)分提高至末次随访的(95.8±6.0)分。该研究表明多孔钛合金髋臼杯能够在全髋关节置换术中提供较高的手术成功率和良好的术后稳定性。PERTICARINI等[75]对104位使用多孔钛合金髋臼杯进行翻修手术的患者在术后2~12年进行了随访,结果显示,其平均Harris髋关节评分从术前43.7分提高至末次隨访的84.4分。该研究证实了多孔钛合金髋臼杯在翻修术后具有良好的临床和影像学效果。在MEO等[76]、WAN等[77]、LI等[78]报道的全髋关节置换与翻修手术中,多孔钛合金髋臼杯均获得了令人满意的效果。
4 研究展望
基于数字化模型的增材制造技术能够成型具有多孔结构的钛合金,可有效解决致密金属与人体骨之间存在应力遮挡的问题,并且有利于骨组织的长入,因此吸引了众多学者对其力学性能、生物性能进行研究,近年来在植入体中也有着越来越广泛的研究与应用。根据当前阶段的研究状况,增材制造医用多孔钛合金仍面临着成型设备、多孔结构设计、力学性能预测及钛合金材料等方面的难题,因此未来的研究主要可从以下4方面入手。
1)成型设备的研发。由于成型设备的固有特性,当前阶段SLM技术成型件通常存在残余应力,而EBM技术成型件表面质量有待提高。对于批量化生产的多孔植入体,仅具有单激光器的设备在成型速度上已不能满足需求,拥有多激光器的设备正逐渐在市场上出现。相信在不远的将来会有更高成型质量、成型效率的设备被研发出来,应用到多孔钛合金的成型制备。
2)多孔结构的仿生化设计。目前多孔支架、多孔植入体的构建大多还是通过对单元结构进行阵列,获得规则有序的多孔结构,这与天然人体骨随机无序的多孔结构还有一定的差别,并且人体骨在整体结构上并非密度均质,而是呈现出外部致密、内部疏松的梯度结构。因此,多孔结构在设计上应向仿生化发展,以实现将植入体要求的高力学性能与高生物性能有机地结合。
3)Gibson-Ashby模型的修正。虽然使用Gibson-Ashby模型对多孔钛合金的力学性能进行预测可获得较为满意的结果,但由于成型误差、试件存在残余应力等原因,预测结果仍存在一定的偏差。目前已有学者证明通过对模型添加修正系数可获得更为准确的结果,因此Gibson-Ashby模型的修正是未来研究的一个方向。
4)新型钛合金材料的开发。虽然目前最为常用的Ti6Al4V合金拥有良好的生物相容性,但也有学者指出,其所含有的Al和V元素在进入人体后有潜在的不良反应[79-80]。目前,越来越多新型抗菌钛合金、低弹性模量钛合金等逐渐被开发出来并进入临床研究,因此新材料的开发是未来医用多孔钛合金发展的一个趋势。
参考文献/References:
[1] 刘建国,周宏博.医用β钛合金的性能研究现状[J].口腔医学研究,2020,36(6):501-508.
LIU Jianguo,ZHOU Hongbo.Development of β-type medical titanium alloys' performance[J].Journal of Oral Science Research,2020,36(6):501-508.
[2] 尹浜兆,秦瑜,温鹏,等.激光粉末床熔融制备金属骨植入物[J].中国激光,2020,47(11):1-18.
YIN Bangzhao,QIN Yu,WEN Peng,et al.Laser powder bed fusion for fabrication of metal orthopedic implants[J].Chinese Journal of Lasers,2020,47(11):1-18.
[3] MIRCHESKI I,GRADIAR M.3D finite element analysis of porous Ti-based alloy prostheses[J].Computer Methods in Biomechanics and Biomedical Engineering,2016,19(14):1531-1540.
[4] SURMENEVA M A,SURMENEV R A,CHUDINOVA E A,et al.Fabrication of multiple-layered gradient cellular metal scaffold via electron beam melting for segmental bone reconstruction[J].Materials & Design,2017,133:195-204.
[5] 唐刚,王建革,罗红霞.髋关节置换前后不同步态下股骨应力分布[J].医用生物力学,2015,30(2):143-147.
TANG Gang,WANG Jiange,LUO Hongxia.Stress distributions on the femur under different gaits before and after hip joint replacement[J].Journal of Medical Biomechanics,2015,30(2):143-147.
[6] TEICHTAHL A J,WLUKA A E,WIJETHILAKE P,et al.Wolffs law in action:a mechanism for early knee osteoarthritis[J].Arthritis Research & Therapy,2015,17(1).doi:10.1186/s13075-015-0738-7.
[7] 刘培生,杨春艳,程伟.多孔材料性能模型研究3:数理推演[J].材料工程,2019,47(8):59-81.
LIU Peisheng,YANG Chunyan,CHENG Wei.Study on property model for porous materials 3:Mathematical deduction[J].Journal of Materials Engineering,2019,47(8):59-81.
[8] 杜義贤,罗明亮,付君健,等.高比表面积周期性多孔结构拓扑优化[J].组合机床与自动化加工技术,2021(4):31-35.
DU Yixian,LUO Mingliang,FU Junjian,et al.Topology optimization of periodic porous structure with a high specific surface area[J].Modular Machine Tool & Automatic Manufacturing Technique,2021(4):31-35.
[9] 汤慧萍,王建.多孔钛的研究进展[J].中国材料进展,2014,33(sup1):576-585.
TANG Huiping,WANG Jian.Progress in research and development of poroustitanium materials[J].Materials China,2014,33(sup1):576-585.
[10]LIU F,ZHANG D Z,ZHANG P,et al.Mechanical properties of optimized diamond lattice structure for bone scaffolds fabricated via selective laser melting[J].Materials,2018,11(3):374.
[11]RAKESH K,MANOJ K,SINGH C J.The role of additive manufacturing for biomedical applications:A critical review[J].Journal of Manufacturing Processes,2021,64:828-850.
[12]宗学文,熊聪,张斌,等.基于快速成型技术制造复杂金属件的研究综述[J].热加工工艺,2019,48(1):5-9.
ZONG Xuewen,XIONG Cong,ZHANG Bin,et al.Summary of research on manufacturing complex metal parts based on rapid prototyping technology[J].Hot Working Technology,2019,48(1):5-9.
[13]WANG Zhonghan,WANG Chenyu,LI Chen,et al.Analysis of factors influencing bone ingrowth into three-dimensional printed porous metal scaffolds:A review[J].Journal of Alloys and Compounds,2017,717:271-285.
[14]FUKUDA H.Additive manufacturing technology for orthopedic implants[C]//Advances in Metallic Biomaterials.Berlin:Springer,2015:3-26.
[15]田杰,黄正华,戚文军,等.金属选区激光熔化的研究现状[J].材料导报,2017,31(sup1):90-94.
TIAN Jie,HUANG Zhenghua,QI Wenjun,et al.Research progress on selective laser melting of metal[J].Materials Reports,2017,31(sup1):90-94.
[16]李淮陽,黎振华,杨睿,等.选区激光熔化金属表面成形质量控制的研究进展[J].表面技术,2020,49(9):118-124.
LI Huaiyang,LI Zhenhua,YANG Rui,et al.Research progress in forming quality control of selective laser melting metal surface[J].Surface Technology,2020,49(9):118-124.
[17]EDWARDS P,O'CONNER A,RAMULU M.Electron beam additive manufacturing of titanium components:Properties and performance[J].Journal of Manufacturing Science and Engineering,2013,135(6).doi:10.1115/1.4025773.
[18]汤慧萍.粉末床电子束3D打印Ti-6Al-4V合金的工程应用技术研究进展[J].中国材料进展,2020,39(7):551-558.
TANG Huiping.Research progress on engineering application of Ti-6Al-4V alloy fabricated by selective electron beam melting process[J].Materials China,2020,39(7):551-558.
[19]HERZOG D,SEYDA V,WYCISK E,et al.Additive manufacturing of metals[J].Acta Materialia,2016,117:371-392.
[20]SING S L,AN Jia,YEONG W Y,et al.Laser and electron-beam powder-bed additive manufacturing of metallic implants:A review on processes,materials and designs[J].Journal of Orthopaedic Research,2016,34(3):369-385.
[21]MURR L E.Metallurgy of additive manufacturing:Examples from electron beam melting[J].Additive Manufacturing,2015,5:40-53.
[22]牛京喆,孫中刚,常辉,等.3D打印医用钛合金研究进展[J].稀有金属材料与工程,2019,48(5):1697-1706.
NIU Jingzhe,SUN Zhonggang,CHANG Hui,et al.Review on 3D printing of biomedicaltitanium alloy[J].Rare Metal Materials and Engineering,2019,48(5):1697-1706.
[23]MATSAGOPANE G,OLAKANMI E O,BOTES A,et al.Conceptual design framework for setting upaluminum alloy powder production system for selective laser melting (SLM) process[J].JOM,2019,71(5):1840-1857.
[24]孟玄,杨尚磊,房郁,等.电子束选区熔化气孔形成机理[J].上海工程技术大学学报,2020,34(1):81-86.
MENG Xuan,YANG Shanglei,FANG Yu,et al.Formation mechanism of molten pores in electron beam selective melting[J].Journal of Shanghai University of Engineering Science,2020,34(1):81-86.
[25]WANG P,SIN W J,NAI M L S,et al.Effects of processing parameters on surface roughness of additive manufactured Ti-6Al-4V via electron beam melting[J].Materials,2017,10(10).doi:10.3390/ma10101121.
[26]AHMADI S M,YAVARI S A,WAUTHLE R,et al.Additively manufactured open-cell porous biomaterials made from six different space-filling unit cells:The mechanical and morphological properties[J].Materials,2015,8(4):1871-1896.
[27]PENG Wenming,LIU Yunfeng,JIANG Xianfeng,et al.Bionic mechanical design and 3D printing of novel porous Ti6Al4V implants for biomedical applications[J].Journal of Zhejiang University-Science B,2019,20(8):647-659.
[28]ELSAYED M,GHAZY M,YOUSSEF Y,et al.Optimization of SLM process parameters for Ti6Al4Vmedical implants[J].Rapid Prototyping Journal,2019,25(3):433-447.
[29]LIU Jiangwei,SUN Qidong,ZHOU Chang'an,et al.Achieving Ti6Al4V alloys with both high strength and ductility via selective laser melting[J].Materials Science & Engineering A,2019,766.doi:10.1016/j.msea.2019.138319.
[30]MIHALCEA E,VERGARA-HERNNDEZ H J,JIMENEZ O,et al.Design and characterization of Ti6Al4V/20CoCrMo-highly porous Ti6Al4V biomedical bilayer processed by powder metallurgy[J].Transactions of Nonferrous Metals Society of China,2021,31(1):178-192.
[31]KAPAT K,SRIVAS P K,DHARA S.Coagulant assisted foaming-A method for cellular Ti6Al4V:Influence of microstructure on mechanical properties[J].Materials Science and Engineering A,2017,689:63-71.
[32]LI Lan,SHI Jianping,ZHANG Kaijia,et al.Early osteointegration evaluation of porous Ti6Al4V scaffolds designed based on triply periodic minimal surface models[J].Journal of Orthopaedic Translation,2019,19:94-105.
[33]FANTINI M,CURTO M.Interactive design and manufacturing of avoronoi-based biomimetic bone scaffold for morphological characterization[J].International Journal on Interactive Design and Manufacturing,2018,12(2):585-596.
[34]WANG Guanjun,SHEN Lida,ZHAO Jianfeng,et al.Design and compressive behavior of controllable irregular porous scaffolds:Based on voronoi-tessellation and for additive manufacturing[J].ACS Biomaterials Science & Engineering,2018,4(2):719-727.
[35]XU Yangli,ZHANG Dongyun,ZHOU Yan,et al.Study on topology optimization design,manufacturability,and performance evaluation of Ti-6Al-4V porous structures fabricated by selective laser melting(SLM)[J].Materials,2017,10(9).doi:10.3390/ma10091048.
[36]XIAO Zefeng,YANG Yongqiang,XIAO Ran,et al.Evaluation of topology-optimized lattice structures manufactured via selective laser melting[J].Materials & Design,2018,143:27-37.
[37]MAJI P K,ROYCHOWDHURY A,DATTA D.Minimizing stress shielding effect of femoral stem-A review[J].Journal of Medical Imaging and Health Informatics,2013,3(2):171-178.
[38]楊立军,张佳,王哲,等.承力骨支架微孔结构设计及力学特性有限元分析[J].机械设计与制造,2017(7):157-160.
YANG Lijun,ZHANG Jia,WANG Zhe,et al.Design and finite element analysis of the mechanical properties of cellular structure of human load-bearing bone scaffold[J].Machinery Design & Manufacture,2017(7):157-160.
[39]MOLINARI A,KLARIN J,JOHANSSON F,et al.Mechanical properties of porous structures produced by selective laser melting of a Ti6Al4V alloy powder[J].Journal of the Japan Society of Powder and Powder Metallurgy,2018,65(8):481-485.
[40]ZAHARIN H A,ABDUL RANI A M,AZAM F I,et al.Effect of unit cell type and pore size on porosity and mechanical behavior of additively manufactured Ti6Al4V scaffolds[J].Materials,2018,11(12).doi:10.3390/ma11122402.
[41]ZHANG Chunqiu,ZHANG Lan,LIU Lu,et al.Mechanical behavior of a Titanium alloy scaffold mimicking trabecular structure[J].Journal of Orthopaedic Surgery and Research,2020,15(1).doi:10.1186/s13018-019-1489-y.
[42]李卿,赵国瑞,闫星辰,等.选区激光熔化成形多孔Ti-6Al-4V合金力学性能研究[J].激光与光电子学进展,2019,56(1):203-211.
LI Qing,ZHAO Guorui,YAN Xingchen,et al.Mechanical properties of porous Ti-6Al-4Vtitanium alloys fabricated by selective laser melting[J].Laser & Optoelectronics Progress,2019,56(1):203-211.
[43]EPASTO G,PALOMBA G,D'ANDREA D,et al.Ti-6Al-4V ELI microlattice structures manufactured by electron beam melting:Effect of unit cell dimensions and morphology on mechanical behaviour[J].Materials Science and Engineering A,2019,753:31-41.
[44]LEARY M,MAZUR M,WILLIAMS H,et al.Inconel 625 lattice structures manufactured by selective laser melting(SLM):Mechanical properties,deformation and failure modes[J].Materials & Design,2018,157:179-199.
[45]刘培生,崔光,程伟.多孔材料性能模型研究1:数理关系[J].材料工程,2019,47(6):42-62.
LIU Peisheng,CUI Guang,CHENG Wei.Study on property model for porous materials 1:Mathematical relations[J].Journal of Materials Engineering,2019,47(6):42-62.
[46]GIBSON L J,ASHBY M F.Cellular Solids[M].New York:Cambridge University Press,1997.
[47]YANG Guang,GUO Chongchong,ZHANG Yongdi,et al.Design method of porous titanium alloy based on meta-structure[J].Integrated Ferroelectrics,2021,215(1):149-165.
[48]CHEN S Y,HUANG J C,PAN C T,et al.Microstructure and mechanical properties of open-cell porous Ti-6Al-4V fabricated by selective laser melting[J].Journal of Alloys and Compounds,2017,713:248-254.
[49]XU Yangli,ZHANG Dongyun,HU Songtao,et al.Mechanical properties tailoring of topology optimized and selective laser melting fabricated Ti6Al4V lattice structure[J].Journal of the Mechanical Behavior of Biomedical Materials,2019,99:225-239.
[50]MACONACHIE T,LEARY M,LOZANOVSKI B,et al.SLM lattice structures:Properties,performance,applications and challenges[J].Materials & Design,2019,183.doi:10.1016/j.matdes.2019.108137.
[51]NUNE K C,MISRA R D K,GAYTAN S M,et al.Interplay between cellular activity and three-dimensional scaffold-cell constructs with different foam structure processed by electron beam melting[J].Journal of Biomedical Materials Research Part A,2015,103(5):1677-1692.
[52]KARAGEORGIOU V,KAPLAN D.Porosity of 3D biomaterial scaffolds and osteogenesis[J].Biomaterials,2005,26(27):5474-5491.
[53]FUKUDA A,TAKEMOTO M,SAITO T,et al.Osteoinduction of porous Ti implants with a channel structure fabricated by selective laser melting[J].Acta Biomaterialia,2011,7(5):2327-2336.
[54]NUNE K C,LI Shujun,MISRA R D K.Advancements in three-dimensional titanium alloy mesh scaffolds fabricated by electron beam melting for biomedical devices:Mechanical and biological aspects[J].Science China Materials,2018,61(4):455-474.
[55]鄧珍波,周长春,樊渝江,等.多孔钛骨组织工程支架设计及孔结构表征[J].稀有金属材料与工程,2016,45(9):2287-2292.
DENG Zhenbo,ZHOU Changchun,FAN Yujiang,et al.Design and characterization of porous titanium scaffold for bone tissue engineering[J].Rare Metal Materials and Engineering,2016,45(9):2287-2292.
[56]TANIGUCHI N,FUJIBAYASHI S,TAKEMOTO M,et al.Effect of pore size on bone ingrowth into poroustitanium implants fabricated by additive manufacturing:An in vivo experiment[J].Materials Science and Engineering:C,2016,59:690-701.
[57]刘路坦,牛国旗,周乾坤,等.3D打印多孔钛金属植入物不同孔隙率对骨长入影响的实验研究[J].蚌埠医学院学报,2019,44(9):1153-1157.
LIU Lutan,NIU Guoqi,ZHOU Qiankun,et al.Study on the effect of different porosity of 3D printing porous titanium implants on bone ingrowth[J].Journal of Bengbu Medical College,2019,44(9):1153-1157.
[58]刘邦定,郭征,郝玉琳,等.多孔钛合金不同孔径大小对新骨长入的影响[J].现代生物医学进展,2012,12(9):1601-1604.
LIU Bangding,GUO Zheng,HAO Yulin,et al.Effect of pore sizes of porous titanium alloys as bone material on bone formation[J].Progress in Modern Biomedicine,2012,12(9):1601-1604.
[59]王宏,胡敏.3D打印钛及钛合金在颌骨缺损修复中的应用[J].中华老年口腔医学杂志,2017,15(2):117-120.
WANG Hong,HU Min.Progress of titanium and its alloy fabricated by 3D printing technique in jaw defects reconstruction[J].Chinese Journal of Geriatric Dentistry,2017,15(2):117-120.
[60]WALLY Z J,GRUNSVEN W V,CLAEYSSENS F,et al.Porous titanium for dental implant applications[J].Metals,2015,5(4):1902-1920.
[61]WALLY Z J,HAQUE A M,FETEIRA A,et al.Selective laser melting processed Ti6Al4V lattices with graded porosities for dental applications[J].Journal of the Mechanical Behavior of Biomedical Materials,2019,90:20-29.
[62]秦風利,王超,刘婷,等.3D打印多孔钛个性化根形种植体的体内骨愈合研究[J].口腔医学研究,2018,34(12):1337-1341.
QIN Fengli,WANG Chao,LIU Ting,et al.Bone healing of customized 3D printed poroustitanium root-analogue implants in vivo[J].Journal of Oral Science Research,2018,34(12):1337-1341.
[63]LEE U L,KWON J S,WOO S H,et al.Simultaneous bimaxillary surgery and mandibularreconstruction with a 3-dimensional printed titanium implant fabricated by electron beam melting:A preliminary mechanical testing of the printed mandible[J].Journal of Oral and Maxillofacial Surgery,2016,74(7).doi:10.1016/j.joms.2016.02.031.
[64]SUSKA F,KJELLER G,TARNOW P,et al.Electron beam melting manufacturing technology for individually manufactured jaw prosthesis:A case report[J].Journal of Oral and Maxillofacial Surgery,2016,74(8).doi:10.1016/j.joms.2016.03.046.
[65]YAN Rongzeng,LUO Danmei,HUANG Haitao,et al.Electron beam melting in the fabrication of three-dimensional mesh titanium mandibular prosthesis scaffold[J].Scientific Reports,2018,8(1).doi:10.1038/s41598-017-15564-6.
[66]SERRA T,CAPELLI C,TOUMPANIARI R,et al.Design and fabrication of 3D-printed anatomically shaped lumbar cage for intervertebral disc (IVD) degeneration treatment[J].Biofabrication,2016,8(3).doi:10.1088/1758-5090/8/3/035001.
[67]XU Nanfang,WEI Feng,LIU Xiaoguang,et al.Reconstruction of the upper cervical spine using a personalized 3D-printed vertebral body in an adolescent with ewing sarcoma[J].Spine,2016,41(1):50-54.
[68]刘正蓬,王雅辉,张义龙,等.3D打印椎间融合器置入治疗脊髓型颈椎病:颈椎曲度及椎间高度恢复的半年随访[J].中国组织工程研究,2021,25(6):849-853.
LIU Zhengpeng,WANG Yahui,ZHANG Yilong,et al.Application of 3D printed interbody fusion cage for cervical spondylosis of spinal cord type:Half-year follow-up of recovery of cervical curvature and intervertebral height[J].Chinese Journal of Tissue Engineering Research,2021,25(6):849-853.
[69]伊明揚.TC4激光选区熔化椎间融合器开发[D].厦门:厦门理工学院,2018.
YI Mingyang.Development of TC4 Cage Based on Laser Selective Melting[D].Xiamen:Xiamen University of Technology,2018.
[70]舒启航,廖亦佳,薛静波,等.新型颈椎3D打印多孔椎间融合器的三维有限元分析[J].中国组织工程研究,2021,25(24):3810-3815.
SHU Qihang,LIAO Yijia,XUE Jingbo,et al.Three-dimensional finite element analysis of a new three-dimensional printed porous fusion cage for cervical vertebra[J].Chinese Journal of Tissue Engineering Research,2021,25(24):3810-3815.
[71]MOUSSA A,TANZER M,PASINI D.Cervical fusion cage computationally optimized with porous architected titanium for minimized subsidence[J].Journal of the Mechanical Behavior of Biomedical Materials,2018,85:134-151.
[72]王昊森,郝智秀,林剑浩,等.基于有限元方法的全髋关节假体个体化选型分析[J].医用生物力学,2014,29(3):219-226.
WANG Haosen,HAO Zhixiu,LIN Jianhao,et al.Individualized selection of total hip prosthesis base on finite element method[J].Journal of Medical Biomechanics,2014,29(3):219-226.
[73]DALL'AVA L,HOTHI H,HENCKEL J,et al.Comparative analysis of current 3D printed acetabular titanium implants[J].3D Printing in Medicine,2019,5(1).doi:10.1186/s41205-019-0052-0.
[74]GENG Xiao,LI Yang,LI Feng,et al.A new 3D printing porous trabecular titanium metal acetabular cup for primary total hip arthro-plasty:A minimum 2-year follow-up of 92 consecutive patients[J].Journal of Orthopaedic Surgery and Research,2020,15(1).doi:10.1186/s13018-020-01913-1.
[75]PERTICARINI L,ROSSI S M P,MEDETTI M,et al.Clinical and radiological outcomes of acetabular revision surgery with trabecular titanium cups in Paprosky type Ⅱ and Ⅲ bone defects[J].Journal of Orthopaedics and Traumatology,2021,22(1).doi:10.1186/s10195-021-00571-1.
[76]de MEO F,CACCIOLA G,BELLOTTI V A,et al.Trabecular titanium acetabular cups in hip revision surgery:Mid-term clinical and radiological outcomes[J].HIP International,2018,28(sup2):61-65.
[77]WAN Lei,WU Guangliang,CAO Pengke,et al.Curative effect and prognosis of 3D printing titanium alloy trabecular cup and pad in revision of acetabular defect of hip joint[J].Experimental and Therapeutic Medicine,2019,18(1):659-663.
[78]LI Qingtian,CHEN Xuepan,LIN Bofu,et al.Three-dimensional technology assisted trabecular metal cup and augments positioning in revision total hip arthroplasty with complex acetabular defects[J].Journal of Orthopaedic Surgery and Research,2019,14(1).doi:10.1186/s13018-019-1478-1.
[79]PORTER J A.FRAUNHOFER J A V.Success or failure of dental implants?A literature review with treatment considerations[J].General Dentistry,2005,53(6):423-432.
[80]COSTA B C,TOKUHARA C K,ROCHA L A,et al.Vanadium ionic species from degradation of Ti-6Al-4V metallic implants:In vitro cytotoxicity and speciation evaluation[J].Materials Science & Engineering C-Materials for Biological Applications,2019,96:730-739.
收稿日期:2021-10-07;修回日期:2021-10-25;责任编辑:冯 民
基金项目:河北省自然科学基金(E2017208128);河北省技术创新引导计划(20477706D);石家庄市科学技术研究与发展计划(201200313A)
第一作者简介:张永弟(1976—),女,河北景县人,副教授,硕士,主要从事增材制造技术方面的研究。
通讯作者:楊 光教授。E-mail:y_guang@126.com
张永弟,王琮瑜,王琮玮,等.
增材制造医用多孔钛合金研究与应用现状
[J].河北科技大学学报,2021,42(6):601-612.
ZHANG Yongdi,WANG Congyu,WANG Congwei,et al.
Research and application status of medical porous titanium alloy formed by additive manufacturing
[J].Journal of Hebei University of Science and Technology,2021,42(6):601-612.

