盐碱地白刺不同部位微生物群落高通量分析
艾海白尔·卡斯木,樊永红,迪拉热·海米提
(新疆大学生命科学与技术学院,乌鲁木齐 830046)
0 引 言
【研究意义】白刺在我国主要分布在西北干旱,高寒地区及北方的盐渍地带,白刺属蒺藜科多年旱生或超旱生落叶小灌木,该树根系发达,多分枝,生长快,抗旱性强,能够在重盐碱地生长,能在沙漠盐碱等恶劣环境下生存,有较好的水土保持效果。利用白刺跟其根际微生物的互作机制,是改良土壤盐碱化,提高盐渍化土地利用效率,并对土壤起持久利用和改良作用的一项有效途径[1-3]。农耕土壤有的盐碱化和沙漠化趋势[4],过量施用化肥和农药会使土壤盐碱化、板结[5]。盐生植物除了自己适应盐碱和沙漠环境的特性之外,其根际微生物和内生菌,在其适应逆境和新陈代谢过程中起着有利的作用[6],土壤微生物是一类数量多、分布广泛的微生物群类,参与有机物的分解,无机化合物的增溶,养分转移和能量释放等[7]。全球土壤中微生物的种类可达数万种,数量高达1029数量级[8]。【前人研究进展】目前土壤微生物作用于植被、农作物、土壤修复等方面的研究较多,尤其是一些有特定功能的植物内生微生物和根际微生物[9]。根际微生物是指位于根系周围土壤的微生物组,由于植物根系分泌物的影响,根际微生物种类和多样性与根际外土壤的微生物存在一定的差异[10]。种类繁多、数量庞大的根际微生物中有许多对植物有益的微生物群落,有的跟植物激素新陈代谢有关,有的可以诱导植物产生抗逆性等[11]。内生菌指的是植物根、茎和叶片等部位的内生菌群,功能与根际微生物大致相似。一些根际微生物可以在根内定植,发挥其有益价值[12]。【本研究切入点】土壤中微生物的可培养率仍然很低,只有0.1%到1%。以编码16S rDNA基因为基础的高通量测序技术灵敏度高,准确性佳,具有较高的高通量,已经广泛用于微生物菌群结构与遗传功能多样性的研究领域[13-15]。【拟解决的关键问题】运用Novaseq测序平台对白刺根际土壤和叶片进行16SrDNA-V4区和ITS1区测序,对序列数据进行生物信息学分析,评价物种的Chao1指数、shannon指数以及Alpha多样性。
1 材料与方法
1.1 材 料
选取新疆五家渠市103团的盐碱地的白刺,样点之间的距离不少于1 km,并用铲除法收集其根部10~20 cm处根际土壤,把附在白刺根部的土壤也一起抖下来,用无菌密封袋封好置于冰盒中(BS1、BS2、BS3)。相对应的叶片连同树枝一并收起来,用无菌密封袋封好,置于冰盒中(BP1、BP2、BP3)。将置于冰盒的样本带回实验室,置于-20℃的冰箱保存,一部分用于根际土壤和叶片的高通量测序,另一部分用于根际微生物和叶片内生菌的筛选。
1.2 方 法
1.2.1 叶片表面消毒
叶片的表面消毒采用参考文献[16]的方法,消毒后用无菌袋封好,备用高通量测序。
1.2.2 土壤和叶片16S rDNA基因测序
采用 CTAB 或 SDS 方法[17]对样本基因组 DNA 提取,鉴定细菌16S V4区引物515F和806R多样性;鉴定真菌ITS1区引物ITS5-1737F和ITS2-2043R多样性,测定方法参考文献[18-19]。PCR产物使用2%浓度的琼脂糖凝胶电泳检测;等量混样PCR产物浓度进行,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,目的条带使用qiagen公司提供的胶回收试剂盒回收产物。使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒文库构建,构建好文库经过Qubit和Q-PCR定量,文库合格后,使用NovaSeq6000上机测序[20]。
1.2.3 测序数据
下机数据拆分,去除Barcode和扩增子序列用,FLASH(V1.2.7, http://ccb.jhu.edu/software/FLASH/)对每个样本的序列拼接,得到高质量序列(clean tags)。参照Qiime(V1.9.1,http://qiime.org/scripts/split_libraries_fastq.html)的序列质量控制操作,去除嵌合体序列,得到最终有效序列(effective tages)[21-22]。
1.3 数据处理
对前述获得有效序列,利用Uparse软件(Uparse v7.0.1001,http://www.drive5.com/uparse/)以默认97%的相似度进行OTUs(Operational Taxonomic Units)划分,出现频率最高的序列为OTUs代表序列。基于OTUs代表序列进行聚类和物种注释分析,在各分类水平上统计样本的群落组成,对样本的数据均一化处理,均一化数据进行OTUs丰度、venn图、α多样性分析,获得群落结构和物种多样性信息[23]。
所有数据用Excel 2019进行整理,用Graphpad prism8.4软件进行作图和数据统计分析。
2 结果与分析
2.1 白刺根际土壤及叶片内生细菌和真菌生物种丰度与多样性
研究表明,根际土壤样本和叶片样本分别测得62 102、68 195、65 588、79 637、70 590、77 015和45 369、46 114、68 429、74 781、71 023、76 083条序列,测序序列条数趋于平稳,在增加测序深度只会产生极少量OTUs,测序深度足够。过滤和去除无法被聚类到的OTUs低频序列,再剔除叶绿体和线粒体序列,在97%的序列相似性水平上,有效序列最终可划分为61 977、68 147、65 516、68 122、64 393、68 690和45 366、46 079、67 393、66 776、60 092、66 793条有效序列。3个土壤样本细菌的OTUs数分别为1 235、1 378、1 390,共含的OTUs数为916,其占文库OTUs总数的22.88%;3个土壤样本真菌的OTUs数分别为334、543、404,共含的OTUs数为184,其占文库OTUs总数的14.36%。3个叶片样本内生细菌的OTUs分别为333、260、243,共含的OTUs数为152,其占总文库OTUs数的18.18%;3个叶片样本内生真菌的OTUs数分别为51、21、21,共含的OTUs数为15,其占总文库OTUs数的16.12%。无论是细菌还是真菌,根际土壤的微生物种类丰富度都远高于叶片,分别高6倍和12倍。
细菌BS1号土壤样本的Chao1指数和Shannon指数最高,分别为7.88和1 503.46,说明其细菌种类丰富度和多样性最高;对于真菌BS2号土壤样本的Chao1指数和Shannon指数最高,分别为4.53和579.40,其真菌物种丰富度和多样性最高;叶片样本中,细菌BP1号样本的Chao1指数和Shannon指数最高,分别为2.25和375.98,其细菌种类丰富度和多样性最高;真菌BP3号样本的Shannon数最高,其数值为1.563,BP1的Chao1指数为最高,其数值为59.67,前者物种丰富度最高,后者物种种类最多。Chao1指数和Shannon指数的结果与OTUs的结果一致。根际土壤的物种丰富度和种类多样性高于叶片;细菌的物种丰富度和种类多样性高于真菌。表1,表2,图1

图1 白刺不同部位微生物稀释曲线及韦恩图Fig 1 Microbial dilution curve and Wayne diagram of different parts of Nitraria tangutoru

表1 白刺根际土壤及叶片内生细菌和真菌的物种丰度与多样性Table 1 Abundance and diversity of endophytic bacteria and fungi in rhizosphere soil and leaves

表2 不同分类水平的物种注释Table 2 The classified phylotypes detected at different taxonomical levels
2.2 白刺不同部位门水平微生物群落组成与多样性差异
研究表明,根据物种注释结果,选取每个样本在门水平上丰度前10的物种。根际土壤样本中,不同样本之间土壤细菌门分类水平上的差异极显著(P<0.01),细菌丰度前10的有:放线菌门(Actinobacteria),变形菌门(Proteobacteria),芽单胞菌门(Gemmatimonadetes),拟杆菌门(Bacteroidetes),浮霉菌门(Planctomycetes),酸杆菌门(Acidobacteria),庞微菌门(Verrucomicrobia),厚壁菌门(Firmicutes) 绿弯菌门(Chloroflexi) ,其中丰度较高的菌门是放线菌门(Actinobacteria),变形菌门(Proteobacteria),芽单胞菌门(Gemmatimonadetes);土壤真菌只测到物种丰度前7的物种,不同样本之间土壤真菌门水平上的差异极显著(P<0.01),其物种分别为子囊菌门(Ascomycota),担子菌门(Basidiomycota),毛霉亚菌门(Mucoromycota),被孢霉菌门(Mortierellomycota),球囊菌门(Glomeromycota),壶菌门(Chytridiomycota),隐真菌门(Rozellomycota)等,其中丰度最高的是子囊菌门(Ascomycota);叶片样本中,不同样本之间细菌门水平上的差异极显著(P<0.01),细菌丰度前10的有:蓝细菌门(Cyanobacteria),放线菌门(Actinobacteria),变形菌门(Proteobacteria),厚壁菌门(Firmicutes),拟杆菌门(Bacteroidetes),芽单胞菌门(Gemmatimonadetes),栖热菌门(Deinococcus-thermus),酸杆菌门(Acidobacteria),绿弯菌门(Chloroflexi),其中丰度最高的是蓝细菌门(Cyanobacteri)和放线菌门(Actinobacteria);叶片真菌只检测到物种丰度前3的物种,不同样本之间叶片真菌门水平上的差异极显著(P<0.01),其物种分别为:子囊菌门(Ascomycota),被孢霉菌门(Mortierellomycota),担子菌门(Basidiomycota),其中丰度最高的是子囊菌门(Ascomycota)。土壤微生物的物种丰度比叶片的高。在门分类水平上,土壤细菌与叶片细菌差异极显著(P<0.01),土壤真菌与叶片真菌差异显著(P<0.05)。表3,表4,图2

表3 白刺不同部位细菌门水平上含量Table 3 The content of different parts of Nitraria tangutorum at the level of bacteria phylum
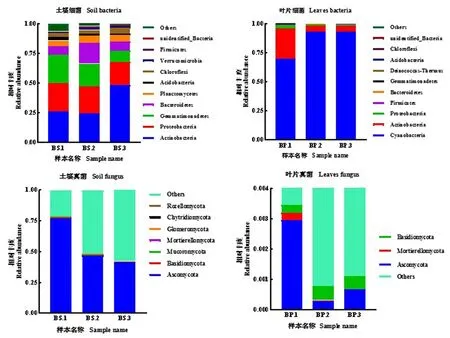
图2 白刺不同部位微生物门水平上的相对丰度Fig 2 The relative abundance of different parts of Nitraria tangutorum at the level of microflora

表4 白刺不同部位真菌门水平上的含量Table 4 The content of different parts of Nitraria tangutorum at the level of fungus phylum
2.3 白刺不同部位属水平微生物组成与多样性差异
研究表明,土壤和叶片微生物属水平上的群落丰度和种类差异明显。不同土壤样本中,土壤细菌属水平上的差异极显著(P<0.01),其中BS3号样本的细菌丰度比其他两个样本较高,种类较多。土壤细菌的大部分菌属被聚类到酸杆菌门、放线菌门、拟杆菌门、蓝细菌门、厚壁菌门、芽单胞菌门、变形菌门。不同土壤样本中,土壤真菌属水平上的差异极显著(P<0.01),其中BS2号样本的真菌丰度比其他两个样本较高,种类较多。土壤真菌的大部分菌属被聚类到子囊菌门、担子菌、被孢霉菌门、毛霉菌门。不同叶片样本中,叶片细菌属水平上的差异极显著(P<0.01) ,叶片真菌属水平上的差异不显著,其中BP1号样本的细菌和真菌丰度最高,种类最多,叶片细菌的大部分菌属被聚类到放线菌门、拟杆菌门、蓝细菌门、厚壁菌门、变形菌门;叶片真菌的大部分菌属被聚类到子囊菌门,担子菌门,被孢菌门。属水平上的优势菌属数量上存在土壤细菌>叶片细菌>土壤真菌>叶片真菌的数量关系,细菌和真菌在根际土壤的分布比叶片较均匀;土壤细菌和土壤真菌的多样性比叶片细菌和叶片真菌较高。土壤细菌和叶片细菌在属分类水平上差异极显著(P<0.01);土壤真菌和叶片真菌在属分类水平上差异极显著(P<0.01)。表5,表6,图3
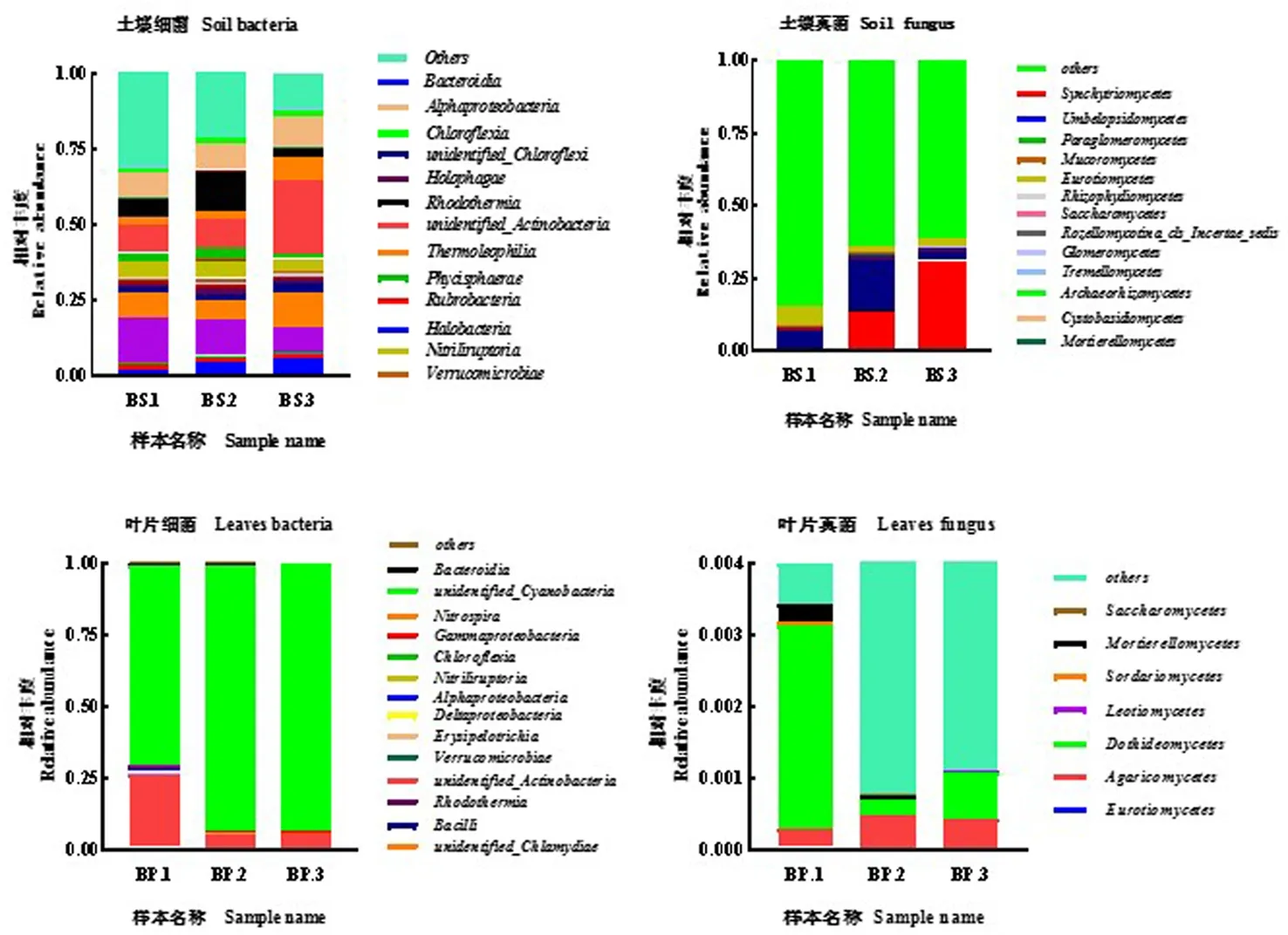
图3 白刺不同部位微生物属水平Fig 3 Cluster analysis of microbial genera in different parts of Nitraria tangutorum

表5 白刺不同部位细菌属水平的优势菌群分布Table 5 Distribution of dominant flora at bacterial genus level in different parts of Nitraria tangutorum

表6 白刺不同部位真菌属水平的优势菌群分布Table 6 Distribution of dominant flora at fungus genus level in different parts of Nitraria tangutorum
2.4 白刺不同部位微生物群落主坐标
研究表明,白刺不同部位微生物第一主坐标和第二主坐标的贡献率。其中土壤细菌第一主坐标(PC1)的贡献率为68.08%,第二主坐标(PC2)的贡献率为31.91%;叶片细菌的第一主坐标(PC1)的贡献率为99.85%,第二主坐标(PC2)的贡献率为0.15%;土壤真菌第一主坐标(PC1)的贡献率为85.17%,第二主坐标(PC2)的贡献率为14.29%;叶片真菌第一主坐标(PC1)的贡献率为96.73%,第二主坐标(PC2)的贡献率为3.27%。白刺各样点之间的微生物群落结构差异较为明显。图4

图4 白刺不同部位微生物群落主坐标Fig 4 microbialprincipal coodrdinates analysis of different parts of Nitraria tangutorum
3 讨 论
经序列比对发现在土壤样本中细菌优势菌门是放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、芽单胞菌门(Gemmatimonadetes) ,变形菌门(Proteobacteria)是革兰氏阴性菌,是一类富营养化细菌,这些细菌与营养元素的含量成正相关,在生物控制和植物生长方面发挥着重要的作用,营养元素含量对全球碳、氮循环至关重要[24]。放线菌门(Actinobacteria)能产生多种次生代谢产物,如抗生素、胞外酶这些物质在植物病害的防治中发挥着重要作用。变形菌门(Proteobacteria)和放线菌门(Actinobacteria)丰度高,有利于改善土壤质量,增加土壤养分含量,增强抗逆性,促进植物生长,有利于土壤微生态的可持续发展[25]。叶片样本的细菌优势菌门是蓝细菌门(Cyanobacteria)、放线菌(Actinobacteria)、变形菌门(Proteobacteria) ,蓝细菌可以产生水杨酸、生长素和细胞因子,所产生的生物活性物质可以抑制一些有害细菌的生长,分泌植物激素来促进植物生长和诱导植物抗病,提高植物体内和土壤的养分含量来支持植物生长[26]。根际土壤和叶片的两个样本的优势真菌群落是子囊菌门(Ascomycota),子囊菌门大都陆生,营养方式有腐生、寄生和共生,腐生的子囊菌可以引起木材、食品、布匹和皮革的腐烂以及动植物残体的分解[27]。有利于白刺在营养缺乏的盐碱环境,通过腐蚀的方式为自身提供有机物质。还检测到了一些低丰度的微生物菌落:庞微菌门(Verrucomicrobia),栖热菌门(Deinococcus-thermus)、隐真菌门(Rozellomycota、梳霉菌门(Kickxellomycota)、昆虫霉菌门(Entomophthormycota)等。测序结果显示出了新一代测序技术的优势,虽然高通量测序方法检测到很多基因序列,但是有些序列未能分类,因为有些微生物在植物体内以特定的形式存在,芽孢杆菌门在植物体内大多数是以孢子形式存在,目前采用的SDS方法提取植物组织DNA,存在植物组织裂解不完全等问题,导致未能获取该类群的基因组DNA[28]。
土壤中有些与促生有关的微生物跟植物根部形成互利作用,有些促生菌有一定程度的定殖力,可以定殖根内、茎和叶子等部位[29]。这类植物根际促生长菌株通常命名为(Plant growth-promoting rhizobacteria.PGPR),研究发现的促生菌属主要有假单胞菌属(Pseudomonasssp.)、芽孢杆菌属(Bacillusssp.)、克雷伯氏菌属(Klebsiellassp.)、肠杆菌属(Enterobacterssp)、固氮菌属(Azotobacteerssp.)等[30]。PGPR主要是通过参与植物新陈代谢来实现自己的作用机制。植物在生长过程中,通过光合作用合成多种能够被PGPR消化吸收的糖类、有机酸和维生素等营养物质,这些营养物质同时被PGPR作为物质代谢途径有关的信号分子。PGPR通过分泌一些激素或生长素类似物来降低植物体内分泌过量的一些植物激素[31]。乙烯是一种植物激素,与植物和果实的成熟相关。但是在高温、高盐碱和水资源极度匮乏等逆境条件下植物会分泌过多的乙烯,将导致植物严重脱水甚至枯死,但是PGPR通过分泌降解乙烯合成前体的酶来降低植物逆境下的乙烯含量[32]。白刺长期生长在盐碱环境中,其适应盐碱环境除了白刺自身的植物学特性之外,根际微生物起到决定性作用[33]。
PGPR可以促进植物根部的伸长、提高植物鲜重和株高、提高农作物产量。通过菌剂处理种子可有效的对植物进行诱导,提高植物的抗旱性能,产生超氧化物歧化酶(SOD)和过氧化物酶(APX)等来减少植物体内H2O2的积累,减少过氧化物带来的氧化损伤,下调Le25和SIERF84等干旱基因的表达[34]。PGPR可以提高土壤速效钾、速效磷含量。解钾细菌改善毛竹林的土壤肥力,蓝曲霉JP-NJI和嗜松青霉JP-NJ4提高了松树林土壤速效磷和速效钾含量,丰富了解磷微生物的种质资源[35,36]。
铁在自然界中以Fe3+的形式存在,导致土壤中的植物和细菌无法获得和利用。微生物产生低分子量(近200~2000Da)铁载体,在微生物体内铁载体主要分为两类,真菌产生的羟肟酸类(Hydroxamate-type siderophores)铁载体和细菌产生的邻苯二酚类( Catecholate-type siderophores)铁载体。Fe3+跟微生物分泌的铁载体进行耦合,进入微生物体内,通过氧化还原反应形成Fe2+,其容易被吸收。铁载体还可以耦合其他重金属,使植物减少重金属中毒[37]。IAA是一种生长素,目前的研究中嗜酸菌和假单胞菌是IAA的主要生产菌。在干旱胁迫下IAA也能够刺激植物根系的生长,提高植物对土壤水分的吸收[38]。氮是植物体内氨代谢所需的重要元素之一,土壤中的固氮菌将空气中的NO2转化为容易被植物吸收的氨。固氮菌与植物以共生和非共生的形式存在,研究表明豆科植物根与根瘤菌共生形式存在;蓝藻,固氮螺菌属,梭状芽胞杆菌属等与植物不会形成独特的共生结构,提出了对新一类的固氮菌的认识和研究[39]。赤霉素和细胞分裂素可提高作物种子的萌发率,缩短萌发时间[40]。为了提高铁载体的产量,通过ARTP方法诱导选育具有高铁载体能力的细菌T0,其中突变体T7-14的铁载体产量最高达6.0mmol/g,比T0提高了155%[41]。
高通量测序与一些技术联用,可提高测序效率,尤其催化报告沉积荧光原位杂交技术(CARD-FISH) ,两者的联用不仅能在群落水平研究PGPR,而且能进一步精准地在单细胞水平上对PGPR进行研究,对PGPR与环境之间的物质传递、信号传递和新陈代谢等途径的研究有重要意义[42]。
4 结 论
白刺根际土壤和叶片内生微生物各分类水平上的群落结构和物种丰富度,各样本的优势菌群及不同样点之间微生物群落构成的差异,优势菌群中可能存在使白刺适应高盐碱、干旱等环境变化的细菌,这些细菌的存在对白刺在逆境下自我保护起到积极作用。

