Fe3 O4/MoS2 复合材料的制备及其对丁基钾黄药的降解性能
常亮亮,韩姿怡,陈杰杰,王英杰,李乐乐,徐 珊,郭晋邑
(陕西省尾矿资源综合利用重点实验室/商洛学院,陕西商洛 726000)
1 前 言
随着采矿规模逐步扩大,浮选药剂的使用量也随之增加。浮选废水中残留的高毒性、高污染药剂一旦排放到水中,必然导致生态环境恶化。黄药是最常用、最有效的硫化矿捕收剂,能增加矿物表面的疏水性,使其容易粘附气泡,从而提高矿物的可浮性。然而,由于废水处理系统设计不合理,尾矿中往往会残留大量的黄药。它会对动物、人类和自然生态系统造成严重危害[1],比如黄药对人的中枢神经系统具有明显的抑制作用;动物可死于呼吸衰竭;当浓度达到15 mol/L时,会杀死大部分鱼类;即使在尾矿废水中残余量极少的情况下,也会使周围散发着恶臭[2]。因此,研究黄药的处理方法对矿区环境保护具有十分重要的意义。
光催化是一种降解剧毒和易致癌有机污染物的最有效技术。采用光催化降解浮选废水中的黄药已有相关报道,付保军等[3]发现TiO2悬浮液对异丁基黄药的光催化降解性能良好;廖河东等[4]制备了Cu WO4,探索发现其对黄药的光催化性能良好;杨状等[5]研究了复合材料Bi VO4/Zn O 对丁基黄药的光降解性能,在模拟太阳光下去除效果良好。但是这些光催化剂仍存在着可见光下量子产率低,难以回收利用等问题。
MoS2是一种层状过渡金属硫化物,具有特定表面积大、导电性好、化学反应性高、可调节带隙能(1.2~1.9 e V)[6-11]等优良特性,广泛应用于光解水产氢、能量转换/存储、超级电容器和污染物降解方面。1999年Thurtoton等[12]采用纳米MoS2作为光催化材料,利用可见光降解苯酚,单层MoS2禁带宽度约为1.8~1.9 e V,与TiO2(禁带宽度为3.0~3.2 e V)相比,对可见光具有很强的吸收作用,能够克服TiO2的缺陷,在太阳能利用方面具有更大的优势;Ma等[13]通过控制物质的量比(nMo∶nS)水热合成了多缺陷MoS2纳米片,不仅具有高比表面积,并且分子层边缘还具有大量的活性位点,表现出超高的压电催化活性,30 s内能够降解99%的环丙沙星;Lei等[14]制备了对染料分子具有良好光催化性能的Ni Te2/MoS2。虽然MoS2的光催化活性高,但因难以回收利用,限制了其的应用。Fe3O4是一种传统的过渡金属氧化物纳米粒子(NPs),具有匹配的能带结构可以增强光生电荷的分离和提升量子传输速率[15],能有效提高光催化性能,因此引起了人们的广泛兴趣。那些引入Fe3O4的杂化纳米催化剂,如TiO2/Fe3O4、Bi2O3/Fe3O4和g-C3N4/Fe3O4等都表现出单组分催化剂无法达到的性能[16]。因此,本研究制备Fe3O4/MoS2复合水处理剂,研究其对丁基黄药的光催化性能,以建立水处理剂的组成-性能之间的关系,为MoS2基水处理剂在工业上的推广使用奠定基础。
2 实 验
2.1 试剂与仪器
实验所用试剂有硫脲(H2NCSNH2),四水合钼酸铵 ((NH4)6Mo7O24·4H2O),无 水 乙 酸 钠(CH3COONa),十六烷基三甲基溴化铵(C19H42Br N,CTAB),乙二醇(CH2OH)2),三氯化铁(FeCl3),柠檬酸(C6H8O7),丁基钾黄药(C4H9COS2K,PBX),重铬酸钾(K2Cr2O7)和丙酮(CH3COCH3)等,均为外购分析纯。
采用模拟日光氙灯光源(PLS-SXE300)进行光降解实验;采用紫外-可见-近红外分光光度计(UV-Vis,Cary 5000)测试溶液浓度;利用扫描电子显微镜(SEM,S4800),透 射 电 子 显 微 镜 (TEM,YQ2006000256),X 射线衍射仪(XRD,D/max-2200X)和振动样品磁强计(VSM,7410)等表征材料的形貌、结构和磁性能;将样品涂覆于铟锡氧化物导电玻璃上作为工作电极,Pt箔(99.9%)作为对电极,饱和甘汞电极作为参比电极,以300 W 氙灯为光源。通过电化学工作站(CHI-660D)测量样品的瞬态光电流。
2.2 Fe3 O4/MoS2 复合材料的制备
2.2.1 MoS2的制备 取2.47 g(NH4)6Mo7O24·4H2O 和一定量的H2NCSNH2(nMo∶nS为1∶5)溶于70 m L去离子水中,剧烈搅拌30 min后,将溶液转移到100 m L聚四氟乙烯内衬的反应釜内,210℃下水热反应18 h。待反应釜冷却至室温,将所得产物离心分离,用去离子水和无水乙醇分别清洗3~5 次,之后60 ℃下干燥12 h,得到所需产物。
2.2.2 Fe3O4/MoS2复合材料的制备 称量0.8 g FeCl3和一定量的MoS2,加入到40 m L(CH2OH)2中搅拌至澄清,再加入3.6 g CH3COONa 和3.6 g CTAB,将混合液搅拌至澄清后转移到100 m L聚四氟乙烯内衬的反应釜中,180 ℃下水热反应20 h,所得产物用去离子水和无水乙醇清洗,之后60 ℃下干燥12 h,即得所需产物。制备5,10,15,20,25 wt%负载量Fe3O4的复合材料分别标记为5%-Fe3O4/MoS2,10%-Fe3O4/MoS2,15%-Fe3O4/MoS2,20%-Fe3O4/MoS2和25%-Fe3O4/MoS2。Fe3O4/MoS2复合粉体制备流程见图1。

图1 Fe3 O4/MoS2 复合材料的制备工艺流程Fig.1 Schematic synthesis of Fe3 O4/MoS2
纯Fe3O4的制备方法与Fe3O4/MoS2复合材料相同,只是在前驱体中不添加MoS2。
2.3 光催化性能测试
以含PBX 的模拟废水作为目标降解物,来评价Fe3O4/MoS2的光催化活性。配制浓度为40 mg·L-1的PBX 溶液后取50 m L 于夹套玻璃反应容器中,再投入25 mg光催化剂,经30 min暗反应后,使悬浮液达到吸附-脱附平衡。选用300 W 氙灯作为模拟太阳光光源,进行光降解反应,整个反应过程中使用循环水冷却以减少误差。光照开始后,在一定时间间隔,从悬浮液中取出4 m L 溶液,经离心分离后,使用UV-Vis对上层清液进行测试,对PBX 的浓度进行分析。样品的去除率D可由式(1)计算所得:

式中:C0为PBX 的初始浓度;C为PBX 在t时刻的浓度。
3 结果与讨论
3.1 样品表征
3.1.1 结构与形貌 图2是Fe3O4,MoS2及不同组分的Fe3O4/MoS2粉体的XRD 图谱。从图可见,随着Fe3O4添加量的提高,复合材料的XRD 图谱不仅有MoS2特征峰,而且有Fe3O4的特征峰。添加5 wt%Fe3O4时,仅观察到MoS2的特征峰,这是因为Fe3O4相对含量偏低。当Fe3O4添加量为15 wt%时,(220)、(311)、(400)、(511)晶面所对应的衍射峰开始较明显地出现在复合材料的XRD 图谱上;而当Fe3O4添加量为20 wt%时,能较为明显地观察到(440)晶面所对应的衍射峰。因此,随Fe3O4含量提高,复合材料中MoS2对应的衍射峰强度不断减小,Fe3O4衍射峰增强,说明了MoS2和Fe3O4形成了复合材料。

图2 Fe3 O4、MoS2 和Fe3 O4/MoS2 粉体的XRD图谱Fig.2 XRD patterns of Fe3 O4,MoS2 and Fe3 O4/MoS2 composites
从图3可以看出团聚颗粒是由许多密集的纳米片组成的花瓣状结构,每一片MoS2都呈“小而薄”的表面形貌,且单层MoS2纳米片尺寸约为200 nm。从图4可以看出,在水热条件下成功制备出了大小均一,分散均匀的球形Fe3O4纳米粒子。从图5 可以看出,负载15 wt%Fe3O4纳米粒子后,MoS2纳米片边缘变得平滑,卷曲程度增大,并且纳米片“薄而多”的形貌特征消失,说明MoS2纳米片经二次水热后厚度增加,纳米片尺寸范围为200~300 nm。同时,Fe3O4NPs较为均匀地负载在MoS2表面上,其直径范围为200 nm 左右,不仅增加了材料比表面积,还提高了材料的磁性能。TEM 观察结果可以看出花状MoS2互相堆叠形成团簇状形貌(图6(a)),而在图6(b)中可以更加清晰的看出,MoS2确由薄纱状的纳米片卷曲和重叠而成,并且MoS2边缘厚度最薄。其中Fe3O4被MoS2纳米片包围,这种结构能够保证复合材料边缘最大限度暴露出来,有利于提高其光催化活性。

图3 低倍率和高倍率下MoS2 粉体的SEM 照片Fig.3 SEM images of MoS2

图4 低倍率和高倍率下Fe3 O4 粉体的SEM 照片Fig.4 SEM images of Fe3 O4

图5 低倍率和高倍率下15%-Fe3 O4/MoS2 复合材料的SEM 照片Fig.5 SEM images of Fe3 O4/MoS2

图6 低倍率和高倍率下15%-Fe3 O4/MoS2 复合材料的TEM 照片Fig.6 TEM images of Fe3 O4/MoS2
3.1.2 磁滞回线 利用VSM 测定室温下Fe3O4和Fe3O4/MoS2复合粉体的磁滞回线,测试结果如图7所示。从图可见,Fe3O4具有较高的饱和磁化强度(76.03 emu·g-1),矫顽力几乎为0;随Fe3O4含量的增加,Fe3O4/MoS2的饱和磁化强度逐渐增大,5%-Fe3O4/MoS2、10%-Fe3O4/MoS2、15%-Fe3O4/MoS2、20%-Fe3O4/MoS2、25%-Fe3O4/MoS2粉体的饱和磁化强度分别为0.75、3.82、11.27、15.70 和19.87 emu·g-1,这是由磁性复合粉体中磁性材料所占的比重增大所致;15%-Fe3O4/MoS2在外界磁场的作用下,能够在1 min内较快地被磁铁吸引,使溶液变澄清。说明15%-Fe3O4/MoS2能较为迅速地实现固液分离,从而可实现回收利用且避免二次污染。

图7 不同质量分数Fe3 O4/MoS2 粉体的磁滞回线图(内插图为磁铁吸附15%-Fe3 O4/MoS2 展示)Fig.7 M-H curves of Fe3 O4/MoS2 composites with different Fe3 O4 component ratios(Inset photograph:display of magnetic properties of 15%-Fe3 O4/MoS2)
3.1.3 光学性能 从图8 插图中可以看出,与MoS2相比,15%-Fe3O4/MoS2在可见光范围内吸收率增强,这可能是因为窄带隙(0.1 e V)Fe3O4的掺入,提高了Fe3O4/MoS2的可见光吸收能力。MoS2的禁带宽度随层数的增加而减少,单层MoS2禁带宽度为1.8~1.9 e V,而块体MoS2禁带宽度为1.2 e V[17]。根据Tauc plot法绘图可得到图8,图中MoS2禁带宽度为1.75 e V,15%-Fe3O4/MoS2禁带宽度为1.68 e V,与已有研究[17]基本符合。

图8 MoS2 和15%-Fe3 O4/MoS2 的Tauc plot曲线图(内插图为UV-Vis DRS图)Fig.8 Tauc plot curve of MoS2 and Fe3 O4/MoS2(inset photograph:UV-Vis DRS image of MoS2 and Fe3 O4/MoS2)
半导体材料中电子和空穴的分离可以产生光电流,高光电流意味着高的光生电子-空穴对的分离效率。由图9 瞬态光电流响应结果可知,15%-Fe3O4/MoS2电极的光电流约是MoS2的6倍。图10展示了MoS2和15%-Fe3O4/MoS2的EIS曲线。通常,半导体材料的EIS的曲线为半圆弧,其直径与电荷转移电阻有关。相比MoS2,15%-Fe3O4/MoS2电极的EIS半径更小,表明界面处的光生电荷具有较高的转移率和较低的复合率。这些测试结果证实,Fe3O4纳米粒子的引入,可以有效地降低电子/离子输运电阻,从而增强可见光诱导电荷转移效率,提高MoS2光催化性能。

图9 MoS2 和15%-15%-Fe3 O4/MoS2 在300 W 氙灯下的光电流瞬态响应Fig.9 Photocurrent transient response of MoS2 and 15%-Fe3 O4/MoS2 under 300W xenon lamp

图10 MoS2 和15%-Fe3 O4/MoS2 的电化学阻抗谱Fig.10 EIS curves of MoS2 and 15%-Fe3 O4/MoS2
3.2 Fe3 O4/MoS2 对丁基钾黄药的降解性能
3.2.1 Fe3O4添加量对Fe3O4/MoS2光催化性能的影响 MoS2与不同质量分数Fe3O4进行复合,考察所制备的Fe3O4/MoS2在300 W 氙灯下对PBX 降解效果,结果如图11所示。从图可见,Fe3O4能够降解部分PBX,MoS2、Fe3O4/MoS2则能够有效降解PBX。从MoS2和不同质量分数Fe3O4/MoS2的降解曲线变化趋势来看,经过145 min光照后,MoS2的降解率为70.84%,而10%-Fe3O4/MoS2和15%-Fe3O4/MoS2降解PBX 的效果十分明显,降解率分别为90.32%和94.11%;相比之下,20%-Fe3O4/MoS2和25%-Fe3O4/MoS2的降解效果有所下降,对应的降解率分别为82.11%和58.34%,产生这种现象可能是由于Fe3O4掺入量过多导致MoS2材料本身的光催化性能降低。采用准一级反应模型ln(C/C0)=kt(k是反应速率常数)[18]考察降解PBX 的动力学过程,如图12 所示。Fe3O4, MoS2,5%-Fe3O4/MoS2,10%-Fe3O4/MoS2,15%-Fe3O4/MoS2,20%-Fe3O4/MoS2和25%-Fe3O4/MoS2的K值分别是0.00222,0.00844,0.01388,0.01643,0.02037,0.01206 和0.00597,表明引入Fe3O4均能不同程度地提高MoS2的降解速率。其中15%-Fe3O4/MoS2的降解速率最高,是纯MoS2的2.41倍,这也与样品的光电流相应和阻抗测试结果相一致。考虑到光催化降解和磁性回收效果,因此选择15%-Fe3O4/MoS2作为后续实验所用的催化剂。

图11 不同质量分数Fe3 O4/MoS2 粉体的光催化降解图Fig.11 Photocatalytic degradation diagram of Fe3 O4/MoS2 composites with different Fe3 O4 component ratios

图12 不同质量分数Fe3 O4/MoS2 粉体的降解动力学曲线Fig.12 Degradation kinetics of Fe3 O4/MoS2 composites with different Fe3 O4 component ratios
3.2.2 Fe3O4/MoS2光催化剂的稳定性评价 为考察所制备的Fe3O4/MoS2光催化剂的稳定性,在实验误差允许的范围内对其进行了6次重复利用实验。从图13可以看出材料重复使用6次后,经145 min光照对PBX 的去除率下降至35%,而重复使用3次后,去除率仍高达85%,这说明为保证Fe3O4/MoS2较好的光催化活性,应将循环使用控制在3次以内。
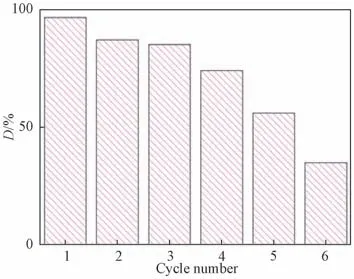
图13 15%-Fe3 O4/MoS2 光催化循环利用Fig.13 Recyclability of 15%-Fe3 O4/MoS2
3.2.3 Fe3O4/MoS2光降解机理 为了研究Fe3O4/MoS2复合材料的降解机理,进行了·OH 和h+捕获实验。在捕获实验中,乙二胺四乙酸二钠盐(EDTA-2Na)和异丙醇(IPA),分别作为h+猝灭剂和·OH 猝灭剂。图14 表明,加入IPA 对15%-Fe3O4/MoS2的光降解活性影响较小,而加入EDTA-2Na对15%-Fe3O4/MoS2的光降解活性影响较大。由此可以推论,·OH 自由基对材料的光催化降解性能影响很弱,在光降解过程中可能不存在·OH。根据文献[19-21]画出的Fe3O4和MoS2的价带(VB)如图15所示。Fe3O4的VB[19-20](0.27 e V)和MoS2

图14 不同捕获剂对15%-Fe3 O4/MoS2 光催化性能的影响Fig.14 Photodegradation efficiencies of 15%-Fe3 O4/MoS2 in the presence of different scavengers

图15 Fe3 O4和MoS2 的带位置和带隙Fig.15 Band positions and band gap energies of Fe3 O4 and MoS2
[12]的VB(1.92 e V)比-OH/·OH(2.4 e V)氧化电位更负,因此Fe3O4的VB(0.27 eV)和MoS2的VB的光生h+,不能有效地将-OH 氧化成·OH。MoS2的导带(CB)(-0.28 e V)比O2/O2·(-0.13 e V)还原电位更负,因此MoS2的CB(-0.28 e V)的电子能将O2还原成O2·。而Fe3O4的CB(0.17 e V)的电子不能将O2还原成O2·。因此,15%-Fe3O4/MoS2的主要活性物种应是光生h+,而不是—OH 自由基。光降解黄药的机理见图16,光生电子极易从MoS2的表面转移到低价态的Fe3O4的CB,MoS2表面产生的h+也能迁移到Fe3O4的VB上部,h+直接对污染物氧化。

图16 Fe3 O4/MoS2 的光降解机理图Fig.16 Photodegradation mechanism diagram of Fe3 O4/MoS2
4 结 论
利用水热法将Fe3O4负载在MoS2的表面制备Fe3O4/MoS2复合材料。并利用XRD、SEM、TEM、UV-Vis和瞬态光电流等分析测试了光催化剂的微观结构和性能。得到的复合光催化剂在300 W 氙灯照射下,对PBX 的光催化降解效果明显高于MoS2,其中15%-Fe3O4/MoS2复合材料降解率大约是MoS2的1.33倍,在145 min光照后,PBX 降解率达94.11%。15%-Fe3O4/MoS2的超顺磁性使其易于从水溶液中分离和回收。Fe3O4/MoS2复合材料优异的光催化性能可归因于Fe3O4能有效的促进MoS2光生载流子的分离效率。整个实验结果表明,Fe3O4/MoS2复合材料是一种很有前途的光催化剂。

