绿豆皮中黄酮类化合物的抗氧化活性及其结构分析
陈洪生,国 慧,刁静静 ,张东杰,
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319;2.黑龙江八一农垦大学,国家杂粮工程技术研究中心,黑龙江大庆 163319;3.黑龙江八一农垦大学,粮食副产物综合利用教育部工程研究中心,黑龙江大庆 163319)
绿豆(Vigna radiata)是一种药食同源的食用豆,其富含蛋白质、碳水化合物、矿物质和维生素,还含有丰富的多酚、酚酸和黄酮类化合物等活性成分,这些活性成分由于其较强的抗氧化能力而有利于预防癌症、糖尿病、心血管疾病等非传染性慢性病[1−2]。我国在对绿豆进行工业利用过程中会产生大量绿豆皮,这些绿豆皮多被用作动物饲料或者直接废弃物[3]。绿豆皮中含有大量的黄酮类、多酚类化合物,这些功效成分具有抗肿瘤[4]、降低血脂、降胆固醇等生理功能[5]。因此,绿豆皮可以用来制取黄酮类物质,以提高资源利用率。近年来,国内外有关绿豆皮的研究主要集中在功能成分的制取及营养功效评价,朱文学等[6]采用超声波辅助水提取绿豆皮黄酮工艺的研究;Yao等[4]和Peng等[7]的研究发现绿豆中富含多酚,这些酚类物质具有较强的DPPH自由基清除能力。Lee等[8]研究发现绿豆皮提取物黄酮具有抗炎作用。罗磊等[9]研究表明绿豆皮黄酮对氧化损伤人脐静脉内皮细胞具有保护作用。以上这些研究都证实绿豆皮黄酮具有较好的抗氧化、抗炎等生物活性,但绿豆皮黄酮类物质中起主要作用的活性组分的具体组成,目前还不甚清楚。
本试验采用自主研制的连续化制备色谱对绿豆皮黄酮粗提物进行梯度分离,收集不同分级产物分析其抗氧化能力,采用LC-MS分析具有最强抗氧化能力级分的结构,以得出绿豆皮黄酮中最强抗氧化活性的组分结构,以期为绿豆皮的高值化利用提供理论支撑。
1 材料与方法
1.1 材料与仪器
山西明绿豆 大庆萨尔图区博微物资经销处;AB-8大孔吸附树脂 购于天津南开大学树脂有限公司;芦丁、1,1-二苯基-2-三硝基苯肼(1,1-iphenyl-2- picrylhydrazyl,DPPH)、2,2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2′-azinobis-3-ethylbenzothiazoline -6-sulphonic acid,ABTS) 上海Macklin公司;6-羟基-2,5,7,8-四甲基色烷-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox) Sigma公司;乙腈(色谱级)、甲醇(色谱级)、三氯化铁、水杨酸、亚硝酸钠、氧氧化钠、无水乙醇、硝酸铝等试剂安达市清顺化学试剂公司;总抗氧化能力(total antioxidative capability,T-COA)试剂盒 购于南京建成生物工程研究所。
AL-204电子天平 北京瑞泽康科技有限公司;粉碎机 天津市泰斯特仪器有限公司;连续化制备型不锈钢分离柱 实验室自制;UPLC-Triple-TOF/MS系统:AcquityTMultra型高效液相色谱仪 美国Waters 公司;TU1810 型紫外分光光度计 北京普析通用仪器有限公司;CW-200 型超声-微波协同萃取仪 上海新拓分析仪器科技有限公司。
1.2 实验方法
1.2.1 绿豆皮黄酮粗提液的制备 采用康维良等[10]的方法稍作改动,将绿豆皮在40 ℃下恒温干燥,粉碎,过80目筛后密封保存。配制料液比为1:31(g/mL)绿豆皮粉末样品溶液,采用超声-微波协同萃取仪进行绿豆皮黄酮的提取,微波功率为521 W,时间30 min,结束后将提取物进行3500 r/min离心10 min,收集上清液,低温保存备用,得到绿豆皮黄酮粗提液(测得绿豆皮提取物中黄酮含量为2.26%)。
1.2.2 绿豆皮黄酮的分离纯化 采用本实验室自制的连续化制备型不锈钢分离装置,根据课题组前期分离纯化条件对绿豆皮黄酮粗提物进行分离纯化。以1 mL/min流速将绿豆皮黄酮粗提物泵入分离柱中进行饱和吸附,然后分别采用1~1.5倍体积的20%、40%、60%、80%乙醇进行梯度洗脱,收集不同洗脱级分的洗脱液备用。
1.2.3 绿豆皮黄酮抗氧化能力的测定
1.2.3.1 DPPH自由基清除能力的测定 参照陈青青等[11]方法稍作改动,分别取样品0.1 mL样品(浓度2%),加入3.9 mL DPPH(30 μmol/L)溶液,避光30 min,517 nm测吸光度,按式(1)计算DPPH自由基清除率。

式中:A1为静置30 min后样品的吸光度;A2为等体积的乙醇对照的吸光度;A3为待测样品与DPPH等体积乙醇吸光度。
1.2.3.2 ABTS+自由基清除能力 参照陈青青等[11]方法,分别取样品0.1 mL样品(浓度2%),加入5 mL ABTS+·工作液静置10 min,734 nm测吸光度,以0.1 mL乙醇作为对照。ABTS+自由基清除率按式(2)计算;

式中:AS为乙醇对照组吸光度;Am为样品吸光度。
1.2.3.3 羟自由基清除能力 参照封燕等[12]的方法稍作改动,分别取样品0.1 mL样品(浓度2%),依次加入1 mL 6 mmol/L FeSO4溶液、1 mL 6 mmol/L水杨酸-乙醇溶液和1 mL 6 mmol/L H2O2溶液,于37 ℃水浴 30 min,510 nm测吸光度,以0.1 mL蒸馏水代替样品作为对照组。羟自由基清除率按式(3)计算;

式中:Ai为待测样品吸光度;Aj为对照组吸光度;A0为双蒸水代替H2O2溶液作为底物对照的吸光度。
1.2.3.4 T-AOC的测定 采用T-AOC检测试剂盒进行分析。
1.2.4 绿豆皮黄酮类化合物的结构分析 称取10 mg冻干后的样品粉末,加甲醇10 mL溶解,10000 r/min离心15 min,取上清液用于测试。使用0.1%甲酸乙腈为流动相,流速为0.5 mL/min,检测波长280 nm。采用Waters T3色谱柱(50 mm×3.0 mm i.d. ,1.8 μm),进样量5 μL,柱温箱40 ℃。采用UPLC-Triple-TOF/MS系统进行黄酮结构测定,并根据Scifinder和Reaxy数据库检索和推测黄酮类化合物组分。
1.3 数据处理
所得数据均为三次重复的平均值,用Statistix 8(分析软件, St Paul, MN) 进行数据分析,平均数之间显著性差异(P<0.05)通过Turkey HSD进行多重比较分析。并采用SigmaPlot 12.5作图。
2 结果与分析
2.1 绿豆皮黄酮类化合物的分离
图1 反映的是绿豆皮黄酮梯度洗脱样品图。由图1可知,绿豆皮黄酮饱和吸附后,采用不同洗脱溶剂等体积洗脱制备得到的绿豆皮黄酮级分浓度不同,随着洗脱剂乙醇浓度的增强,洗脱样品的颜色也逐渐变深,其中60%洗脱样品颜色最深,表明60%洗脱样品中得到的溶质相对较多,80%醇洗液在连续分离中既可将分离柱中的剩余组分洗脱下来,还可起到清洗分离柱的效果,以保证分离柱的下一轮吸附洗脱。图2反映的是绿豆皮黄酮梯度洗脱四个级分的得率。由图2可知,四种洗脱溶剂得到的黄酮类化合物浓度分别为0.0056、0.021、0.0257、0.0044 mg/mL,与图1结果结合分析得出,绿豆皮黄酮类化合物集中在40%和60%洗脱样品中,达到绿豆皮黄酮粗提物的80%以上;其中60%洗脱样品浓度最高;20%醇洗液由于极性相对较低,洗脱液中含量较低;由于绿豆皮黄酮类化合物集中在40%和60%洗脱样品中,因而80%醇洗液中样品也较低。结合图1和图2也可以看出绿豆皮黄酮类化合物组分集中在40%~60%醇洗液中。

图1 绿豆皮黄酮洗脱样品图Fig.1 Elution sample diagram of flavonoids from mung bean hull

图2 绿豆皮提取物梯度洗脱样品黄酮浓度Fig.2 Concentrations of flavonoid of mung bean hull extract by gradient elution
2.2 不同级分绿豆皮黄酮的抗氧化能力
图3 反映的是梯度洗脱后不同级分绿豆皮黄酮的抗氧化能力。由图可知,等浓度的各个洗脱级分的DPPH·、ABTS+·、·OH清除能力和总抗氧化能力不同,20%、80%洗脱级分的抗氧化能力最低,60%洗脱级分的抗氧化能力显著强于其他洗脱级分(P<0.05),与未分级样品相比,60%洗脱级分的ABTS+·、·OH清除能力和总抗氧化能力显著高于等浓度的黄酮粗提物(P<0.05),但DPPH·清除能力显著低于黄酮粗提物(P<0.05),这说明洗脱样品中的组分与未分级绿豆皮黄酮粗提物存在不同,不同的抗氧化组分其作用效果及机理不同,这与自由基种类也存在一定的相关性,ABTS+·和·OH属于带电荷的自由基,而DPPH·却并不带电荷,所以抗氧化效果不同;40%洗脱级分尽管抗氧化能力强于20%和80%洗脱样品,但显著低于60%洗脱级分(P<0.05),这也表明不同洗脱样品中的组分不同,因此抗氧化能力不同,也表明绿豆皮黄酮中主要抗氧化组分集中在60%洗脱液中。
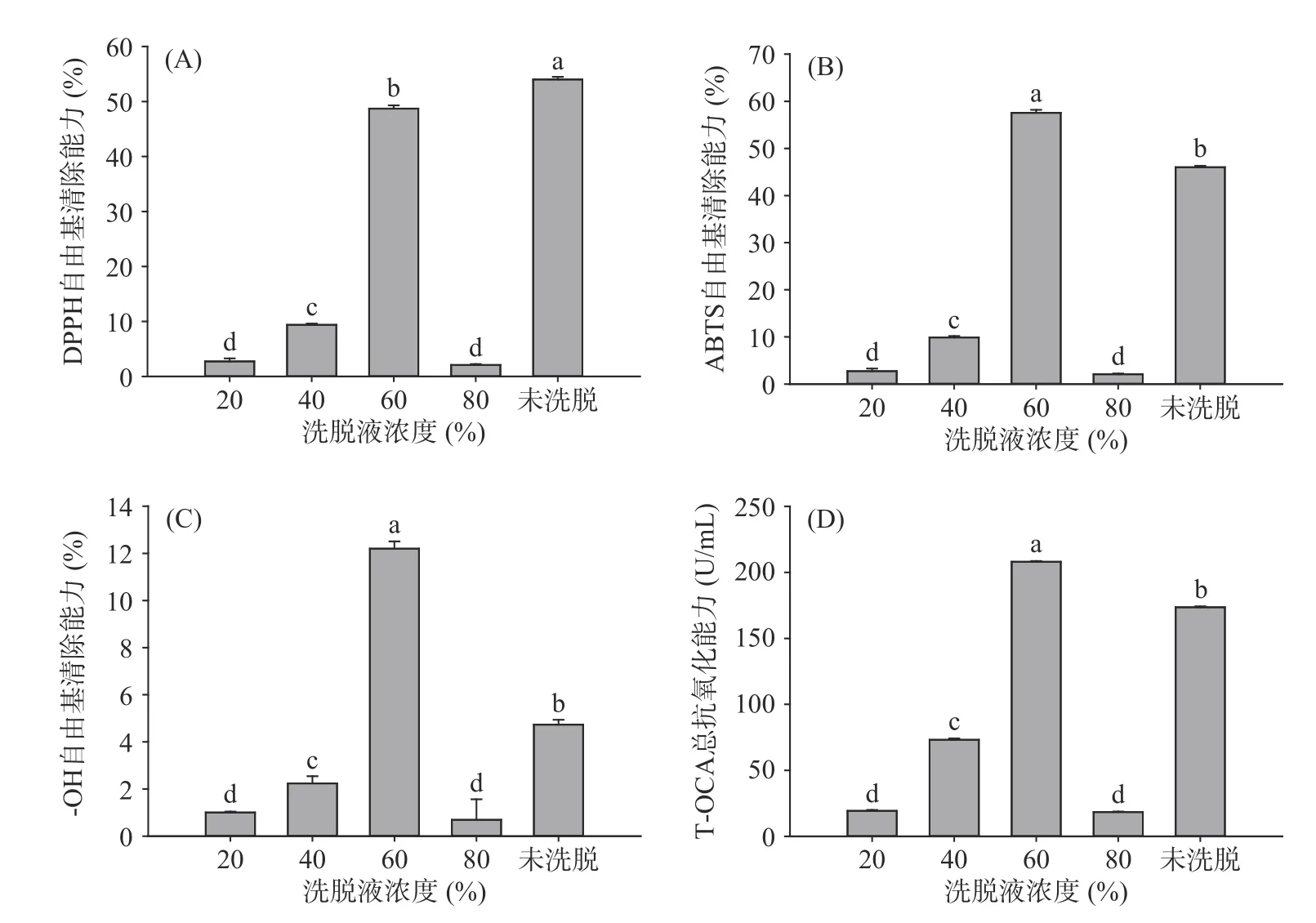
图3 不同级分绿豆皮黄酮的抗氧化能力Fig.3 Antioxidant activity of mung bean hull flavonoid from different fractions
2.3 60%醇洗脱绿豆皮黄酮类化合物结构分析
图4 反映的是60%醇洗样品的液相色谱图,由图可知,纯化后绿豆皮黄酮样品中的吸收峰主要有3个,分别出现在4.59、6.06和6.20 min,说明60%醇洗脱液中绿豆皮黄酮类化合物主要含有3种物质。

图4 60%乙醇洗脱液中黄酮类化合物的液相分析图谱Fig.4 HPLC chromatograms of mung bean hull flavonoids in 60% ethanol elution liquid
2.3.1 成分Ⅰ分析 图5是成分I的一级二级质谱图和可能的结构式。该化合物的出峰时间为4.59 min,[M-H]−为449.1107,根据高分辨质谱结果拟合的分子式为C21H22O11,根据二级质谱[M-90-H]、[M-120-H]等碎片离子,该化合物为碳苷,且含有六元糖,根据cifinder和reaxy数据库检索,推测该化合物为圣草酚-6-C-β-D-吡喃葡萄糖苷(eriodictyol-6-C-β-D-glucopyranoside)。

图5 成分Ⅰ的一级(A)、二级(B)质谱及可能的结构式(C)Fig.5 Ingredients I primary(A), secondary(B) mass spectrogram and possible structural formula(C)
2.3.2 成分Ⅱ分析 图6是成分II的一级二级质谱图和可能的结构式。该化合物的出峰时间为6.06 min,[M-H]−为431.0992,根据高分辨质谱结果拟合的分子式为C21H20O10,根据二级质谱[M-90-H]、[M-120-H]等碎片离子,该化合物的为碳苷,且含有六元糖,根据Scifinder和Reaxy数据库检索,根据保留时间分析,推测该化合物为牡荆素(vitexin)。

图6 成分Ⅱ的一级(A)、二级(B)质谱及可能的结构式(C)Fig.6 Ingredients II primary(A) , secondary(B) mass spectrogram and possible structural formula(C)
2.3.3 成分Ⅲ分析 图7是成分III的一级二级质谱图和可能的结构式。该化合物的出峰时间为6.20 min,[M-H]−为431.1007,根据高分辨质谱结果拟合的分子式为C21H20O10,根据二级质谱[M-90-H]、[M-120-H]等碎片离子,该化合物的为碳苷,且含有六元糖,根据Scifinder和Reaxy数据库检索,推测该化合物为异牡荆素(isovitexin)。

图7 成分Ⅲ的一级(A)、二级(B)质谱及可能的结构式(C)Fig.7 Ingredients III primary(A), secondary(B), mass spectrogram and possible structural formula(C)
3 讨论与结论
本研究结果表明,绿豆皮较强的抗氧化活性与其富含黄酮类化合物有关。罗磊等[9]和Kanatt等[13]的研究表明,绿豆皮比仁核具有较强的抗氧化性,这是由于皮壳中含有较高的黄酮类化合物。Li等[14]的研究发现荞麦皮壳中含有较高的黄酮类化合物,其主要黄酮类物质是牡荆素和异牡荆素,这两种组分被认为是最主要的抗氧化剂。有研究表明绿豆具有清热解毒作用是由于其活性部位提高了机体对氧自由基的清除能力,减轻了过量的氧自由基引起的机体损伤[15−17]。本研究通过连续制备色谱分离纯化得出的抗氧化活性组分经鉴定推测出其主要含有牡荆素、异牡荆素和圣草酚-6-C-β-D-吡喃葡萄糖苷。牡荆素和异牡荆素具有较高的抗氧化能力已被很多研究所证实,牡荆素能保护DNA氧化损伤,使细胞免受·OH诱导的氧化损伤,降低CSHFD小鼠肝脏脂肪沉积,减轻脂质代谢,抑制肝脏炎症反应。此外,牡荆素可显著降低肝巨噬细胞浸润,明显下调肝SREBP-1c、FAS、ACC mRNA和蛋白表达[18−19]。异牡荆素可通过抑制机体的氧化反应改善顺铂诱导的肾损伤[20]。黄酮类化合物的B环是其清除自由基的主要活性部位,当该环存在邻酚羟基结构时,抗氧化活性增强。潘国庆等[21]的研究表明,B环上有邻位羟基,自由基清除能力会显著增强,如槲皮素比山萘素的B环上多了一个邻位羟基,其活力显著增强。胡栋宝等[22]的研究发现,黄酮类化合物的B环上含有邻位羟基容易形成分子内氢键,这有利于分散苯氧自由基上的单电子,此种结构具有较高的抗氧化活性[23]。本研究推测的另外一种成分圣草酚-6-C-β-D-吡喃葡萄糖苷的B环上有一个邻位羟基,由此,除了牡荆素和异牡荆素这两种抗氧化组分外,这可能是60%洗脱样品中绿豆皮黄酮具有较强抗氧化能力的另外一个原因。本文对绿豆加工副产物中绿豆皮的黄酮类化合物进行了提取及分离纯化,鉴定出绿豆皮黄酮中具有较强抗氧化能力的3个组分结构,这为绿豆加工副产物资源的利用提供了理论依据。

