m6A修饰及其生殖调控功能研究进展
郭韶珂,裴 杰,王兴东,吴晓云,郭 宪
(中国农业科学院兰州畜牧与兽药研究所,甘肃省牦牛繁育工程重点实验室,甘肃兰州 730050)
RNA将遗传信息从DNA传递到蛋白质,维持生命活动的正常运转。RNA修饰是RNA调控生物系统、维持RNA稳定的主要方式,和DNA修饰在表观遗传学中发挥的多种作用类似,RNA上的可逆化学修饰已作为普遍现象出现,可能会开启“RNA表观遗传学”的新篇章。目前在mRNA和非编码RNA中已经发现了100多种不同的RNA修饰,其中1974年发现的N6-甲基腺苷(N6-methyladenosine,mA)甲基化是最普遍的RNA内部修饰。mA修饰在生物体的各个组织中都被发现,这种修饰通过控制RNA代谢、剪接、降解和翻译来调控基因表达和实现相应的生物学功能。近年来,有研究报道mA修饰在细胞分化、动物发育、动物生殖和疾病发生中起到重要调控作用。mA甲基化相关酶表达异常也会影响mA的修饰水平,进而影响生物体的生殖和分化功能,提示mA修饰可能是生殖类疾病调控的新靶点,然而其作用机制还未阐明。本文从mA修饰特点、mA甲基化酶及其在动物配子发生和胚胎发育等生殖方面的调控作用进行分析和总结,旨在为mA修饰在家畜生殖和育种上的研究与应用提供思路和理论依据。
1 m6A修饰的定位
mA修饰是指在mRNA中腺苷酸(A)的第六位氮原子处发生甲基化,在人和小鼠中有1/3~1/2的mRNA存在mA修饰。哺乳动物mRNA中分离的mA占所有腺苷核苷酸的0.1%~0.4%,平均每2 000个核苷酸上就存在1个mA修饰峰(mA peak),每条mRNA上含有3~5个mA peak。在研究初期有人推测mA可能来自rRNA和snRNA的污染,并认为特定mA位点的突变不会影响mRNA的丰度和加工。虽然mA的化学性质稳定,但mRNA在细胞内的丰度较低,并且对检测它的化学处理不敏感,在所检测的细胞mRNA中很少检测到mA。直到2012年,Dominissini等和Meyer等将免疫沉淀技术与下一代高通量测序(mA-Seq或 MeRIP-Seq)结合起来,这种方法可以对mA修饰进行分辨率为200 nt的全基因组定位,并首次在人和小鼠组织中7 000多个基因的转录本中检测到12 000多个mApeak。mA修饰在约25%的转录本中是非随机分布的,研究发现mA在终止密码子附近、3′非翻译区(3′-UTR)和较长内部外显子中富集,并更多地出现在前体mRNA中,优先嵌入由5′-RRACU-3′(R=A或G;H=A、C或U)组成的共有序列基序中。随后,2015年,研究发现通过miCLIP和mA-CLIP技术可以将mA修饰位点精确到近单碱基分辨率的测定,但由于实验方法涉及同位素标记成本过高,目前实验室仍普遍采用MeRIP-Seq技术进行mA检测。
2 m6A甲基化酶
2010年,He首次提出在基因表达调控中可逆的RNA修饰问题。Jia等的研究进一步证实了mA修饰的动态可逆性。mA修饰的调控功能需要甲基化转移酶(Writer)、去甲基化酶(Eraser)和甲基化阅读蛋白(Reader)3种酶协同发挥作用。甲基化转移酶的作用是使mRNA上的腺苷酸发生甲基化修饰,而发生甲基化修饰的碱基可以在去甲基化酶的作用下将甲基移除,甲基化阅读蛋白的功能是识别这些发生甲基化修饰的甲基位点,不同的阅读蛋白发挥的调控功能也不相同。
2.1 甲基化转移酶 甲基转移酶复合体是催化mA修饰的重要物质,其关键成分主要包括甲基转移酶3(METTL3)、甲基转移酶14(METTL14)和Wilms肿瘤1相关蛋白(WTAP)。METTL3在各个组织中都有表达,在睾丸中的表达尤其丰富。METTL14是METTL3的高度同源物,METTL3和METTL14之间会形成一个化学计量比为1:1的稳定异二聚体,前者作为催化亚基,后者提供RNA结合支架,并且这个复合物的甲基化活性要高于这两个酶单独的甲基化活性。WTAP是一种与Wilms肿瘤1(WT1)蛋白结合的剪切因子,它在体外不显示mA修饰的催化活性,但WTAP在核小点中与METTL3-METTL14相互作用,共同参与mA RNA甲基化过程。Sorci等研究显示,METTL3蛋白的敲低和过度表达均导致WTAP蛋白上调。KIAA1429也称为vir样mA甲基转移酶相关蛋白VIRMA,是mA甲基转移酶复合物的新鉴定成分,在指导区域选择性mA沉积中起关键作用。有研究表明,甲基转移酶可以通过调节RNA半衰期和选择性剪切来影响机体的组织或干细胞的分化异常,也可通过调节mRNA翻译和基因表达发挥致癌作用。
2.2 去甲基化酶 Jia等首次在小鼠中发现去甲基化酶脂肪质量和肥胖相关蛋白(FTO),FTO的发现证明了mA修饰是通过可逆调节来影响mRNA的功能。FTO在控制食物摄入的下丘脑部位表达量最高。基因表达下调提高mRNA中mA的水平,而基因上调表达抑制mA甲基化,这一现象揭示FTO具有去甲基化活性。随后被发现的另一个去甲基化酶是同为ALKB家族成员的-酮戊二酸依赖的双加氧酶ALB同系物5(ALKBH5),ALKBH5主要通过其去甲基化活性影响mRNA的输出和加工。ALKBH5在大多数组织中都有表达,在小鼠睾丸中的表达量最高,基因敲除的雄性小鼠表现出精子发生异常。到目前为止,仅有FTO和ALKBH5两个mA去甲基化酶被发现,由于它们在组织分布和RNA靶点的种类上存在差异,它们在RNA代谢中发挥的生物学作用也不尽相同。此外,FTO不仅与肥胖的发生和发展密切相关,也与其他代谢性疾病和癌症的发生有关,ALKBH5在癌症发病和抑制的机理中起到关键作用。
2.3 甲基化阅读蛋白 使mA甲基化发挥生物学作用的是特定的阅读蛋白。YT521-B Homology(YTH)结构域家族在真核生物中普遍存在,具有YTH结构域的蛋白质可识别mA标记,并且发挥RNA剪接、mRNA衰减、翻译的分子功能。在人类基因组中发现了5个YTH家族的阅读蛋白,根据一级序列和结构特征分为3类:YTHDC1(DC1家族)、YTHDC2(DC2家族)和YTHDF1-3(DF家族)。YTH蛋白在细胞内有不同的分布,其中YTHDF家族蛋白和YTHDC2蛋白广泛分布于细胞质中,而YTHDC1蛋白主要分布于细胞核中。YTHDF1能特异性识别和结合3′-UTR区中的mA,并直接与启动因子相互作用以促进翻译。YTHDF2的羧基末端结构域选择性地结合特定区域发生mA甲基化的mRNA,促进mRNA的衰退与降解。YTHDF3同样也可以促进翻译,它通过与YTHDF1的协同作用促进甲基化mRNA的翻译和蛋白质合成。研究发现YTHDF3敲除会降低YTHDF1和YTHDF2的RNA结合特异性。YTHDC1是唯一发现的细胞核内mA阅读蛋白,它在核mRNA加工和核定位中发挥作用。YTHDC2与减数分裂特异的包含卷曲结构域的蛋白(MEIOC)形成复合物,通过其YTH结构域识别mA来调节RNA水平。除了含有YTH结构域的蛋白外,有报道称真核细胞启动因子3(eIF3)也为mA阅读蛋白。5′-UTR中包含mA的mRNA可以直接结合eIF3,可以在没有帽结合因子eIF4E的情况下募集43S复合体以启动mRNA的翻译。
3 m6A修饰调控动物生殖过程
3.1 影响干细胞增殖和分化 在哺乳动物中,精原干细胞(Spermatogonial Stem Cell,SSC)会进行无限制的自我更新和分化以生成精原细胞,维持雄性的整个生命周期中都能持续产生精子。SSCs自我更新和分化之间的平衡受到外部环境刺激和特定内在基因表达的调节。研究发现,SSCs的大多数关键调控因子都具有广泛的mA甲基化修饰。小鼠生殖细胞中METTL3或METTL14通过控制SSCs增殖和分化的关键调控因子的转录本来维持SSCs稳态,其特异性失活会引起mA缺失,导致SSCs过度增殖,从而使SSCs库耗竭。
在动物的胚胎干细胞(Embryonic Stem Cell,ESC)中也发现了mA甲基化修饰在维持自我更新和分化过程中发挥作用。在mESC中,mA的靶标包括ESC核心多能性网络和分化过程中具有动态控制丰度的转录本。Batista等在人和小鼠ESCs中鉴定出的位置和序列特征表明,mA沉积的机制与体细胞中的机制相似,与未修饰的转录本相比,发生mA修饰的转录本具有RNA半衰期缩短、mRNA衰减速率增加、翻译效率降低的特点。Wang等报道小鼠胚胎干细胞中敲除后会表现出丧失自我更新能力的表型特征。然而,Batista等研究表明,缺失不会影响ESCs的生存能力或自我更新,只是ESCs的更新速度有所提高。这两项研究中观察到的表型差异可能是由于不同细胞类型对mA修饰的RNA依赖性不同,急性与慢性失活或RNAi脱靶的作用所致。缺失的ESCs增强了自我更新能力,但mA不足会影响ESCs在体外和体内从自我更新到分化成特定谱系的过程,导致ESCs分化受阻,这是通过限制许多ESC基因(包括多能性调节剂)的水平实现的。
3.2 调控精子减数分裂和精子发生 精子生成是一个复杂的过程,涉及动态的精原细胞分化、减数分裂和精细胞分化过程。近年来,去甲基化酶和甲基转移酶催化的mA修饰已被证实在动物精子的发育过程中起重要作用。METTL3在睾丸发育期间在生殖细胞和体细胞中均表达,但在未分化精原细胞中的表达相对较高。缺失会影响与精子发生相关基因的表达模式,使精母细胞无法达到减数分裂前期的粗线期,严重阻断了精原细胞分化和最初的减数分裂正常进行。METTL3介导的mA修饰通过基因的选择性剪接在精子发生中起重要调节作用,如选择性剪接因子Bcas2在减数分裂的转化过程中起作用。与这些结果不同的是,Lin等研究发现或单独缺失的小鼠表现出正常的减数分裂和精子发生,但和联合缺失的个体表现出精子分化受损,这是由于精子发生关键因子翻译失调所致。这表明,METTL3和METTL14在精子发生晚期中可能具有不同或部分重叠的功能,而mA调控RNA翻译可能是控制精子发生后期的机制。
mA去甲基酶的缺失也会导致精子发生受损。ALKBH5的整体失活除导致雄性小鼠不育外,均不会导致明显的发育缺陷或成年疾病,这表明ALKBH5只在精子形成过程中起至关重要的作用。ALKBH5从前体mRNA正确擦除mA对于在睾丸中的粗线精细胞和圆形精子细胞的细胞核中正确剪接和产生较长的3′-UTR mRNA是必不可少的,否则,将导致异常剪接。mA去甲基化酶和甲基转移酶在精子从形成到发生过程中的重要作用还表明,mA修饰的总体平衡是在精子发生过程中维持分化程序的关键,可逆的mA修饰是减数分裂和单倍体生精细胞中控制mRNA转录后命运的关键机制。
作为甲基化阅读蛋白的YTHDC2同样在从有丝分裂性精原细胞的基因表达程序成功过渡到减数分裂精子细胞中起着至关重要的作用。在雄性小鼠睾丸中的缺失改变精原细胞有丝分裂和减数分裂中相关基因的表达,导致其无法正确进行减数分裂。YTHDC2降低mRNA的丰度可能通过募集衰变机制,以在哺乳动物细胞翻译期间或之后加速mRNA靶标的降解。上述研究表明,YTHDC2在调节mA修饰的转录本水平,以维持有利于减数分裂进展的基因表达程序中的作用,不过由YTHDC2组装的mA指导的转录后调控复合物的详细作用机理还需要进一步的研究。
3.3 调控卵子发生 卵子发生的过程分为生长、成熟和排卵3个阶段。有研究发现,mA修饰主要发生在生殖细胞中,而不是卵巢体细胞中,并且mA水平随着减数分裂的启动而显著增加。在非洲爪蟾的生发泡期(GV期)或减数分裂中期II期,卵母细胞中的mRNA发生广泛的mA修饰,这些mRNA主要参与转录、蛋白质磷酸化和细胞分裂等生物学过程,而mA甲基化可能通过抑制mRNA翻译来影响减数分裂进行。斑马鱼中的缺失导致胆固醇转运和类固醇生成途径中关键酶的mRNA水平显著降低,损害卵母细胞减数分裂过程。这很可能是mA水平降低导致性激素合成和促性腺激素信号转导重要基因表达受阻的结果,可通过体内和体外激素来挽救。最新研究发现,KIAA1429介导的RNA代谢在小鼠卵泡形成和卵母细胞能力维持中起关键作用,其缺失导致卵泡发育不良,完全长大的生发泡卵母细胞无法经历生发泡破裂(GVBD),因此丧失恢复减数分裂的能力。这主要是改变了卵泡发育必需的卵母细胞衍生因子的表达模式所致,影响了与卵子发生有关的基因的选择性剪接。
甲基化阅读蛋白也是哺乳动物卵母细胞能力的内在决定因素。研究发现,3种mA阅读蛋白YTHDF2、YTHDC1和YTHDC2在调节雌性动物生殖方面的功能略有不同。YTHDF2主要维持女性的生育力和卵母细胞生长能力,YTHDC1是卵母细胞生长和成熟所必需的,YTHDC2是卵母细胞减数分裂进程所必需的。YTHDF2可能以mA依赖性的方式调节卵母细胞减数分裂成熟过程中的mRNA降解,YTHDF2缺失不会严重影响卵母细胞的生长或母体转录的发生,只会导致在卵母细胞成熟期间基因mRNA表达量的异常。YTHDC1在卵母细胞核中的前mRNA转录物的加工中起关键作用,可以调节含mA的mRNA的核输出和选择性剪接。除了剪接缺陷外,YTHDC1缺失还会引起卵母细胞中广泛的替代性聚腺苷酸化,影响多腺苷酸化位点的选择和3′-UTR长度。Wojtas等研究表明YTHDC2缺失卵巢的RNA-seq分析显示转录组调控异常,这可能导致雌性生殖细胞无法成功执行减数分裂程序,从而导致不孕。Zeng等在雌性生殖细胞中发现的YTHDC2表达模式与其他人报道的两性减数分裂生殖细胞中的表达模式相似,这表明YTHDC2在介导不同性别之间的生育力和配子发生方面具有潜在的保守功能。
3.4 影响早期胚胎发育 mA修饰可能通过调节mRNA的衰变影响细胞周期进而影响早期胚胎发育过程。有研究发现在小鼠胚胎中敲除后会导致神经中放射状胶质细胞周期进程中断,最终导致脑皮层厚度减小,甚至会出现出生后死亡的现象。而小鼠中的METTL3灭活或果蝇中的IME4(METTL3的同系物)灭活也会发生一定的胚胎致死率,这证明mA在谱系分化中起着至关重要的作用。Zhao等发现mA修饰会影响斑马鱼早期胚胎中的靶标mRNA的稳定性和随后的蛋白质合成。斑马鱼胚胎中的的敲除减缓了阻碍了合子基因组的激活,使其在细胞周期的G2晚期或M早期处于阻滞状态,并在整个幼虫寿命中保持发育延迟。另一项研究报道了METTL3在着床前胚胎发育中发挥重要作用,METTL3介导的mA可能通过阻止mRNA降解来影响母体到合子的转换和合子基因组的激活。
3.5 控制性别决定 mA修饰还与动物的性别决定有关。Haussmann等研究发现,mA在果蝇性别决定和剂量补偿中起作用,IME4失活的果蝇尽管仍能存活并飞行,但表现出偏向雄性的性别发育。果蝇性别决定性的关键调节因子是RNA结合蛋白SXL,它在雌性中特异性表达。果蝇控制性别分化通常采用剂量补偿机制,即上游的X:A的性染色体和常染色体比例决定下游的是否会被激活。Lence等研究发现雄性果蝇基本不受IME4的影响,而雌性果蝇中的缺失在基因型上表现出与雄性果蝇共有的外显子插入以及雌雄果蝇独有的剪切模式。这些结果表明,IME4破坏了果蝇体内正常的剂量补偿效应,并通过调控影响雌雄果蝇的存活。此外,该研究还发现YT521-B(YTHDC1的同源物)是调节性别决定因子SXL的主要mA效应因子,YT521-B过表达可诱导雌性的特异性SXL剪接,该发现在其他研究中也得到证实。mA介导的基因表达调节可能是自然界发现的多种性别决定机制的关键步骤,目前只是在果蝇中被发现,这可能跟果蝇特殊的性别分化机制有关。在其他动物中的调控机制需进一步探究。
3.6 mA与人类生殖疾病相关 弱精子症(Asthenozoos permia,AS)是男性不育的常见原因,实验表明,与健康对照组相比AS患者精浆中的mA水平显著增加,精子中METTL3可能调节某些与精子运动相关的基因的稳定mRNA表达。mA不仅与某些代谢物水平减少相关,似乎与精子数量、运动性和曲线速度也显著相关。与这个结果相似的是,通过分析特发性无精症(Idiopathic Azoospermia,IA)患者的GEO数据库发现,YTHDF3的过表达可能在精子发生障碍的机制中起重要作用。
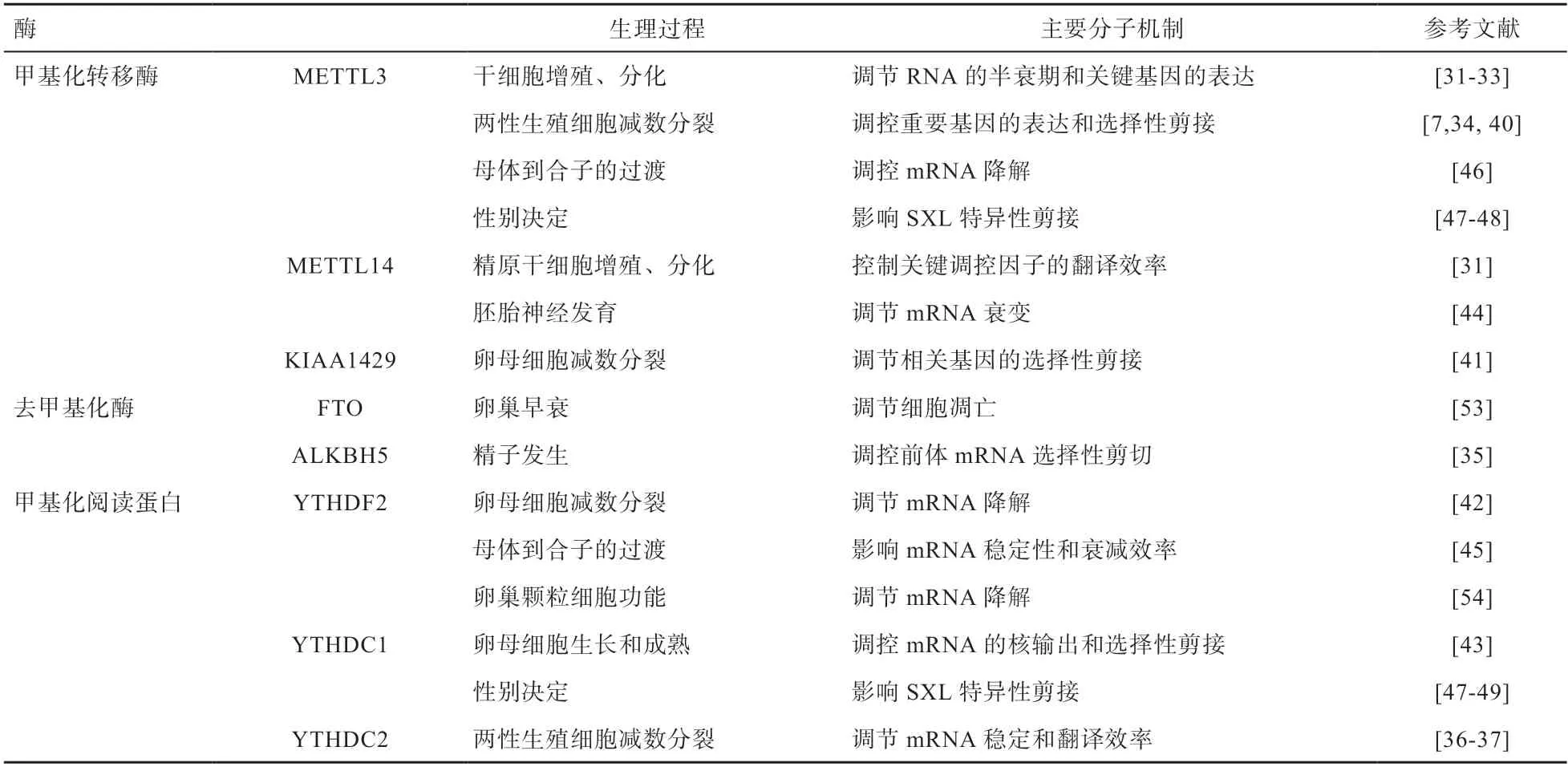
表1 m6A甲基化修饰调控生殖发育过程的主要机制
卵巢早衰(Premature Ovarian Insufficiency,POI)是一种早期卵巢功能障碍,Ding等发现mA含量与POI风险高度相关,FTO调控的细胞凋亡会损害卵巢颗粒细胞功能并进一步引起卵巢癌。多囊卵巢综合征(Polycystic Ovary Syndrome,PCOS)是一种常见的内分泌失调,Zhang等研究发现mA修饰引起卵巢过度刺激后PCOS患者黄素化颗粒细胞(GC)中与细胞凋亡相关基因上调,这可能与YTHDF2调节mRNA降解有关。上述这些结果暗示mA水平可能是导致人类不育的潜在生物标志物。
4 小 结
mA修饰作为表观遗传修饰的一种,以其广泛的存在影响着生物各个组织的生长发育。在mRNA中,mA修饰可以通过不同的机制影响蛋白质的结构与功能。目前研究发现,甲基转移酶主要通过单独的或两者协同作用调控两性生殖和胚胎发育;去甲基化酶FTO主要调控卵母细胞成熟和卵巢发育,而ALKBH5主要调控精子发生和发育;阅读蛋白YTHDC1、YTHDC2、YTHDF2主要在雌性生殖中起调节作用。这表明mA可能是通过不同的调控机制在动物配子发生过程中发挥不同作用。总的来说,mA调控两性生殖以及早期胚胎发育主要是通过控制基因表达、选择性剪接、mRNA降解和翻译效率来实现的。
目前,仍存在以下问题需要研究人员去探究:1)mA甲基化是否和其他修饰联合调控动物生殖系统发育;2)除了人和小鼠等模式动物,在其他家畜的生殖发育中mA修饰的功能以及作用机制是否相似?3)目前在动物生殖学方面的研究主要集中在mA甲基化产生的影响,其在生殖生育中的确切作用和潜在分子机制的全面系统研究尚不完善。通过检测或调节甲基化作用酶的水平,有望成为诊断和治疗某些生殖方面疾病的新突破口。未来对mA修饰在动物生殖上的深入研究不仅可以促进对表观遗传调控的理解,而且对人类生殖疾病的发生与治疗以及在家畜繁殖育种中的应用有着积极作用。