植物内部磷循环利用提高磷效率的研究进展
孙 艳,洪婉婷,韩 阳,徐梓楷,程凌云
(中国农业大学资源与环境学院/植物与土壤相互作用教育部重点实验室,北京 100193)
磷不仅是核酸、磷脂、ATP的重要组成成分,还是能量传递、蛋白质活化等过程中的关键代谢调节因子[1]。农业生产上,磷对作物产量的提高及作物优良品质的维持方面具有重要作用。土壤中的磷素主要以无机磷(Pi)的形式被植物吸收利用,但由于土壤中Pi极易与有机、无机化合物结合或存在于微溶矿物中使其移动性差、扩散速率低,从而大大降低了磷的生物有效性[2–3]。据报道,在全球范围内约有70%的土壤受低磷胁迫的影响,使磷素成为限制植物生长发育的重要因子[4–5]。为了满足人口不断增长对粮食产量的高需求,磷肥的施用量呈现逐年增加的趋势,目前全球对磷肥的需要量达到了约5亿t,且预计从现阶段到2030年,磷肥的施用量年均增长2亿t左右[4,6–8]。White等研究表明,磷肥的当季利用率仅为的15%~30%[9],其余绝大部分则被土壤固定为缓效态或无效态磷[10]。磷的需求日益增加,如果以过去3年间磷矿石供给速度估计剩余年数,到2040年所有磷矿石供给都将耗尽[11]。因此,提高植物对磷素高效吸收与利用的能力显得尤为重要。植物为应对低磷胁迫已经进化出一系列与生长发育或生理生化相关的机制以提高低磷浓度下养分的有效性。在低磷供应下,植物可通过改善根系构型和分泌有机酸和磷酸酶活化周围土壤难溶性磷及有机磷以增强其对磷的吸收,也可对贮存在植物体内的磷营养进行再活化、再转运和再利用等以实现磷的高效利用[12]。
因此,许多科研工作者致力于研究根系从土壤中获取磷的能力(即磷获取效率,PAE)和植物对磷利用的能力(磷利用效率,PUE),以改善植物营养和保证粮食产量[13–14]。然而仅仅通过提高PAE来促使作物增产会加速农田土壤总磷的耗竭,导致其它负面环境问题[13,15],这一措施不能满足农业生产的可持续发展。相比之下,通过提高植物磷利用效率,以较低的投入获得更高的产量,应该引起我们的关注[13]。
本文将综述植物在应对磷胁迫时对其体内磷素的再活化利用及与磷转运相关的生物学机制,以期进一步提高农业生产中磷利用效率并为培育耐低磷胁迫的磷高效优质作物品种、降低磷肥投入、减轻环境污染等提供必要的生物学理论和技术改良基础。
1 植物生长发育过程中磷的再活化分配
磷被吸收进入植物体内后,全磷中约15%的磷以游离无机磷(Pi)的形式存在,约有85% (全磷含量中占比)的磷转化为有机磷酸酯,形成核酸、磷脂、低分子量的磷酸酯和磷酸化蛋白等有机磷库,且其含量大小顺序为核糖核酸(RNA)>磷脂>磷酸酯>脱氧核糖核酸 (DNA)[13,16–18]。
一般情况下,植物组织中Pi浓度能反映该植物体的外部Pi供应水平[13,19]。组织内的Pi存在于细胞质和液泡中。其中细胞质Pi库代谢活跃,含量约为P 0.1~0.8 mg/g(干重),占细胞内总 Pi的 15%,且保持在相当窄的范围内变动。而液泡Pi含量显著高于细胞质Pi含量,可占细胞内Pi的80%,随环境磷变化波动较大[20–23]。
1.1 磷素营养在植物不同生育期的再分配利用
在植物营养生长阶段早期,磷在光合作用及相关碳氮代谢方面发挥着重要作用,此时高效吸收利用磷素有利于植物相对生长速率的提高[13,24]。施磷可加速作物营养生长,促进植株体内光合产物的分配[25–26],从而进一步影响植株叶面积、根系吸收养分和水分的速率及根系碳周转[27–28]。
在植物营养生长阶段后期或当其遭受低磷胁迫时,部分叶片发生衰老,此时衰老叶片会产生较大的呼吸成本,加上植株自身生长壮大后对光照的遮荫,最终减少了光合产物的产量[13]。与此同时老叶中含磷生物大分子(核酸、磷脂等)会有序分解释放磷并从老叶迁移到其它器官,在组织死亡之前,磷被活化并重新运输到生长旺盛的库组织(尤其是发育中的种子和正在伸展生长的新叶)中,从而显著提高老叶养分回收利用率[29–30]。植物磷供应从由根系吸收为主转变为以回收衰老组织中迁移的磷为主的过程,发生在营养生长后期或生殖生长早期阶段,这一转变可能对整株植物的健康生长至关重要,且当植物处于土壤养分缺乏的环境中时显得尤为关键[13,30]。衰老组织中有机、无机磷的回收利用不仅有利于提高植物磷利用效率,同时可以防止老叶中的磷营养流失到周围环境中而造成损失。研究发现,山龙眼科植物(Hakea prostrata)较耐磷匮乏环境,其叶片对核酸、磷脂等的需求也随土壤磷含量的下降而降低,并且成熟叶片中约80%的有机磷可被再活化利用[31–33]。而大豆(Glycine max)老叶有机磷的再活化程度相对较低,磷回收率不到50%[34]。在拟南芥研究中,高达78.4%的有机、无机磷会从老叶中转移出被再利用[35]。因此,从营养生长阶段的中后期开始,植物组织中磷从衰老器官转移到生长更活跃的器官成为植物继根系吸收之外磷来源的又一重要途径,尤其在缺磷土壤中磷的再分配显得尤其重要[13,17]。
当植物进入生殖生长期,衰老叶片中磷营养的回收利用成为幼叶、生殖器官和贮藏器官中磷的主要来源之一[17]。Masoni等[36]研究表明,小麦(Triticum durumL.)叶片和秸秆中磷含量会随着其由开花期到成熟期的过渡而降低,而穗中磷含量增加到初始值的4倍。另有研究发现,油料作物胡麻在盛花至完熟期阶段的磷素积累量最大,且籽粒中约有35.14%~55.24%的磷素是由叶片中的有机磷再活化转运而来的[37]。Jeong等[38]研究表明,叶片在衰老过程中发生的磷转移损失可能不仅影响其进行光合作用,还作用于籽粒灌浆过程中同化物有效性。对于水稻(Oryza sativaL.)而言,磷主要在籽粒灌浆后期从叶片迁移到籽粒中,这一过程与叶片衰老密切相关[39-41]。类似地,在大豆(Glycine max)的灌浆期增加磷营养供给会延迟叶片衰老的同时收获更高的籽粒产量[42]。然而,在甘蓝型油菜(Brassica napus)的籽粒灌浆期间增施磷素会降低生物量并减少籽粒产量[43]。Mazlouzi等[44]研究发现,低磷营养下生长的小麦(Triticum durumL.)籽粒中有81%的磷来源于体内磷的再活化利用,而在高磷条件下这部分磷仅占籽粒磷的65%;缺磷胁迫下的小穗和叶片对磷再活化的贡献相对较大,占比分别为43.6%和34.6%,但高磷营养下贡献相对较大的器官分别为叶片(32%)和茎(30.4%)。
1.2 籽粒中过量磷的输入
整体而言,籽粒中磷含量过高会在降低作物品质的同时破坏农业生产过程中的磷素平衡。一方面,磷被转移到正在发育的种子中以满足其进行正常细胞生理生化功能的需要,且内部储存的磷可为幼苗的生长发育提供营养,人们普遍认为种子磷储量越高越有利于幼苗生长[45]。然而籽粒中大量磷素存在会导致过多植酸的形成,其在缺乏植酸酶的动物体内难以被吸收利用,同时会造成多重抗营养效应,使铁、钙、锌和镁等微量营养元素有效性降低[46–48]。这部分未被动物消化吸收的植酸磷排出体外后污染水土资源,导致水体富营养化与土壤中有机磷富集,不利于植物根系直接吸收土壤中的磷营养[49–51]。另一方面,大约60%~85%的地上部磷储存在籽粒中,这就意味着在作物收获的同时会从田间带走大部分磷素[40]。农业生产中会进行过量施磷以弥补土壤磷素的损失,但这种做法通常会增加富磷土壤被侵蚀后使水体富营养化的风险[40]。由此可见,这种不合理方式循环往复,农田土壤中磷素平衡势必会受到极大破坏。因此,为实现可持续农业生产,将籽粒磷浓度降低到满足磷素需求的水平是重要途径。通过培育并种植籽粒含磷低的品种或解析调控籽粒含磷低的关键基因,或许能够在一定程度上减少磷素在作物生长后期向籽粒的输入,这也将成为降低籽粒中磷浓度的潜在措施。
2 磷在植物体内的储存与再利用
2.1 液泡Pi的再利用与细胞内磷稳态
植物获取的Pi首先在细胞质中积累直至达到稳定水平,然后在液泡中累积。液泡被认为是最大的与磷储存和再活化相关的细胞器,且液泡中磷酸盐含量约占细胞内总磷酸盐的75%[21,52]。研究发现Pi在总磷含量中的占比相对于有机磷的占比变化较大,这与Pi的有效性密切相关[13]。当外界磷供应充足时,由于细胞质中代谢活跃的Pi水平受到严格控制,多余的Pi将储存在液泡中。短期内缺磷时,液泡Pi外流到胞质以满足细胞质Pi需求,从而缓解细胞缺磷状况[52–54]。可见,液泡输出的Pi可能是植物细胞中Pi的缓冲器。液泡Pi的储存和输出能够维持细胞内Pi的稳态(图1),同时满足外部Pi有效性的变化及植物体的代谢需求[52]。研究表明无论植物体内Pi状态如何,细胞质的Pi水平都始终维持在一个恒定值[55]。当外部供应不同水平的磷浓度时,豌豆(Pisum sativumL.)根尖液泡Pi的变化显著,但根尖细胞质Pi的浓度稳定保持在18 mmol/L[56]。当大豆(Glycine maxL.)处于较高水平磷营养下,自开花期到鼓粒中期生长的过程中,液泡磷酸峰最先消失,表明液泡磷酸盐的再活化程度较细胞质大。在低磷营养处理下,液泡对细胞质Pi的缓冲作用会维持到生殖生长阶段的后期[57]。Lee等[58]将玉米种子发芽2天后置于外源磷浓度为0~0.5 mmol/L范围内的培养基上生长,发现磷有效性的降低会显著影响液泡Pi含量,而细胞质中Pi占比则几乎没有差异。植物在体内细胞增大或分裂为两个子细胞的生长过程中,部分细胞质的Pi会被作为新细胞的结构材料而使用,然后细胞会从外部介质或者液泡中吸收Pi作为补偿,这一阶段Pi的代谢对胞质Pi水平的影响大于对总磷含量的影响[59]。
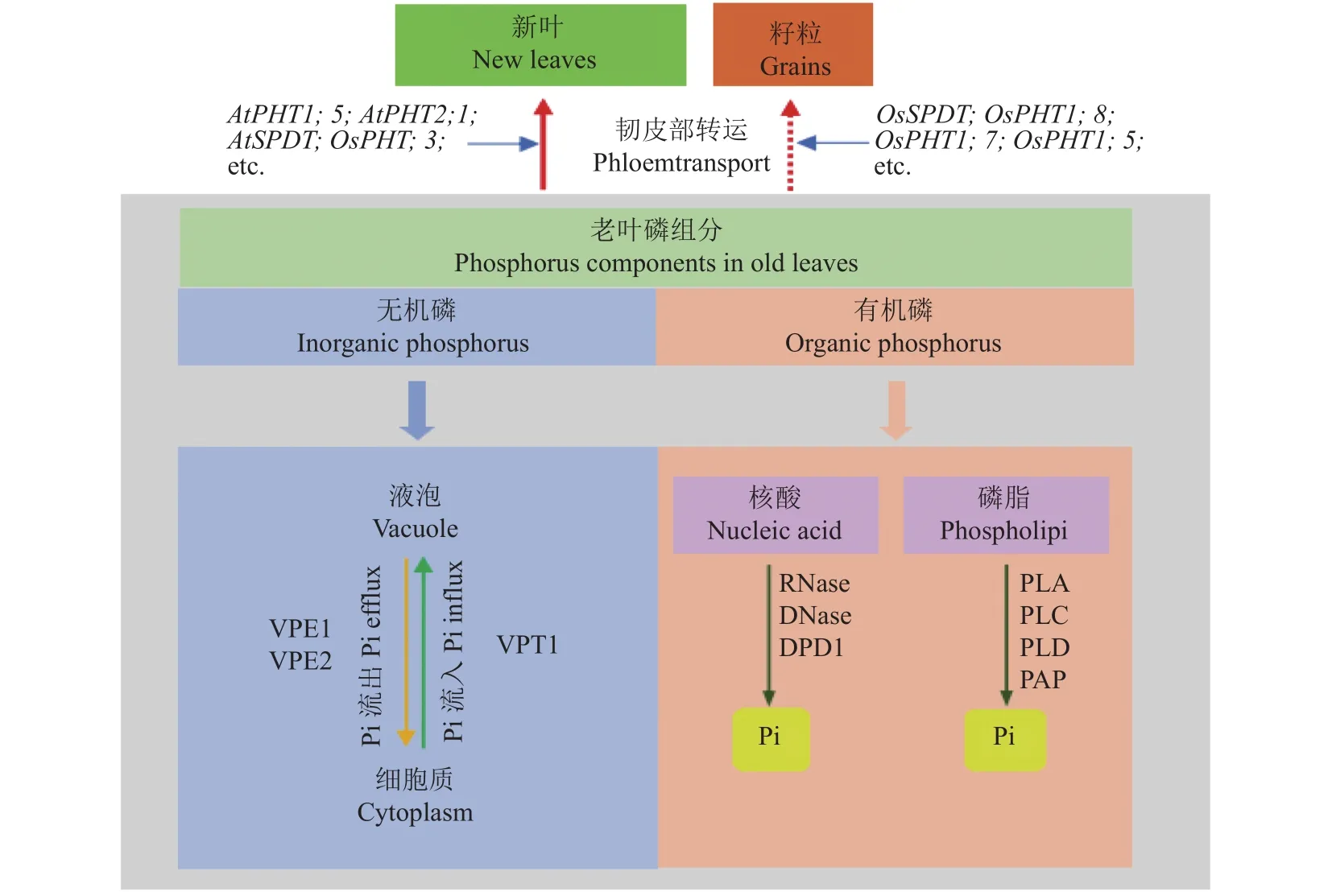
图1 植物地上部磷素进行再活化与转运机制综合模式图Fig. 1 A comprehensive model diagram of the mechanism of phosphorus reactivation and transport in plant shoot
在细胞质中保持稳定的Pi水平对于维持细胞内磷稳态起着非常重要的作用。细胞质Pi的稳态主要是通过液泡与其之间进行Pi的膜转运和有机磷酸盐向无机磷酸盐的代谢转化而实现的[59]。大麦叶片的叶肉细胞有能力通过改变膜转运活性和/或消耗液泡中的Pi来维持细胞质Pi水平的恒定[54]。然而,有研究表明当植物由于摄取甘露糖或被磷酸化而引起其突然需求细胞质Pi时,此时即使存在大量液泡磷库,最终也会耗尽细胞质磷库[60–61]。综上所述,液泡Pi的储存与再利用对调节细胞内磷稳态起着关键作用,但是在植物应对极端情况时调节作用有限。
2.2 有机磷库中磷的释放
处于低磷胁迫条件下的植物,可以从不同的磷库中重新获取磷并再分配以保证植物的生长发育[13]。当液泡无机磷对胞质缺磷的缓冲不能满足植物的磷素需求时,有机磷便开始降解以实现磷的再利用。低磷胁迫下的植物体内Pi含量显著降低,组织中不同磷库的利用存在较大差异[13,62]。叶片衰老过程中,持续的磷匮乏耗尽液泡Pi库,且显著减少了细胞质Pi库,与此同时细胞内会诱导并分泌大量的水解酶以从有机磷库中释放Pi[17]。核酸和磷脂等有机磷组分的活化对于Pi的再分配利用及植物的正常生长发育起着非常重要的作用(图1),并且有机磷库在提高植物磷利用效率过程中涉及到复杂的生物学机制。
2.2.1 核酸—磷含量最丰富的有机磷库 核酸是植物体最大的有机磷库,约有50%的有机磷储存于核酸,且其中约80%以核糖体RNA (rRNA)的形式存在[13,63–64]。供磷不足导致核糖体数量减少,从而影响蛋白质的合成,继而使植物生长缓慢。与磷供应充足的植株相比,低磷条件下生长的拟南芥地上部RNA含量减少了90%,导致其生长受阻[65]。在植物叶片发育的过程中,rRNA水平随着蛋白质需求量的增强而增加,而成熟叶片中蛋白质需求量减少,rRNA水平也随之下降[66–67]。由于RNA中磷的丰度很高,从RNA中回收磷能够有效提高植物磷利用效率。研究表明核酸酶RNases负责从rRNA中回收Pi,番茄叶片中的 LX RNase (一种 RNase)在其衰老后期会被诱导表达并参与RNA的分解代谢过程[68]。RNases中发挥主要作用的是T2家族基因[69],在拟南芥的研究中发现T2家族能受低磷胁迫和/或衰老而诱导表达[70],其中S-like RNases在Pi的回收中发挥重要作用[69]。RNase先通过2',3'-环化核苷酸中间体(cNMP)将RNA分解为核苷一磷酸(NMP)[71]。这种cNMP中间体随后被环状核苷酸磷酸二酯酶进一步分解代谢产生NMP,继而作为紫色酸性磷酸酶(PAP)的底物进行酶促反应,释放Pi并将其运输到库组织中利用[72]。
虽然植物中DNA含量在总核酸中的占比远低于RNA,但由核DNA与细胞器DNA (orgDNA)共同组成了细胞总DNA,且两者均可发生降解以提高细胞Pi含量[73]。orgDNA作为内在磷源存贮于细胞内,大量的细胞器基因构成了近半数的以核酸存贮的有机磷库。在植物成熟组织,特别是叶组织(内部叶绿体基因占比能够达到总DNA含量的30%,且每个细胞的叶绿体基因组的拷贝量能够达到1000份)具有很大的拷贝数量[74]。据报道,双功能核酸酶1 基因BFN1受叶片衰老的诱导表达量上调,继而降解单链DNA或RNA[75–76],释放出的Pi能够被转运到库组织中供植物生长发育所需。Takami等[74]研究表明,在低磷胁迫下,拟南芥和白桦树中的叶绿体DNA会被脱氧核糖核酸外切酶1 (DPD1)降解,释放的Pi则从下位叶转移到上位叶以供新生器官发育所需。
综上所述,当植物处于低磷胁迫和/或其叶片在衰老过程中时,RNA是核酸磷再利用的主要贡献者,而细胞器DNA的含量虽少但也在一定程度上起磷再活化作用,且释放的Pi对提高植物磷利用效率与整体磷素循环具有重要意义。
2.2.2 磷脂—参与低磷下的膜脂质重塑反应 磷脂是质膜、类囊体膜等生物膜的重要组成成分,同时也是植物体内的第二大有机磷库,这部分磷素约占成熟叶片总磷库的25%[13]。植物在响应低磷胁迫时,叶片或根中的磷脂可以通过膜脂质重塑降低体内磷消耗,该过程的第一步反应是磷脂酶水解磷脂释放Pi[77]。而不同磷脂酶通过不同的水解位点水解磷脂,可据此将其分为4大类:磷脂酶A1 (PLA1)、磷脂酶 A2 (PLA2)、磷脂酶 C (PLC)和磷脂酶 D (PLD)[78]。除此之外,有研究发现PLC的同工酶非特异性磷脂酶C (NPC)也参与调节低磷营养下的磷脂酶活性,但拟南芥体内的NPC4在植株缺磷时表达量上调,且NPC4功能的缺失显著降低了PLC的活性[79]。磷脂的降解主要通过PLC的直接途径、涉及PAP活性的PLD的间接途径,PLC水解磷脂产生二酰甘油和磷酸化的头基,而PLD水解磷脂产生磷脂酸,其进一步通过PAP生成二酰甘油[78–82]。PLA也可通过水解磷脂产生溶血磷脂与游离脂肪酸的间接途径释放[30]。通过磷脂酶水解磷脂产生的二酰甘油作为底物合成半乳糖脂和/或硫脂用于替代膜中磷脂,这有利于维持生物膜的正常结构和功能,而且释放的Pi被转移到更活跃的库组织(如新叶、圆锥花序)中[3,83]。植物细胞中含有大量的半乳脂类,如单半乳糖甘油二酯(MGDG)和双半乳糖甘油二酯(DGDG)以及硫代异鼠李糖甘油二酯(SQDG),它们与磷脂酰甘油(PG)一起为类囊体膜的主要成分[84]。在低磷胁迫下,叶绿体中的PG被SQDG代替,质体外膜中的磷脂被DGDG取代[85–86]。缺磷时,多年生黑麦草中编码SQDG的关键酶UDP-硫代异鼠李糖合酶的基因表达量显著增加。同样地,在拟南芥研究中发现缺磷情况下,SQDG和DGDG水平均有所增加,同时磷脂含量相应减少[87–88]。另外,Meike等[89]研究发现,MGDG也可作为DGDG等非含磷脂质的合成前体参与到膜脂质重塑中。
磷脂水解的另一条重要途径是脂质酰基水解酶(LAH)水解磷脂产生甘油磷酸二酯(GPD)和游离脂肪酸链。甘油磷酸二酯磷酸二酯酶(GPX-PDE)将GPD进一步降解为3-磷酸甘油(G3P)和相应的醇,随后G3P可以通过酰基转移酶和紫色酸性磷酸酶PAP转化为二酰甘油和Pi[90–91]。白羽扇豆中GPXPDE1/2的表达受缺磷诱导,且能在低磷胁迫下参与磷脂代谢并促进植株根毛的形成发育,继而增强植株对低磷养分的适应性[92]。Mehra等[93]在水稻研究中发现,OsGPX-PDE2过表达植株通过脂质重塑和改善根系结构增加了幼苗中的Pi含量,且与野生型相比,超表达株系能增加生物量和丙酮酸(PA)含量。Cheng等[91]在拟南芥研究中发现,GPX-PDE有助于释放G3P中的Pi并维持细胞内的Pi稳态。Wang等[94]研究表明ZmGPX-PDE1能够催化玉米中GPD的降解,促进磷从老叶到新叶的循环,同时发现ZmGPXPDE1基因在叶片衰老过程中表达量上调。因此,磷脂的水解及GPX-PDE对GPD的降解能够提高低磷营养下磷的再活化利用。
膜脂质重塑有利于磷脂中磷的回收,维持生物膜的功能与完整性,从而显著提高植物磷利用效率及其缺磷耐受性。Stigter等[30]研究发现植物在缺磷与衰老时有许多相似的代谢及转录组变化,许多低磷响应基因(如半乳糖脂合成酶基因,磷转运蛋白基因等)的表达也可受衰老诱导上调。由此可见,研究植物在这两种情况下磷脂代谢的相关性为进一步深入了解磷再利用的分子生物学机制提供了思路。
2.2.3 其它有机磷库 有机磷库中低分子量的磷酸酯和磷酸化蛋白也能在提高植物磷利用效率方面发挥一定的作用,其中磷酸化蛋白主要参与调控并维持植物正常的生长发育[13]。植酸(肌醇六磷酸)是作物种子中磷素的主要储存形式,占种子干重的1%~4%,其含磷量约占总磷量的65%~80%[95–96]。植素是植酸的钙、镁盐或钾、镁盐,属于磷脂类化合物。在种子萌发过程中,植酸能被植酸酶水解并释放出Pi供给子叶发育和幼苗生长,即储存在种子中的磷素得以重新利用[45,97]。种子中Pi的释放对其发育阶段生物膜的建成及淀粉代谢具有重要作用[98–100]。种子中Pi的消耗与其自身质量、幼苗发育需要量、土壤磷有效性等密切相关,一旦种子Pi储量耗尽,作物在持续快速生长阶段的磷需求就依赖于根系对土壤磷的吸收[13,17]。
植物紫色酸性磷酸酶PAP家族能有效水解磷酸酯并从中释放Pi,且其活性在酸性条件下最佳[101]。Stigter等[30]在拟南芥中的研究发现,AtPAP26在受磷饥饿和/或叶片衰老过程中发挥了关键作用,拟南芥老叶中分泌的AtPAP26可能具有降解流出质膜的磷酸酯的功能以最大限度地回收Pi。因此,在低磷胁迫下,植物体内各有机磷库能够有效维持植株整体的磷循环并尽可能保证其进行正常的生长发育。
3 磷再利用的转运机制
磷酸盐转运蛋白 (phosphate transporters,PHTs)具有有效吸收和转运Pi的功能,可根据介质中有效磷浓度的高低将其分为高亲和力转运系统和低亲和力转运系统,而前者主要负责在低磷营养(3~10 μmol/L)下吸收Pi[53,102–103]。根据PHTs的结构及其亚细胞定位的不同,可以分成PHT1、PHT2、PHT3和PHT4亚家族[103],它们分别定位于质膜、叶绿体膜、线粒体膜和高尔基体膜上,并在植物生长发育过程中发挥着各自的作用[104]。许多研究表明,烟草NtPHT1;1、NtPHT1;2,拟南芥 AtPHT1;1、AtPHT1;4、AtPHT1;5、AtPHT1;8、AtPHT1;9和番茄LePT1、LePT2等均属于高亲和磷酸盐转运体[105–111],而水稻OsPHT1;2与最近报道定位于叶绿体上的OsPHT2;1等均属于低亲和磷酸盐转运体[112–113]。
Pi被转运到根表皮细胞后,进一步装载到木质部中向上转运并分配到地上部库组织中供植物利用[114]。在低磷胁迫下,储存于液泡以及衰老组织中的Pi需要通过一系列PHTs (如AtPHT1;5、OsPHT1;3)的协助将其转运到细胞质和/或对磷有需求的库组织中而得以被再利用,继而满足植物生长发育对磷素的需求。
3.1 液泡与细胞质间的Pi转运机制
液泡Pi首先被转运至胞质中再利用以缓解植物缺磷的状况(图1)。已有研究发现了具有N端SPX(SYG1/PHO81/XPR1)结构域和C端主要协同转运蛋白超家族(MFS)结构域且定位于液泡上的液泡Pi转运蛋白(VPTs),又称SPX-MFS蛋白或PHT5家族,能介导Pi在液泡膜上转运[102,115]。MFS是目前已知最大的膜转运蛋白超家族之一[116],且植物PHTl家族属于MFS超家族[117–118]。目前在拟南芥研究中发现的VPT家族主要包括VPT1 (PHT5;1)、VPT2和VPT3成员,且它们均定位于液泡膜上[118]。通过膜片钳及31P核磁共振波谱分析,表明VPT1主要负责将细胞中多余的Pi转运并储存进液泡[102,115]。一项研究发现,拟南芥中VPT1功能缺失会激活VPT3,且VPT3缺失会降低vpt1突变体植株液泡的吸磷效率,推测VPT3在Pi从胞质向液泡转运过程中起着一定作用[119]。另有研究指出水稻PHT5的同源物OsSPXMFS1、OsSPX-MFS2和OsSPX-MFS3也定位于液泡膜上[120],其中除OsSPX-MFS2的表达受缺磷诱导外,OsSPX-MFS1和OsSPX-MFS3的表达量均受到抑制[103]。但是,有研究发现水稻OsSPX-MFS1能够实现拟南芥pht5;1突变体的生长表型互补,由此推测OsSPX-MFS1可能具有由胞质向液泡运输Pi的功能[115]。而水稻OsSPX-MFS3能介导Pi流入非洲爪蟾卵母细胞,且OsSPX-MFS3超表达植株液泡中Pi水平降低,推测OsSPX-MFS3可能作为液泡Pi外排转运蛋白将Pi从液泡中运出[120]。与此相反,还有一项研究表明,OsSPX-MFS3是水稻液泡Pi流入转运蛋白[53]。有研究者通过对液泡膜进行蛋白质组学分析得到一对甘油-3-磷酸转运蛋白(GlpT,即OsVPE1和OsVPE2),并且发现它们在磷饥饿条件下生长的水稻根中丰度增加[53]。可能的解释是GlpT属于MFS蛋白家族且能促进G3P的摄取,同时其也作为一种反向转运蛋白,在将G3P摄入细胞质的同时促进Pi进入周质,但是这一过程受Pi浓度梯度的控制[121]。通过进一步研究发现,在酵母和蛙卵细胞中异源表达OsVPE1和/或OsVPE2可将Pi运入细胞内,并且处于磷饥饿条件下的Osvpe1Osvpe2双突变体液泡中Pi含量较野生型高,同时过表达OsVPE1或OsVPE2降低了液泡中Pi含量,这表明OsVPE是液泡Pi外排转运蛋白[53]。
综上所述,VPT1和VPT3可以将细胞中多余Pi转运到液泡中储存起来,其中前者的作用更为突出。目前有关液泡Pi外排转运蛋白的研究相对较少,其中OsVPE蛋白是已得到证实的液泡Pi外排转运蛋白,主要负责将液泡Pi转运入细胞质。液泡Pi流入转运蛋白与外排转运蛋白共同参与调控细胞磷稳态,有助于调节Pi分配周转及再利用效率,因此有待探索更多的液泡Pi转运蛋白及调控机制。
3.2 营养器官间的Pi转运机制
磷是植物体内易于移动的营养元素,其由源组织(如衰老叶片)到库器官(如幼叶)的迁移(Pi通过韧皮部有效回收磷营养)是磷饥饿状态下植物的一种适应性策略(图1)[122],可提高内部磷的再利用效率[123–124]。
磷酸盐转运蛋白PHT1家族不仅参与根系对土壤Pi的吸收与转运,且该家族某些成员还参与老叶中贮存Pi向库器官的迁移。有研究发现缺磷胁迫可以诱导PHT1;5在老叶、子叶及花的韧皮部细胞中表达[108]。拟南芥AtPHT1;5在衰老叶片维管束韧皮部中高度表达,并负责将Pi从老叶向正在发育的叶片中进行再转运[106]。另有研究发现大麦HvPHT1;6在缺磷的老叶韧皮部中的转录丰度也有所增加[125–126]。水稻OsPHT1;3能够在极度缺磷条件下高度表达并参与Pi的转运与再分配。当外界供磷浓度低于5 μmol/L时,OsPHT1;3能参与磷素的吸收并具有将Pi从根系向地上部转运的活性,与此同时OsPHT1;3也能在基部节维管组织的韧皮部中特异表达,负责将Pi从老叶向新叶中转运[122]。Versaw等[127]研究发现除PHT1家族成员具有在缺磷胁迫下对老叶贮存的Pi进行再转运的活性之外,PHT2家族也参与其中。野生型拟南芥的幼叶与老叶中Pi含量比随着植株缺磷时间的延长而增加,而pht2;1突变体的幼叶和老叶中Pi含量基本保持不变,表明AtPHT2;1介导了缺磷胁迫下Pi从老叶到幼叶的再分配。另有研究表明水稻低亲和磷酸盐转运蛋白OsPHT2;1受低磷诱导表达,并参与了植株体内磷的再分配过程[128]。
3.3 营养器官与生殖器官间的Pi转运机制
植物生长过程中其体内的源库关系是动态变化的,这主要取决于其生长速度、发育阶段及Pi有效性,因此Pi在植物体内的迁移是一个相对复杂的过程[124,129–130]。植物在花芽分化后由营养生长转变为生殖生长阶段[131–132],此时生殖器官成为植物体内新的库,大量磷素从营养器官中再活化并转运到生殖器官供植株所需。最近的研究发现低磷胁迫下生长的小麦在花后吸收的磷(约72%)转运到籽粒,但这部分磷仅占籽粒磷的19%,其余大部分(81%)来自营养器官(根、茎、叶)中磷的再活化[44]。
在发育早期的水稻叶片中会积累大量的Pi,并在发育后期将叶片中储存的Pi运输到穗部[132]。水稻OsPHT1;8属于高亲和磷酸盐转运蛋白,主要负责在植株生长后期将Pi从营养器官转运到生殖器官。Jia等[133]研究发现抑制OsPHT1;8活性的植株穗轴磷含量较野生型增加约30%,且未灌浆稻壳磷含量仅为野生型的70%左右,同时其结实率降低,推测OsPHT1;8可能参与了Pi从穗轴向籽粒转运。另有研究发现OsPHT1;5蛋白具有将磷素转运到种壳等部分生殖器官的功能,但不足以改变籽粒中的磷含量,此外,OsPHT1;7也具有类似功能但其功能较OsPHT1;5更弱[134]。Yamaji等[135]研究发现水稻的磷分配转运蛋白(SPDT)能够在节点处特异表达,且SPDT发生突变会减少籽粒中的磷而增加叶片中的磷,表明OsSPDT蛋白在水稻节点处具有将磷优先分配给籽粒的活性。Ding等[136]研究表明,拟南芥AtSPDT介导了磷从木质部经形成层向韧皮部的转运,继而实现磷组织及器官的优先分配利用。AtSPDT的表达量受缺磷诱导上调,敲除AtSPDT的植株在低磷营养下降低了组织器官中的磷含量,减少了磷向种子及新叶的迁移,从而抑制了新生器官(如幼叶)的生长[136]。另有研究发现在低磷胁迫下,番茄质子焦磷酸酶(AVP1D)具有促进磷从营养器官向生殖器官转运的活性,并进一步调控果实的发育和成熟[134]。近期的研究表明OsPHO1;2能够介导水稻苗期根-茎组织间的Pi转运[137],Ma等[138]利用膜片钳技术首次直接证实OsPHO1;2具有Pi内流和外排转运活性且以外排活性为主。研究发现Ospho1;2突变体籽粒灌浆过程中胚乳细胞的Pi含量显著累积而总磷含量降低,表明该蛋白能将Pi从胚乳细胞中释放出来(外排),维持籽粒中Pi稳态并保证有机磷的正常合成[138]。综上,Pi从营养器官向生殖器官转运显著提高了磷再利用效率,有利于作物后期生长发育过程中磷素的积累,对提高作物结实率与促进果实发育具有积极作用。
4 结论与展望
植物在应对缺磷胁迫和/或叶片发生衰老过程中,体内各有机磷库与无机磷库中的磷素会被酶类水解活化,并通过磷转运蛋白转运到需无机磷的新生组织及器官中再利用,继而提高了植株磷的再利用效率并有效缓解植物缺磷的状况,这一过程对维持植物正常生长发育与促进整体的磷循环发挥着重要作用。许多受缺磷诱导的基因也可受衰老诱导而发生上调,比如植物在缺磷或衰老过程中均可发生膜脂质重塑反应。因此,缺磷和衰老两种胁迫条件下磷的活化再利用有何区别有待于进一步探索。目前,PHT1已被鉴定为可以将Pi从老叶转运到新叶中的主要磷酸盐转运蛋白家族,且有研究发现定位于叶绿体上的PHT2家族成员(PHT2;1)也参与了老叶中磷的转运过程。但是关于PHT1、PHT2、PHT3和PHT4家族蛋白如何将磷素从源器官转运到库器官缺乏系统研究。综上所述,需要深入探索植物体内磷素的再活化利用及与磷转移相关的分子生物学机制,为提高磷的利用效率并培育出磷高效作物品种提供科学理论依据与技术支撑。

