白术多糖对Ang-Ⅱ诱导的血管平滑肌细胞增殖及氧化应激的作用
巩克民, 季宏建
(1.江苏医药职业学院药学院,江苏 盐城 224005;2.盐城市第三人民医院药学部,江苏 盐城 224005)
动脉粥样硬化是心肌梗死和脑卒中的发病基础,其基本的病理表现为血管壁弹性下降、血管内膜损伤、修复、增厚及其导致的管腔狭窄,继而引发靶器官的缺血缺氧损伤,最终引发一系列严重疾病[1]。内皮细胞、巨噬细胞和血管平滑肌细胞(vascular smooth muscle cells,VSMCs)参与了动脉粥样硬化的形成和发展[2],VSMCs在新生内膜的大量积聚是血管中膜平滑肌细胞迁移至内膜并大量增殖造成,有效抑制VSMCs的活化及增殖可能是防治动脉粥样硬化的重要环节[3]。而氧化应激是动脉粥样硬化发生发展过程中的重要促进因素之一,主要通过氧化修饰作用,诱导血管基因表达、促进局部炎症反应和VSMCs增殖,从多方面参与动脉粥样硬化的发生发展[4]。
中药多糖是一种来源广泛、无毒副作用的天然的大分子化合物,具有多种生物活性和多种药理作用。有研究报道[5-7],多糖能够减轻脑缺血造成的神经功能损伤,抑制神经元凋亡,降低模型大鼠脑组织中的NO水平和NOS活性,表现出明显的抗氧化应激损伤活性,发挥脑组织保护作用;同时也有研究报道[8-9],多糖能够减轻机体氧化应激反应的发生,抑制血管平滑肌细胞增殖,保护血管内膜从而减轻动脉粥样硬化的形成。白术多糖作为白术的主要生物活性成分之一,已经在抗炎、抗氧化、抗肿瘤、提高免疫力、治疗中枢神经系统疾病等方面被广泛地使用[10]。但是关于白术多糖在心脑血管方面的应用研究极少。本实验旨在观察白术多糖对血管紧张素Ⅱ (angiotensin-Ⅱ,Ang-Ⅱ)诱导的VSMCs增殖及氧化应激反应的影响,以期为白术多糖应用于临床脑血管病的防治提供理论依据。
1 材料
1.1 动物 8周龄雄性SPF级SD大鼠,由江苏省实验动物中心提供,动物生产许可证号SCXK(苏) 2019-0036。
1.2 药物 白术多糖购于陕西慈缘生物技术有限公司,批号CY190105,纯度≥98%,深棕色粉末状,极易溶于水,双蒸水配制成20 mg/L贮备液,0.22 μm滤膜过滤除菌,分装并贮存于常温备用。
1.3 试剂 DMEM高糖培养基、胎牛血清、0.25%胰蛋白酶和青-链霉素均购于美国HyClone公司;Ang-Ⅱ购于美国Sigma公司;p-p38、c-Myc、β-actin抗体均购于美国R&D公司;PE-BrdU细胞增殖检测试剂盒购于江苏凯基生物技术股份有限公司;p38MAPK抑制剂SB203580、ROS活性氧检测试剂盒、SOD和MDA试剂盒均购于上海碧云天生物技术有限公司。
2 方法
2.1 大鼠胸主动脉VCMCs的分离及培养 2%戊巴比妥钠麻醉大鼠后,在无菌条件下取出胸主动脉,剔除血管外膜和内膜后,将血管段剪成1 mm2大小的组织块,均匀铺在培养瓶底部,加入含有20%胎牛血清的DMEM培养基,置于37 ℃,5% CO2饱和湿度培养箱培养,待观察到组织块周围的细胞生长融合后,用0.25%胰蛋白酶消化传代,取第4~5代细胞用于后续实验研究。
2.2 分组处理 取第4~5代VCMCs细胞分为5组,对照组,VCMCs细胞不经过任何处理,正常培养;Ang-Ⅱ组,采用0.1 μmol/L Ang-Ⅱ处理VCMCs 24 h[11];Ang-Ⅱ+白术多糖组,采用0.1 μmol/L Ang-Ⅱ刺激24 h,80 μg/mL白术多糖处理VCMCs 48 h;Ang-Ⅱ+SB203580组,采用10 μmol/L p38MAPK抑制剂SB203580预处理2 h[12],0.1 μmol/L Ang-Ⅱ刺激24 h;Ang-Ⅱ+ SB203580+白术多糖组,依次采用10 μmol/L p38MAPK抑制剂SB203580预处理2 h,0.1 μmol/L Ang-Ⅱ刺激24 h,80 μg/mL白术多糖处理48 h。
2.3 MTT比色法检测VCMCs细胞活力 取对数生长期VCMCs细胞,以每孔2×103个细胞种于96孔板,先采用0.1 μmol/L Ang-Ⅱ诱导刺激24 h,再采用不同质量浓度(0、20、40、80、160 μg/mL)的白术多糖分别处理24、48、72 h。吸取培养液,取出不同分组的细胞培养板,每孔加20 μL MTT 溶液(5 mg/mL),继续培养4 h,然后吸掉上清,每孔加入150 μL DMSO溶解液,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm波长处测量各孔光密度(OD490)表示细胞活力。
2.4 BrdU法检测VCMCs细胞增殖情况 VCMCs细胞分组处理后,按照试剂盒说明书步骤进行操作和BrdU标记,加入PE-BrdU抗体,4 ℃避光孵育30 min。使用488 nm激发波长、575 nm发射波长,经流式细胞仪检测,以BrdU标记的阳性细胞所占百分比表示细胞增殖情况。
2.5 流式细胞仪检测细胞内ROS水平 培养VCMCs细胞,分组处理后收集细胞沉淀,重悬后按照试剂盒说明书步骤进行,加入10 μmol/L DCFH-DA荧光探针避光孵育30 min,PBS洗涤3次,使用488 nm激发波长,525 nm发射波长,上流式细胞仪检测,以相对平均荧光强度值表示细胞内ROS水平。
2.6 细胞内SOD活性及MDA水平检测 培养VCMCs细胞,分组处理后收集细胞沉淀,冰水浴条件下裂解细胞,按照试剂盒说明书进行操作,采用硫代巴比妥酸法测定MDA水平,羟胺法测定T-SOD活性。
2.7 Western blot检测p-p38和c-Myc的蛋白表达 培养VCMCs细胞,分组处理后收集细胞沉淀,加入RIPA裂解液,提取细胞总蛋白,采用BCA法检测各组蛋白浓度。取20 μg蛋白上样,进行SDS-PAGE电泳分离,再将蛋白转印至PVDF膜上,5%脱脂奶粉封闭液封闭2 h,洗膜,加入一抗稀释液(c-Myc、p-p38和β-actin,1∶1 000),室温孵育1 h,洗膜,加入HRP标记的山羊抗兔或小鼠IgG(1∶20 000),室温孵育1 h,洗膜,滴加化学发光试剂,于暗室中显影分析。
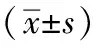
3 结果
3.1 白术多糖对暴露于Ang-Ⅱ条件下VCMCs细胞活力的影响 如图1所示,与对照组比较,Ang-Ⅱ作用24、48、72 h均可提高VCMCs细胞增殖活性(P<0.05);与Ang-Ⅱ处理组比较,80、160 μg/mL白术多糖处理48、72 h均可抑制Ang-Ⅱ诱导的VCMCs细胞活力增强(P<0.05)。综合考虑,选择80 μg/mL白术多糖处理48 h作为实验条件。

注:与对照组比较,*P<0.05;与Ang-Ⅱ+白术多糖(0 μg/mL)组比较,#P<0.05。图1 不同质量浓度白术多糖对VCMCs细胞活力的影响
3.2 白术多糖抑制Ang-Ⅱ诱导的VCMCs细胞增殖 如图2所示,与对照组比较,Ang-Ⅱ组VCMCs细胞增殖水平增加(P<0.05);与Ang-Ⅱ组比较,Ang-Ⅱ+白术多糖组和Ang-Ⅱ+SB203580组VCMCs细胞增殖水平降低(P<0.05);与Ang-Ⅱ+白术多糖组比较,Ang-Ⅱ+SB203580组和Ang-Ⅱ+SB203580+白术多糖组VCMCs细胞增殖水平降低(P<0.05);Ang-Ⅱ+SB203580组、Ang-Ⅱ+SB203580+白术多糖组VCMCs细胞增殖水平无明显变化(P>0.05)。
3.3 白术多糖对Ang-Ⅱ诱导条件下VCMCs细胞内氧化应激水平的影响 如图3所示,与对照组比较,Ang-Ⅱ组VCMCs细胞内ROS、MDA水平增加(P<0.05),SOD活性降低(P<0.05);与Ang-Ⅱ组比较,Ang-Ⅱ+白术多糖组和Ang-Ⅱ+ SB203580组VCMCs细胞内ROS、MDA水平降低(P<0.05),SOD活性增加(P<0.05);与Ang-Ⅱ+白术多糖组比较,Ang-Ⅱ+SB203580组和Ang-Ⅱ+SB203580+白术多糖组VCMCs细胞内ROS、MDA水平降低(P<0.05),SOD活性增加(P<0.05);与Ang-Ⅱ+SB203580组比较,Ang-Ⅱ+SB203580+白术多糖组VCMCs细胞内ROS、MDA水平以及SOD活性均无明显变化(P>0.05)。
3.4 白术多糖对Ang-Ⅱ诱导条件下VCMCs细胞内p-p38和c-Myc蛋白表达水平的影响 如图4所示,与对照组比较,Ang-Ⅱ组VCMCs细胞内p-p38和c-Myc蛋白表达水平增加(P<0.05);与Ang-Ⅱ组比较,Ang-Ⅱ+白术多糖组和Ang-Ⅱ+SB203580组VCMCs细胞p-p38和c-Myc蛋白表达水平降低(P<0.05);与Ang-Ⅱ+白术多糖组比较,Ang-Ⅱ+SB203580组和Ang-Ⅱ+SB203580+白术多糖组VCMCs细胞p-p38和c-Myc蛋白表达水平降低(P<0.05);与Ang-Ⅱ+SB203580组比较,Ang-Ⅱ+ SB203580+白术多糖组VCMCs细胞内p-p38和c-Myc蛋白表达水平无明显变化(P>0.05)。

注:A为ROS水平, B为SOD活性,C为MDA水平。与对照组比较,*P<0.05, **P<0.01;与Ang-Ⅱ组比较,#P<0.05;与Ang-Ⅱ+白术多糖组比较,■P<0.05。图3 白术多糖对Ang-Ⅱ诱导条件下VCMCs细胞内ROS、MDA水平及SOD活性的影响
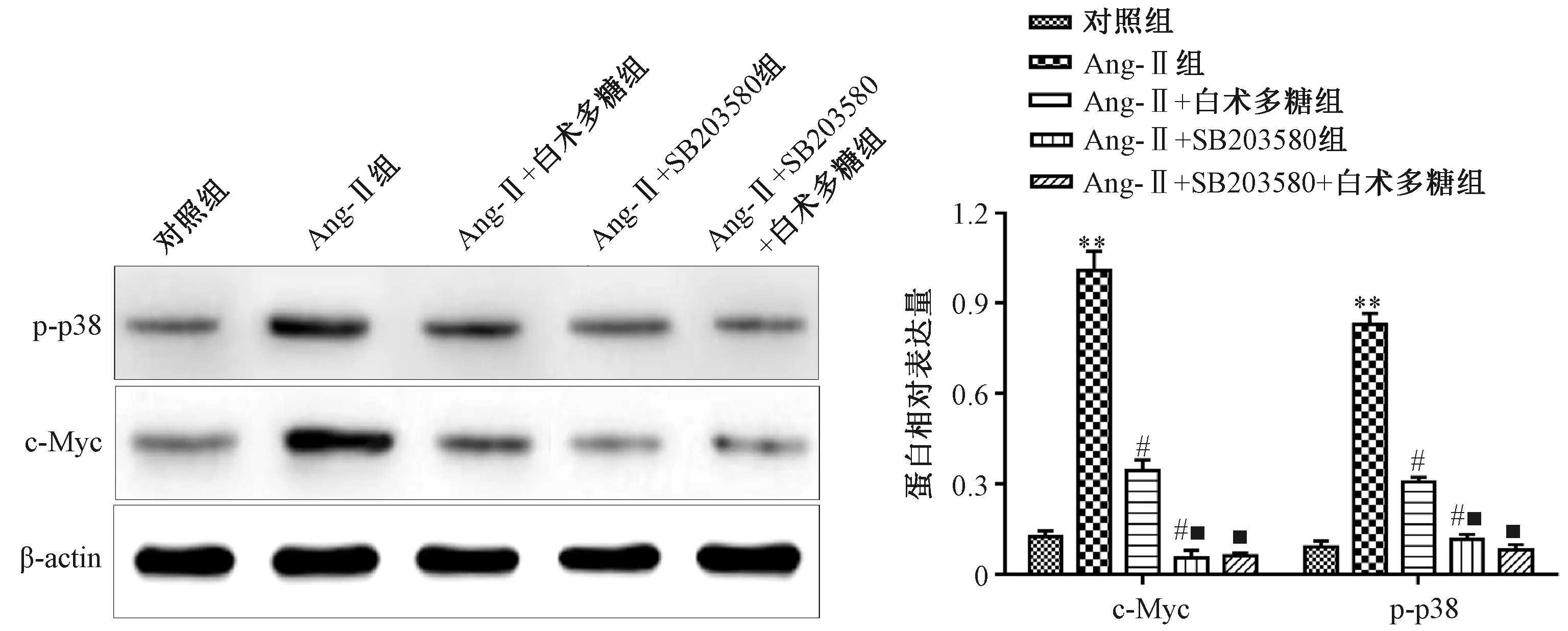
注:与对照组比较,**P<0.01;与Ang-Ⅱ组比较,#P<0.05;与Ang-Ⅱ+白术多糖组比较,■P<0.05。图4 白术多糖对Ang-Ⅱ诱导条件下VCMCs细胞内p-p38和c-Myc蛋白表达水平的影响
4 讨论
动脉粥样硬化是冠心病、脑卒中等心血管疾病最常见的血管病理改变,一直是心血管领域的研究重点。而VSMCs的异常增殖在动脉粥样硬化病变的形成过程中起到重要作用[13]。Ang-Ⅱ作为肾素-血管紧张素-醛固酮系统(RAAS)的重要功能因子,可以通过自分泌和旁分泌方式作用于VSMCs,刺激VSMCs增殖,且具有剂量依赖性[14]。因此,阻断Ang-Ⅱ诱导的VSMCs异常增殖可能成为预防动脉粥样硬化发生、发展的治疗靶点。本研究结果显示,Ang-Ⅱ刺激能够诱导VSMCs增殖并产生氧化应激,而白术多糖处理可抑制Ang-Ⅱ诱导VSMCs细胞增殖,并提高细胞抗氧化能力,并且其作用机制可能与抑制p38 MAPK通路激活有关,提示该药可能对动脉粥样硬化相关心血管疾病的治疗具有一定的疗效。
氧化应激是机体抗氧化反应与氧化反应之间的一种失控状态,机体组织中ROS生成过多是导致血管并发症产生的重要环节,从多方面参与动脉粥样硬化的发生发展[15]。已有研究表明[16],氧化应激发生时,ROS形成可促进细胞因子分泌和相应受体表达引起慢性炎症反应和VSMCs增殖。因此,减少ROS的产生以及提高VSMCs抗氧化水平或许是治疗和预防动脉粥样硬化相关疾病的重要途径。现有的抗动脉粥样硬化药物长期服用,均可导致不同程度的不良反应发生,故从天然植物药中寻找有效的抗动脉粥硬化药物成分是目前研究的热点。白术多糖是从白术根茎中提取出的多糖类,具有抗炎、抗氧化、抗肿瘤、提高机体免疫力、抗衰老、调节胃肠等多重药理作用。已有研究证实[17],白术可通过抑制氧化应激和RAAS的活化改善异丙肾上腺素诱导的大鼠心室重构。提示,白术多糖可能对Ang-Ⅱ诱导的VSMCs增殖及氧化应激具有一定的抑制作用。本研究结果显示,Ang-Ⅱ可诱导VSMCs增殖,并导致细胞内ROS、MDA水平增加,SOD活性降低,说明Ang-Ⅱ可导致细胞内氧化水平增加进而促进VSMCs增殖。然而Ang-Ⅱ处理一段时间后再采用白术多糖干预,结果显示VSMCs增殖被抑制,且胞内ROS、MDA水平下降,而SOD活性上升。表明,白术多糖对Ang-Ⅱ诱导的氧化应激和VSMCs增殖具有抑制作用,而有效抑制VSMCs增殖可能是临床上防治动脉粥样硬化的重要环节。
p38 MAPK是一种重要的转录因子,参与多种基因的表达调控,具有多种生物学功能。多项研究表明[18-19],p38 MAPK通路参与血管损伤后内膜增生过程。Wang等[20]研究显示,AngⅡ能通过激活p38 MAPK信号通路诱导VSMCs增殖,抑制p38 MAPK信号通路活化可抑制AngⅡ诱导的VSMCs增殖。同时,Jeong等[21]研究表明,白术复合物可抑制p38 MAPK信号通路活化。提示,白术多糖有可能通过抑制p38 MAPK信号通路活化进而抑制AngⅡ诱导的VSMCs增殖和氧化应激。为探讨白术多糖是否对AngⅡ激活的p38 MAPK通路产生影响,本研究对p38 MAPK信号通路蛋白进行了检测,结果显示,Ang-Ⅱ干预可诱导VSMCs中p38 MAPK信号通路相关蛋白p-p38和c-Myc蛋白的表达,采用p38 MAPK抑制剂SB203580干预可以抑制Ang-Ⅱ诱导的p38 MAPK信号通路活化,VSMCs增殖及氧化应激,表明抑制p38 MAPK信号通路活化可抑制Ang-Ⅱ诱导的VSMCs增殖及氧化应激。此外,本研究还显示,采用白术多糖干预对Ang-Ⅱ诱导的p38 MAPK信号通路活化具有抑制作用,然而白术多糖与SB203580联合干预并没有对Ang-Ⅱ诱导的VSMCs增殖及氧化应激出现叠加抑制效果,说明白术多糖是通过抑制p38 MAPK信号通路的激活进而抑制Ang-Ⅱ诱导的VSMCs增殖和氧化应激。
综上所述,白术多糖可能通过抑制p38 MAPK信号通路的激活,降低VSMCs细胞内ROS、MDA的生成,提高SOD活性,从而抑制Ang-Ⅱ诱导的VSMCs增殖,本研究结果为白术多糖对AS相关心血管疾病的治疗提供了实验依据,为其应用于临床脑血管病的防治提供了理论基础。

