同位素化学发展史上的三个里程碑

摘要: 通过对同位素化学的发展历程分析可知,同位素化学发展史上有三个重要的里程碑: 一是索迪发现放射性元素位移规则,提出同位素假说;二是阿斯顿发明质谱仪,使同位素现象的普遍性得到证实;三是查德威克发现中子,揭示了同位素现象的微观本质。同位素化学的发展,伴随着科学仪器的发明、科学方法的创新以及科学思想的演进。
关键词: 同位素化学; 索迪; 阿斯顿; 查德威克; 化学史
文章编号: 10056629(2022)01008405
中图分类号: G633.8
文献标识码: B
元素观和微粒观是自古以来人们认识物质的基本观念。随着科学思想的发展,基于哲学思辨的古代元素观和微粒观逐渐发展为基于实证的近代化学元素观和微粒观。至1808年,英国化学家道尔顿(J. Dalton, 1766~1844)在《化学哲学新体系》(A New System of Chemical Philosophy)中阐明了原子论思想:“相同元素的原子形状和大小都一样,不同元素的原子则不同;每种元素的原子重量都是固定的、不变的,原子的相对重量是可以测定的。[1]”此后,直至19世纪末,伴随着原子不可分的观点,人们一直认为一种元素只有一种原子,并把原子量视为原子的基本特征。
20世纪初,电子的发现使原子不可分的范式宣告终结,科学认识开始深入到原子内部,关于元素的认识也开始更新。科学家通过原子量的测定发现一种元素竟然可以有两种或两种以上的原子。由此,英国化学家索迪(F. Soddy, 1877~1956)提出了同位素假说,并逐渐形成一门新兴学科——同位素化学(isotope chemistry)。这门学科的兴起使化学元素观和微粒观有了新的内涵。
关于同位素化学发展史,目前国内外已有一些个案研究,如“Frederick Soddy: From Alchemy to Isotopes”[2]“1922年诺贝尔化学奖获得者——阿斯顿”[3]“哈罗德·尤里和氚的发现”[4]“索迪及其对放射化学的贡献”[5]等。然而,迄今为止,尚未见到从整体的角度考察同位素化学发展史的专门研究。为此,本文拟通过梳理翔实的史料,对此进行深入的考证分析。
1 索迪发现放射性元素位移规则,提出同位素假说
1921年,由于对放射性物质的化学知识和同位素的起源及性质研究方面的贡献,诺贝尔化学奖颁给了牛津大学化学教授索迪[6]。
索迪于1877年9月2日出生于英吉利海峡沿岸的一个小城市伊斯特本(Eastbourne)。索迪在伊斯特本学校上学时开始对化学感兴趣。1896年,他在牛津大学(Oxford)攻读本科,在那里他活跃于初级化学学会(Junior Chemical Society)。他的科学兴趣之一是物质的嬗变(transmutation),这是历史上炼金术士(alchemists)的目标。他于1898年以优异成绩毕业,但一直留在牛津,直到1900年夏天去了加拿大。
索迪到加拿大后,很快在蒙特利尔(Montreal)麦吉尔大学(McGill University)的化学实验室找到一份做实验室讲师(lab instructor)的工作。当时,在麦吉尔大学工作的物理学教授卢瑟福(Ernest Rutherford, 1871~1937)正想找一位化学家来协助他进行放射性研究工作。尽管两人都有很强的个性,但对放射性的共同兴趣促成了他们的成功合作[7]。
在研究的早期,他们用验电器(electroscope)测量钍样品的放射性。结果发现,当实验室门关闭时,强度最大;门打开时,强度最小。卢瑟福和索迪仔细考察了这些奇怪的结果后,发现钍正在产生一种放射性气体。他们研究发现这种气体不是由钍直接产生的,涉及一种中间物质。索迪和卢瑟福怀疑其中有新的放射性元素,称之为钍X(thorium X)。当用纯硝酸钍重复试验时,结果仍然显示有钍X的存在。
经过一段时间的仔细测量和试验的证据使索迪确信有一些新的、化学性质不同的物质正在形成。他和卢瑟福检查了温度和溶液条件变化的影响,看它们的结果是否与化学变化有关,但新物质的产生速度不受影响。1902年,卢瑟福和索迪宣布了一个革命性的新理论:“放射性是一种原子现象,同时伴随着产生新物质的化学变化。”索迪用炼金术士的术语“嬗变”来描述他们的理论。
后来,索迪对镭也产生气体的现象感到好奇,并于1903年3月离开卢瑟福,到伦敦与化学家拉姆塞(W. Ramsay, 1852~1916)一起工作。索迪首先关心的是为自己的调查找到纯镭的来源。到达后不久,他偶然发现一家商店出售的纯溴化镭每毫克7先令6便士。尽管这个价格有点贵,但索迪立即订购了20毫克。索迪记录道:“有了这20毫克,再加上另外一批由盧瑟福借给的32毫克……”。1903年7月8日,索迪和拉姆塞通过光谱研究证明,氦气是放射性衰变的产物。索迪认为氦是以α粒子的形式产生的。1908年,卢瑟福证实了索迪的理论。索迪还确认,钍和镭产生的神秘放射性气体是另一种惰性气体。它现在被称为氡220。这是元素自然嬗变的第一个明确的实验证据[8]。
1910年,在提取新钍(mesothorium)的氯化物时,索迪发现从样品中的铀(the uranium in his sample)中也提取了氯化镭和钍X的氯化物。在仔细评估了他的结果之后,索迪得出结论,新钍(mesothorium)、镭和钍X在化学上是相同的。1912年初,他邀请一位年轻的格拉斯哥化学家弗莱克(A. Fleck)与他合作,确定公认的放射性中间体的化学性质。他们发现了更多化学上相同、寿命较短的放射性元素,有些元素化学上不可分离,光谱上相同,但奇怪的是,它们以不同的方式分解[9]。
在放射性衰变过程中,检测到约40~50种不同元素,但周期表中容纳这些元素的位置不超过10~12个。1910年,索迪提出不同元素能够占据元素周期表中的同一位置,并提出了同位素的概念,但还没有形成同位素的术语(the term of isotopy)[10]。
1913年,索迪在提出他的位移定律时,给混乱带来了秩序。他认识到,当一个α粒子被排出时,一个元素在周期表上向较低质量的方向移动了两个位置;然后,两个β粒子的损失将使元素返回其原始位置。当元素回到周期表上的“同一位置”时,从化学和光谱上来说,它将是原来的同一个元素,但它的重量会有所不同。同年,在索迪岳父(一位工业化学家)举办的一次晚宴上,大家讨论了索迪的新概念,一位家庭朋友玛格丽特·托德博士(Dr. Margaret Todd)提出了同位素(isotope)这个名字(来自希腊语,isos topos,意思是“同一个地方”),指化学上相同但重量不同的原子[11]。至此,同位素假说正式形成,同位素化学开始发展。
2 阿斯顿发明质谱仪,证实同位素现象的普遍性
1922年,第19届诺贝尔化学奖颁发给剑桥三一学院院士阿斯顿(F.W. Aston, 1877~1945),“因为他用质谱仪发现了大量非放射性元素中的同位素,并阐明了整数法则(the wholenumber rule)”[12]。
阿斯顿于1877年9月1日出生于英国伯明翰的哈伯纳(Harbonne)一个商人之家。他1891年开始在莫尔文学院学习,1893年进入梅森学院学习自然科学。在梅森学院,他受到著名的化学家蒂尔登(W.A. Tilden)、弗兰克兰(P.F. Frankland)和物理学家坡印亭(J.H. Poynting)的指导。1898年,他在弗兰克兰指导下进行了酒石酸衍生物光学性质研究,发表了2篇有机化学方面的研究论文,并掌握了精准的吹玻璃技术,这为他日后的科学研究打下坚实的基础[13]。
1903至1908年,他在伯明翰大学成为玻印亭的研究生兼实验助手,1909年升为物理学讲师。阿斯顿在实验仪器制作和实验技巧上有着非凡的才能,这使玻印亭对他非常器重。1910年,时任卡文迪许实验室主任的英国物理学家汤姆逊(J.J. Thomson, 1856~1940)急需聘任一个擅长制作仪器并有一定实验技术的助手。为了阿斯顿有更快的发展和更好的前途,玻印亭十分慷慨地把阿斯顿推荐给汤姆逊。这样,阿斯顿来到了这个人才辈出的卡文迪许实验室,开始了新的科研生涯。
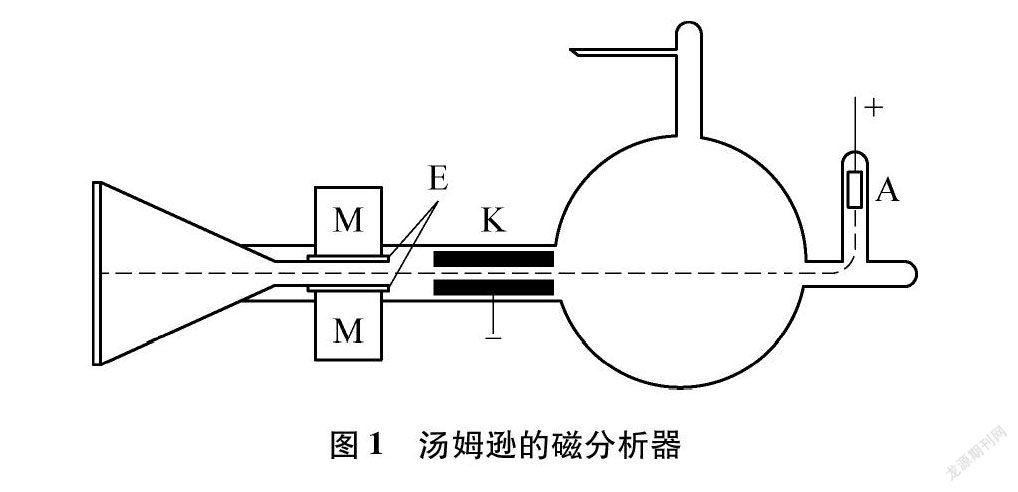
继1897年汤姆逊通过研究阴极射线发现电子后,奥地利物理学家维恩(W. Wien, 1864~1928)于1898年又发现,不仅阴极射线在磁场和静电场中发生偏转现象,某些正离子流也同样受磁场和静电场的影响。这种从气体放电管中引出的正离子流被称为阳射线。1905年,汤姆逊又开始研究阳射线,他使用的仪器是磁分析器(图1)。
在研究中他发现,把氖充入放电管做实验时,在磁场或静电场作用下,出现了两条阳射线的抛物线轨迹。经过进一步研究,他又测出这两条抛物线所表征的原子量各为20和22。这与当时公认氖的原子量20.18相矛盾。对此,汤姆逊的解释为,前者是氖的单质,而后者可能是氖与氢组成的特殊分子NeH2,它的分子量恰好是22。事实上,当时正值索迪提出同位素概念(1913年),但是汤姆逊对这一概念持否定的态度,并因此失去了新发现的良机。他的助手阿斯顿则幸运地得到这个良机。
汤姆逊让阿斯顿改进当时他做阳射线研究的气体放电实验装置,以更准确地测定阳射线在电磁场中的偏转度,从而来决定氖的组成和其原子量。阿斯顿制造了一个球形放电管和带切口的阴极,改进了真空泵,发明了可以检查放电管真空泄漏的螺管和拍摄抛物线轨迹的照相机。同时,他们将电场和磁场前后排列,二者的方向相互垂直,还使它们的作用力与阳射线平行而方向相反。在这种实验装置中,阳射线在两种场的作用下,经过不同玻璃制造的棱镜后,分别向相反方向偏斜,然后又聚焦到同一点上,使感光底片感光,被检测的气体元素的同位素会因为原子量不同,阳射线的速度也不同,致使其偏斜后的曲线曲率也不同。据此就可以测出同位素及其原子量。
阿斯顿认同并采用了索迪的同位素概念,用以解释他在实验中的发现。阳射线在电磁场作用下出现两条抛物线轨迹,表明同位素确实存在。由于同位素的质量不同,所以扩散时的速度也不同,固而出现两条抛物线轨迹。为了更清楚地证实这一点,他先用分馏技术,然后又用扩散法,将氖同位素进行分离,最后再精确地测定它们的原子量,证实了20Ne和22Ne的存在。1913年在全英科学促进会的会议上,阿斯顿宣读了论文,并做了实验演示,展示了两种氖同位素的试样。对于他的这项研究,同行们给予很高的评价。他也由此而获得了麦克斯韦奖。此后,阿斯顿开始设想发明一种可以测定各种元素均有同位素存在的仪器。
1919年,卢瑟福接替了汤姆逊成为卡文迪许实验室的负责人。卢瑟福最早提出放射性元素的嬗变理论,因而对同位素的假说是理解的。他对阿斯顿的工作给予了很大的鼓励和具体的指导。阿斯顿根据他原先改进的测定阳射线的气体放电装置,又参照了当时光谱分析的原理,对磁分析器作了改进后,设计出一个包括有离子源、分析器和收集器三个部分组成的、可以分析同位素并测量其质量及丰度的新仪器——质谱仪(图2)。这种精度极高的仪器使阿斯顿在同位素的研究中获得了丰富的成果。
他首先使用这一新仪器对氖作重新测定,证明氖的确存在20Ne和22Ne兩种同位素,又因它们在氖气中的比例约为10∶1,所以氖元素的平均原子量约为20.2(后来的研究又发现氖存在第三种同位素21Ne,氖元素的平均原子量为20.18)。随后,阿斯顿使用质谱仪测定了几乎所有元素的同位素。实验的结果表明,不仅放射性元素存在着同位素,而且非放射性元素也存在同位素,事实上几乎所有的元素都存在着同位素。在阿斯顿之前,索迪等人都是根据放射性元素的衰变产物来证实同位素的存在。现在,在质谱仪的帮助下,人们发现同位素的存在是个普遍的现象。阿斯顿在71种元素中发现了202种同位素。
阿斯顿运用质谱仪对众多元素所作的同位素研究,不仅指出几乎所有的元素都存在同位素,而且还证实自然界中的某元素实际上是该元素的几种同位素的混合体,因此该元素的原子量也是依据这些同位素在自然界占据不同比例而得到的平均原子量。例如氯元素,自然界的氯有两种同位素: 35Cl、 37Cl。其丰度为35Cl∶37Cl=3∶1,所谓丰度即同位素在自然界该元素中所占的百分比。所以氯的原子量既不是整数的35,也不是37,而是35.46。大多数元素的原子量为什么不是整数,原因就在这里。因此,阿斯顿提出了原子量的整数法则(the wholenumber rule,元素的各种同位素的原子量均为整数)。后来,随着质子、中子等基本粒子逐渐被发现,原子结构秘密也被揭开,元素质量的整数法则也得到了理论上的证明。
后来,阿斯顿又制成了三台质谱仪,其倍率达两千倍,精度达十万分之一。现在通过质谱仪,已测出地球上存在的同位素达489种,其中稳定同位素有264种,天然放射性同位素有225种。此外还发现人工放射性同位素达2000多种。阿斯顿的著作有《同位素》(1922年)和《质谱与同位素》[14]。
阿斯顿发明了质谱仪,证明了同位素现象的普遍性,使同位素化学得到长足的发展。至此,人们对化学元素这一概念有了新的认识,原先元素与原子等同的观念不适用了。元素周期表中的一个元素符号不再是只代表一种确定的元素,而是代表一类原子的集合。然而,从索迪到阿斯顿,均未揭示同位素现象的本质原因。
3 查德威克发现中子,揭示同位素现象的本质
1935年,诺贝尔物理学奖颁给了1932年在人工核反应中发现中子的英国物理学家查德威克(J. Chadwick, 1891~1974)。中子的发现加深了人们对原子核的认识,也让人们从原子核内部弄清了为什么会出现同位素现象。
1911年,英国物理学家卢瑟福(E. Rutherford, 1871~1937)通过α粒子散射实验的结果提出了原子结构的核式模型。1919年,卢瑟福做了用镭的同位素产生的α粒子轰击氮原子核的实验,结果发现了带正电荷的质子(proton)。那么,这些带有同种电荷的质子在原子核那样微小的空间中如何消解彼此间的强排斥力?卢瑟福等人认为原子结构中的电子分两部分,一部分在核内用于中和核内的正电荷,另一部分电子存在于核心的外围。在中性原子内,这些外围电子所带的负电荷总数必须与核内的纯净的正电荷数相等[15]。但卢瑟福的学生、英国物理学家莫塞莱(H.G.J. Moseley, 1887~1915)注意到,原子核所带正电荷数与原子序数相等,但原子量比原子序数大,这说明,如果原子核仅仅由质子和电子组成,它的质量是不够的,因为电子的质量可忽略不计。此外,当时科学界对卢瑟福的原子结构模型存在疑问: 电子究竟以什么状态存在于原子核内?
针对上述困境,卢瑟福于1920年6月在著名的贝克尔演讲(Bakerian Lecture)中阐述了他的思想:“在某些条件下,一个电子有可能更紧密地与H核结合,从而形成一个中性偶极子(doublet,质子电子对)。这样一个粒子将具有很异常的特性。它的外部电场实际上将等于零,除非特别靠近它的核。因此,它能够很自由地通过物质。”卢瑟福还声称:“要解释重元素核的构成,这种粒子的存在看来是必不可少的。”为了检验卢瑟福的假说,卢瑟福的学生查德威克从1921年开始在卡文迪许实验室里一直在寻找这种电中性粒子。他试图设计一种加速方法使质子获得很高的能量,从而撞击原子核,以发现有关中性粒子的证据,但历经十年研究没有结果。
1930年,德国物理学家博特(W. Bothe, 1891~1957)和他的学生贝克尔(H. Becker)用α粒子轰击较轻的元素,特别是轰击铍时,发现从铍中发射出一种强度不大但穿透力极强的射线。这种射线在电场和磁场中都不发生偏转(因而不带电),被称作是铍辐射。根据当时已经发现的各种辐射的研究,α射线和β射线都没有这么强的穿透力,唯一能穿透铅板且在磁场中运动方向不发生偏转的只有γ射线。因此这两位物理学家错误地在实验记录上写下“发现高能γ量子”[16]。
1932年1月,巴黎居里实验室的约里奥居里夫妇(F.J. Curie, 19001958; I.J. Curie, 1897~1956)用强钋源重复了博特的实验。博特使用的探测器是盖革(H. Geiger)计数管,约里奥居里夫妇用了一个顶上有薄窗的电离室。在窗的上方可以放置各种材料做成的板以研究吸收。他们证实了这种射线的吸收数非常小(即穿透能力特別强)。另外,他们意外地观测到博特的γ射线能在石蜡、玻璃纸等含氢物质中能打出能量很高的质子(正是用了薄窗的缘故,才能观察到它们),接着用云室也证实了这一现象,还观察到可以打出其他原子核(氢核、氦核和氮核)的现象。他们夫妇在文章中把这一现象初步解释为类似于γ射线在电子上散射的康普顿效应。他们已经“在事实上发现”了中子。可惜的是,他们夫妇并没有意识到这一点,在理论上没有及时地跨出这一步[17]。
约里奥居里夫妇的实验对查德威克的研究工作有极大的启发。当查德威克从《通报》(Comptes Rendus)上看到约里奥居里夫妇的文章时,他直觉地意识到,那种不带电的铍辐射可能就是自己苦苦寻找的中性粒子。1932年,他自己尝试做了相类似的实验,因此确信所谓的“铍辐射”是一些运动急速而不带电荷的粒子流,粒子质量大约相当于一个质子。除了石蜡外,他还试着用其他的靶,包括氦、氮和锂,这有助于他确立新粒子的质量只比质子的质量多一点点。查德威克还注意到,因为中子未带电荷,所以它们可以穿透进靶内的程度远比质子深得多[18]。他称这种不带电荷的粒子为中子(neutron)。在做过仅仅两周的实验后,查德威克于1932年2月17日写信给《自然》(Nature)杂志,发表了他的论文“中子可能存在”,离约里奥居里的文章不到一个月。同年5月,在《英国皇家学会通报》上他又发表了题为“中子的存在”一文,详细报告了实验结果及理论分析。此发现很快地得到玻尔(Niels Bohr, 1885~1962)和海森堡(Werner Heisenberg, 1907~1976)的认同。查德威克还测量了中子的质量,并下结论说: 中子是一种核粒子,而不是卢瑟福预言的质子—电子对[19]。
查德威克发现中子的成果发表后,博特为自己发现了“铍辐射”却没有认识到它就是中子而深感遗憾;约里奥居里夫妇更是以此为戒。曾经师从约里奥居里夫妇的我国物理学家钱三强回忆说:“我清楚地记得,有一天在洗云室照片时,约里奥先生和我说起这段往事说‘真是笨死了!所有的证据已经摆在那里了,我们怎么会想不到这一点呢!,反质子的发现者之一薛格雷(Emilio Segre, 1905~1989)说得好‘在没有思想准备的时候,眼睛是认识不到的。[20]”
中子的發现揭示了同位素的微观本质: 质子数相同但中子数不同的原子互称同位素。这些原子有相同的电子结构,化学性质相同。
4 结语
从以上分析可知,同位素化学的发展史中有三个重要的里程碑: 一是索迪发现放射性元素位移规则,提出同位素假说;二是阿斯顿发明质谱仪,使同位素现象的普遍性得到证实;三是查德威克发现中子,揭示了同位素现象的微观本质。此后,同位素化学日益发展成熟,并不断涌现出造福人类的新成果。总之,同位素化学发展史不仅是一门学科的发展史,也是科学仪器的发明史、科学方法的创新史以及科学思想的演进史。
参考文献:
[1](英)道尔顿. 李家玉, 盛根玉译. 化学哲学新体系[M]. 北京: 北京大学出版社, 2006: 12.
[2][7][9][11]Nagel, Miriam C. Frederick Soddy: From alchemy to isotopes [J]. Journal of Chemical Education, 1982, 59(9): 739~740.
[3][13]白欣, 冯晓颖, 王晓义. 1922年诺贝尔化学奖获得者——阿斯顿[J]. 化学通报, 2011, 74(3): 284~289.
[4]F.G.. Brickwedde, 邢玉珍. 哈罗德·尤里和氘的发现[J]. 大学物理, 1985, (5): 33~38, 16.
[5][10]张清建. 索迪及其对放射化学的贡献[J]. 科教导刊(中旬刊), 2018, (12): 31~32.
[6][8][12]George B. Kauffman. Nobel Laureates in Chemistry — A Philatelic Survey: Part Ⅱ. 1911~1934 [J]. Journal of Chemical Education, 1990, 67(7): 569~574.
[14]袁振东, 朱敬. 在科学的入口处: 30位化学家的贡献[M]. 武汉: 湖北少儿出版社, 2007: 33~37.
[15]戴安邦. 无机化学中的新观念[J]. 化学, 1934, 1(1): 33~48.
[16]袁振东, 王晓瑾. 通过化学史上的典型案例培养学生的直觉思维[J]. 中学化学教学参考, 2012, (Z1): 51~54.
[17][20]钱三强. 中子的发现[J]. 深圳特区科技, 2000, (3): 18~19.
[18]萧如珀, 杨信男. 1932年5月查德威克描述中子的发现[J]. 现代物理知识, 2010, 22(3): 66~67.
[19]萧如珀, 杨信男. 1932年2月: 查德威克关于中子的研究投稿到《自然》期刊[J]. 现代物理知识, 2018, 30(1): 63~64.

