附睾精子抗氧化保护机制研究进展
许娇霞,张家新
(内蒙古农业大学动物科学学院,内蒙古自治区动物遗传育种与繁殖重点实验室,呼和浩特 010018)
精子在睾丸形成后功能还未成熟,在附睾转运过程中才逐渐获得受精能力和运动能力[1],因此,附睾是精子最后成熟的场所[2]。精子在附睾转运的同时,附睾将含有与精子成熟相关蛋白的附睾小体分泌到附睾液中并作用于精子。精子在经历一系列的表观修饰后,染色质、质膜都将发生重塑,使得精子逐渐成熟[3]。且附睾上皮分泌的附睾小体中含有多种抗氧化酶可传递给精子,保护其免受氧化损伤[4-5]。
1 附睾精子面临的氧化应激
精子氧化损伤主要表现为脂质过氧化增加和DNA损伤[7]。由图1可知,精子代谢异常时线粒体产生过量的ROS进入细胞核后,可将鸟苷氧化成8-羟基脱氧鸟苷(8-OHdG),从而引发DNA突变;而当细胞外ROS过量时脂质过氧化增加,其产物羟基壬烯醛(4-HNE)相应上升后对DNA的突变也具有诱导作用[8-11]。Wu等[2]为检测氧化应激对附睾精子的影响作用,对成年大鼠进行腹腔注射叔丁基过氧化氢(t-BHP)处理,并收集其第3、6和9周附睾尾部的精子,发现3个时期的精子都呈低运动性和高DNA氧化水平,而且t-BHP造成的氧化应激会对附睾的功能造成长期影响,在大鼠经t-BHP处理后第9周,其附睾的脂质过氧化依旧处于一个较高的水平,从而影响到精子成熟,导致精子质量较低。据报道,人的精子在受到氧化应激后,其功能和活力受损,进而对精子的受精过程造成影响,严重时则会导致男性不育[3-14]。而适量的ROS不仅可以保护精子免受氧化损伤,还对精子的获能具有促进作用[10-11],可见附睾中正常生理水平的ROS对雄性生殖能力至关重要。
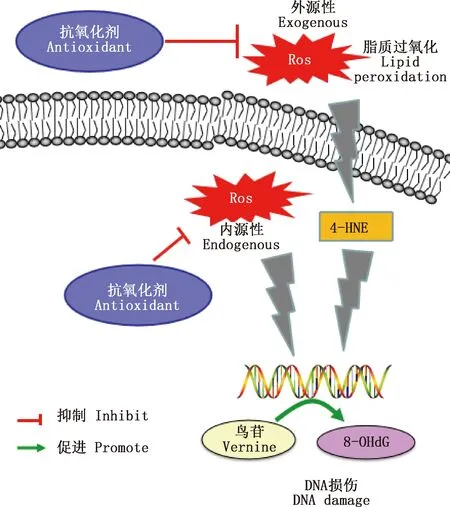
图1 精子中活性氧的作用通路图[10-11]Fig.1 Pathway diagram of reactive oxygen species in sperm[10-11]
随着精子在附睾内的运行与成熟,其代谢率、形态、运动模式都会发生改变,使附睾不同部位的精子产生了不同水平的ROS,而此时精子对于抗氧化剂的需求也会随之发生改变,以适应不同产量的ROS[15]。Rana等[16]报道,在山羊附睾不同节段的精子和附睾液中可以检测到多种抗氧化酶,附睾液中抗氧化酶的活性从附睾头到附睾尾逐渐增加,而精子中的趋势却与之相反,这说明山羊附睾液为精子提供的抗氧化环境对精子具有相应的补偿作用。因此,附睾中生理水平ROS的维持需要各种抗氧化酶的相互协调,从而起到保护精子使之正常成熟的作用[5]。
2 附睾中的抗氧化酶
在附睾中,将ROS维持在生理水平的抗氧化酶主要有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPXs)以及过氧化物酶(PRDXs)等,各种抗氧化酶清除的ROS类型以及产物见图2。以下将对抗氧化物酶在附睾中的作用进行阐述。
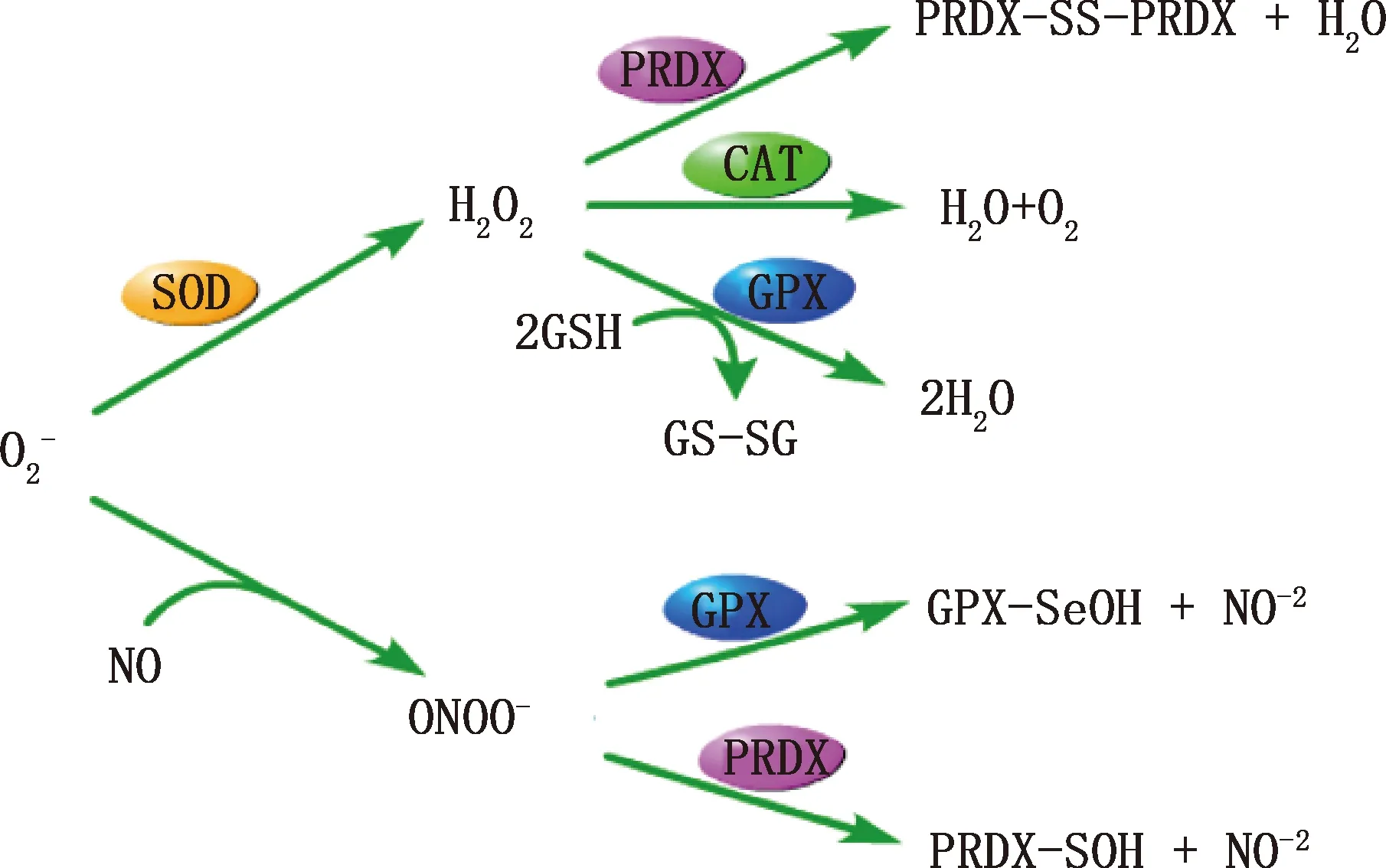
图2 重要抗氧化剂的作用通路[17]Fig.2 Pathway diagram of important antioxidants[17]
2.1 超氧化物歧化酶

有报道表明,SOD在维持精子活力以及功能方面具有重要作用,Aitken等[19]对高活力精子与异常精子SOD活性检测后发现,SOD活性与氧化损伤程度呈正相关,而且在大鼠附睾中SOD的活性还会随年龄的增长而降低[20]。另外,一些精子DNA完整性较差的患者可通过口服SOD抗氧化剂使其症状得以改善[21]。由此可见,SOD对精子DNA完整性具有重要的保护作用。
2.2 过氧化氢酶
CAT是一种含血红素的酶,通过使用铁(Fe)或锰(Mn)辅助因子,将H2O2转化为H2O和O2。在大多数真核细胞中,CAT在过氧化物酶体中的浓度最高,在线粒体和胞浆中浓度较低。Jemec等[22]认为,CAT在某种程度上起辅助GPXs的作用。通过对人红细胞使用放射性标记和氨基三唑抑制后发现,CAT可清除50%的H2O2,而GPXs和谷胱甘肽还原酶(GSH)则负责清除另一半[23]。
然而,CAT在兔[24]、小鼠[25]、牛[26]、水牛[27]、猪[28]的精子中并不存在,但在人[29]、大鼠[30]精子中有较低水平表达,Jean-françois等[26]和Kar等[27]还发现CAT在牛精液中含量很高。Kumar等[31]在山羊附睾不同部位的附睾液和精子中也未检测到CAT的活性。表明不同物种的精子与附睾中CAT的作用机制存在较大差异。此外,Wu等[12]通过使用t-BHP处理大鼠附睾以验证CAT对附睾中ROS的清除能力发现,大鼠附睾任何部位中的CAT表达水平均不会随t-BHP的处理而改变。说明CAT似乎并不是大鼠附睾中抵御氧化应激的关键酶。但对于其他动物是否也如此仍需进一步的研究。
2.3 谷胱甘肽过氧化物酶
GPXs可将脂质氢过氧化物(ROOH)还原为相应的醇,并将H2O2转化为H2O。到目前为止,在哺乳动物中已经报道了8种GPXs(GPX1-8)的基因亚型,这些基因在哺乳动物不同器官中广泛分布[32-33]。有报道表明,当给雄性大鼠服用谷胱甘肽合成酶抑制剂(BSO)后,附睾尾精子抗氧化能力下降,继而使染色质质量受损[34]。这些研究表明GPXs在精子成熟过程中的保护作用至关重要[2,5]。
在GPXs家族中,GPX1-4的活性依赖于硒,其中GPX4是一种重要的结构蛋白[35],在精子线粒体中含量非常丰富(约占精子中段蛋白的50%),而当其缺失时则会导致男性不育[36]。GPX4的核形式(nGPX4)有助于维持精子染色质的稳定性,但敲除nGPX4基因的雄性小鼠仍具备生育能力[37]。GPXs家族的另一成员GPX5,其活性不依赖于硒[32],由附睾上皮的主细胞分泌,与位于细胞质中GPX1、GPX3和GPX4的低表达量相反[38],GPX5在附睾头中高度表达,而且受雄激素的调控[39],可以保护精子DNA免受氧化损伤[33]。敲除GPX5的雄性成年小鼠(3个月~1岁),其精子的DNA氧化水平高于野生型对照,敲除GPX5后虽然具备生育能力并可以产生正常的后代,但随着这些雄性小鼠年龄的增长,其幼崽中流产、围产期死亡及具有不同程度发育缺陷的异常生殖现象都有所增加[32-33]。这表明附睾中GPX5对于精子的抗氧化保护作用具有重要意义。Vilagran等[40]发现,猪新鲜精液中的精子质量较低时,机体会通过升高精浆中GPX5的浓度发起补偿机制来保护精子,且精浆中GPX5的含量对人工授精母猪的产仔数有积极影响[41]。Williams等[42]发现,GPX5能够防止精子过早地发生顶体反应。作者所在研究团队在对绵羊附睾抗氧化功能的研究中发现,在绵羊正常生理条件下,不论是在附睾不同部位的组织、管腔液还是精子中,从附睾头至附睾尾,GPX5的表达量均呈下降趋势,但随着精子在附睾的转运,精子上GPX5的分布却越来越广泛,储存至附睾尾部的成熟精子在核后帽、颈部、线粒体鞘、以及精子尾部均有GPX5的分布(数据未发表)。此外,大鼠精子的免疫荧光结果显示,精浆中GPX5在附睾转运和射精过程中结合到精子头部[42]。总之,在哺乳动物各阶段,精子抵御氧化损伤时,GPXs都起着重要的核心作用[5,15,33]。
2.4 过氧化物酶
PRDXs是一个抗氧化酶家族,从酵母到人类都高度表达。其活性位点含有1或2个半胱氨酸(Cys)残基,在氧化还原过程中参与分子二硫键交联,这对它们的抗氧化功能至关重要[43]。根据活性位点上Cys残基的数量,PRDXs亚型分为2-Cys PRDXs (PRDX1-5)和1-Cys PRDX (PRDX6)[44],它们的过氧化物酶活性受其活性部位Cys残基的氧化状态调节。PRDXs在附睾头和附睾尾的主细胞、基细胞以及窄细胞中高表达,但在透明细胞中不表达[17]。这些酶是精子中重要的抗氧化剂,可以降低过氧化物(H2O2和有机氢过氧化物)和ONOO-等ROS的水平,以避免细胞受到氧化损伤[45-46]。当活性中心Cys被氧化(硫醇氧化)变得无活性时[44],如果ROS水平进一步增加,PRDXs就会被过度氧化,并形成含有PRDX-SO2的高分子复合物[47]。因此,PRDXs须还原Cys残基才能继续清除ROS。 其中,PRDX1-5的氧化形式可以通过硫氧还蛋白(TRX)/硫氧还蛋白还原酶(TRD)/NADPH系统恢复到其活性状态,PRDX1-5的过氧化形式则可以通过硫氧还原蛋白(SRX)或sestrins用ATP和GSH还原(图3A)。而在PRDX6被氧化为PRDX6-SOH的情况下,谷胱甘肽巯基转移酶(GSTpi)和GSH可以通过还原其活性位点的氧化硫醇来恢复其活性。然而,PRDX6的过氧化形式PRDX6-SO2却不能被再次还原,将永久失活不可逆[48](图3B)。
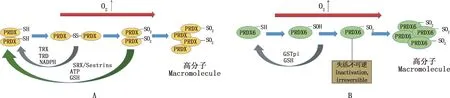
图3 PRDX1-5(A)和PRDX6(B)的活化机制[17]Fig.3 Activation mechanism of PRDX1-5 (A) and PRDX6(B)[17]
在PRDXs家族中,PRDX6是被研究较多的一个酶,它是一种具有过氧化物酶和钙非依赖性磷脂酶A2(iPLA2)活性的双重酶,可防止脂质过氧化和修复氧化膜[49]。基于PRDX6基因敲除动物模型的研究表明,在附睾中缺乏PRDX6的精子出现异常成熟的迹象[48],且与野生型对照相比,产仔数和窝产仔数均降低[50]。这样的低生育能力与缺乏PRDX6所导致的精子活力受损、DNA氧化、精蛋白水平降低以及DNA致密化有关[5,47],而且这种现象会随着年龄的增长而加剧[51]。Liu等[52]通过给大鼠腹腔注射t-BHP来模拟氧化应激,2周后收集附睾组织和精子发现,经处理后的精子PRDX1和PRDX6水平升高,由于精子不能合成蛋白质,因此推测精子中PRDXs含量增加是由附睾上皮分泌含有PRDXs的附睾小体转移到了精子上引起的。另外,有研究发现,附睾上皮在对抗氧化应激时,除了大量表达PRDX1和PRDX6外,同时还会通过直接分泌的方式进入附睾液中保护精子抵抗氧化应激[48]。这些研究表明附睾中PRDXs的抗氧化作用对于附睾成熟过程中的精子具有重要的保护作用。
3 小 结
精子在附睾转运过程中发生的一系列变化,增加了其对高水平ROS的敏感性,而当发生氧化应激时,则会导致精子脂质过氧化增加和DNA的损伤,因此附睾中各抗氧化酶家族对成熟过程中的精子具有重要意义。目前,附睾中各类抗氧化酶家族如何协同发挥作用以将ROS维持在生理水平并不清楚,这仍需进一步研究,以阐明附睾精子的抗氧化保护机制。

