类CT灌注成像监测奥沙利铂所致肝窦损伤
付雪林,周建忠,黄国中,黄小宁,邓 军
(南昌大学第二附属医院医学影像中心,江西 南昌 330006)
肝窦阻塞综合征(hepatic sinusoidal obstruction syndrome, HSOS)为一组窦性门静脉高压症候群,是肝血管型药物性肝损伤临床表现,与细胞毒性药物诱导的肝窦、肝小静脉内皮损伤有关。奥沙利铂(oxaliplatin, OXA)为第三代铂类化学治疗(简称化疗)药物,是用于结直肠癌化疗的一线药物,可显著提高患者无病生存期和总生存率[1],也是胃癌化疗常规用药[2],但会诱导肝窦内皮细胞损伤而发生HSOS,降低肝脏储备功能及肿瘤化疗效果,严重时可致多器官功能衰竭甚至危及生命。早期OXA相关HSOS常无明显临床症状,缺乏敏感、特异的诊断指标。肝脏类CT灌注成像(CT perfusion imaging, CTPI)是通过软件后处理常规多期增强CT图像而获取肝脏血流灌注信息的技术,可量化药物性HSOS所致肝窦血流阻塞情况,为防治HSOS提供依据。本研究评价类CTPI监测OXA所致肝窦损伤的价值。
1 资料与方法
1.1 研究对象 回顾性分析2017年7月—2020年9月128例于南昌大学第二附属医院接受OXA化疗的胃癌或结直肠癌患者,男69例,女59例;年龄22~77岁,平均(51.7±11.5)岁;79例化疗方案为XELOX(OXA+卡培他滨),33例为FOLFOX方案(OXA+5-氟尿嘧啶+亚叶酸钙),16例为SOX方案(OXA+替吉奥)。纳入标准:①术前或术后接受OXA连续化疗6个周期或以上;②分别于化疗前、化疗中期(第2~4个周期)及化疗末期(第6~8个周期)各接受至少1次上腹部增强CT检查,且图像质量佳。排除标准:①其他基础性肝脏疾病;②存在较大肝转移癌(肝转移灶>10个或最大转移灶直径>5 cm);③合并其他恶性肿瘤。检查前患者均签署知情同意书。
1.2 仪器与方法 采用Siemens Somatom Definition Flash双源CT。嘱患者仰卧,行上腹部CT平扫,范围自膈顶至肝脏下缘,扫描参数:管电压120 kV,参考管电流210 mAs,FOV 35 cm×35 cm×40 cm,矩阵512×512,开启实时动态曝光剂量调节技术CARE Dose 4D,探测器24×1.2 mm、层厚1.25 mm、螺距0.9∶1,球管旋转时间0.5 s/rot。之后采用Ulrich Missouri双通路数控高压注射器经肘静脉以3.5 ml/s流率注射80 ml碘佛醇(350 mgI/ml),跟注20 ml生理盐水,分别于开始注射对比剂后30、65及130 s行动脉期、门静脉期及延迟期扫描。
1.3 图像处理 将图像上传至Syngo MMWP VE40C工作站,由2名具有3年以上工作经验的放射科医师逐层勾画脾脏边界,测量脾脏体积。采用3D Slicer软件配准平扫及增强扫描图像,将配准后的图像导入第三方后处理软件CT Kinetics,于腹主动脉(腹腔干开口层面)及门静脉主干层面勾画ROI,以模拟肝脏双重血流灌注;分别于肝脏上、中、下层面尽量避开肝脏小血管及边缘放置4个60~80 mm2ROI(肝右叶2个,肝左内叶1个,肝左外叶1个);选择“liver dual input”模型,计算肝脏类CTPI参数,获得门静脉灌注量(portal venous perfusion, PVP)和动脉增强分数(arterial enhancement fraction, AEF),以12个ROI的平均测值为全肝PVP、AEF。以上参数每名医师测量1次,取平均值作为结果。
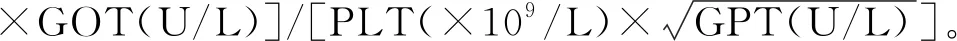
1.5 统计学分析 采用SPSS 25.0统计分析软件。以±s表示符合正态分布的计量资料,采用单因素方差分析比较各时间点相应参数的差异,行LSD法检验进行组间两两比较;以中位数(上下四分位数)表示不符合正态分布的计量资料,采用Friedman秩和检验比较各时间点相应参数的差异,并进行两两比较。以Spearman相关性分析评价类CTPI参数与临床指标的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 肝脏类CTPI参数及脾脏体积 相比化疗前,化疗后各期PVP均明显降低(P均<0.05),而AEF无明显变化(P均>0.05),见表1及图1;化疗后各期脾脏体积均明显增大(P均<0.05),化疗末期脾脏体积较化疗中期明显增大(P<0.05),此时68例(68/128,53.13%)脾脏体积增大超过30%,最大者增大240%。
2.2 临床资料 GOT、GPT、GOT/PLT比值及FIB-4均随化疗周期增加而升高(χ2=220.52、77.50、232.69、207.60,P均<0.05),增高幅度于前3个周期较大;至化疗末期61例(61/128,47.66%)GOT/PLT比值>0.79,57例(57/128,44.53%)FIB-4>3.25。化疗前PLT为211.50(177.25,268.50)×109/L,化疗末期降至138.00(105.00,165.50)×109/L(χ2=250.65,P<0.05)。见图2。
2.3 相关性分析 OXA化疗前后PVP变化与同期肝纤维化指数GOT/PLT比值、FIB-4及脾脏体积均呈负相关(r=-0.18、-0.28、-0.34,P均<0.05)。
3 讨论
3.1 OXA所致肝窦损伤 RUBBIA-BRANDT等[5]于2007年报道了OXA相关肝窦损伤,并提议将其归为OXA相关毒副作用。肝窦内皮细胞损伤导致PLT活化、微血栓形成,PLT外渗进入窦周间隙,这可能是发生HSOS后PLT降低的主要原因。SOUBRANE等[6]发现低PLT与重度HSOS病变相关,PLT外渗、聚集主要见于中央静脉周围。HSOS病变早期,肝窦内皮细胞损伤、脱落,PLT微血栓形成,阻塞肝窦流出道;随后血细胞及细胞碎片通过受损内皮进入窦周间隙,使内皮分离、炎性细胞浸润,窦腔受压、变窄;同时,肝窦内皮细胞受损导致肝星状细胞异常活化,细胞外基质分泌增多,引发窦周纤维化。上述多种病理生理学改变引起肝窦流出道阻力增高,窦性门静脉高压,最终导致肝纤维化及肝硬化[7-8]。

图1 患者男,56岁,结肠癌术后 A、B.化疗前肝脏CT PVP(A)及AEF(B)伪彩图; C、D.7个周期XELOX化疗后肝脏PVP(C)及AEF(D)伪彩图
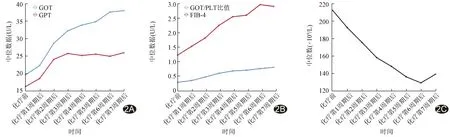
图2 128例胃癌或结直肠癌患者接受OXA化疗前、后各参数变化(第7周期n=107) A.GOT、GPT; B.GOT/PLT比值、FIB-4; C.PLT
HSOS常见临床表现包括不明原因体质量增加、肝区疼痛,肝功能障碍及腹腔积液等,而早期OXA所致肝窦损伤常无明显症状[9]。本组患者化疗后GOT、GPT呈逐渐增高趋势,但至化疗第7个周期末多数GOT、GPT仍位于正常范围或仅轻度增高,原因可能在于HSOS早期主要导致肝窦内皮细胞受损;至化疗后期,肝窦内皮细胞受损及窦汇区炎性反应加重,影响邻近肝细胞物质交换,引起肝细胞代谢功能障碍和缺血损伤[9]。此外,发生HSOS还与化疗患者肝转移癌切除术后并发症增多、住院时间延长、肝功能障碍及总生存期缩短等不良结果有关[10-11]。
3.2 类CTPI参数与OXA肝窦损害 BETHKE等[12]测量化疗前、后肝实质增强CT值,发现门静脉期肝脏CT值由动脉期的(105.6±17.3)HU降至(93.3±18.2)HU,认为可能与化疗药物毒性作用有关。SHIN等[13]采用双能量CTPI观察早期HSOS兔模型,发现在肝脏出现形态学改变及实质不均匀强化前,其CT值及碘浓度逐渐增加,考虑与肝窦淤血、扩张,碘淤积于肝窦内有关;而门静脉期不均匀强化则是肝窦内充满脱落的细胞碎片导致血液流动延迟的结果。HONG等[14]采用体素内不相干运动弥散加权成像评估HSOS动物模型,发现代表灌注参数的f值在HSOS组小于正常组,且与HSOS严重程度呈负相关。本组患者接受OXA化疗后肝脏类CTPI参数PVP明显低于治疗前,而AEF化疗前后变化不明显,可能与肝窦阻塞、窦周纤维化导致血液流动受阻有关。
3.3 肝纤维化指数、脾脏体积与类CTPI参数 GOT/PLT比值和FIB-4是监测慢性病毒性肝炎患者肝纤维化及肝硬化的实验室指标,GOT/PLT比值>0.79或FIB-4>3.25高度提示中或重度肝纤维化[3,15]。PEREYRA等[16]认为GOT/PLT比值预测肝功能障碍的价值极高,能动态反映化疗相关肝损害,可作为选择手术治疗新辅助放化疗后结直肠癌肝转移时机的指标。本组患者OXA化疗后GOT/PLT比值、FIB-4均较化疗前明显升高,47.66%(61/128)化疗末期GOT/PLT比值>0.79,44.53%(57/128)FIB-4>3.25,且与同期肝脏PVP改变呈负相关。
CAYET等[8]发现肿瘤患者接受OXA化疗期间脾脏体积较化疗前增大,体积增大超过30%与发生HSOS密切相关,并可作为预测HSOS的独立危险因素。术前化疗所致脾脏增大是预测术后肝脏再生能力受损的重要指标,且与术后发生肝衰竭相关[17]。本组患者化疗末期脾脏体积明显增大,53.13%(68/128)脾脏体积增大超过30%,且与同期肝脏PVP改变呈负相关,可能与窦性门脉高压所致脾脏淤血有关。
本研究的主要不足:①样本量有限;②采用了3种包括OXA的化疗方案,而既往关于卡培他滨、5-氟尿嘧啶等药物损害的报道[18-20]未涉及肝窦损害; ③对少数患者于化疗期间使用了保肝类药物,可能对结果造成一定影响;④缺乏长期随访资料。关于OXA所致肝窦远期损害有待进一步观察。
综上所述,肝脏类CTPI肝脏血流类灌注参数PVP是量化评价胃癌或结直肠癌患者接受OXA化疗后门静脉血流变化的指标;PVP降低与反映肝窦损害的实验室指标、脾脏体积变化相关,可作为评估药物性肝窦损害的敏感指标。

