超高压处理引发乳糖酶活力变化与荧光强度变化的关系
胡志和,程凯丽,鲁丁强,薛 璐,贾凌云,赵旭飞
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
牛奶是非常优质的食品资源,但由于部分人群受到乳糖不耐受问题的困扰,严重影响了这一优质食品资源的利用[1]。特别是在我国,乳糖酶缺乏现象尤为严重[2-3],不仅影响了我国居民对牛奶的消费量,还会导致老年人和婴幼儿因缺乏摄入牛奶而引发的健康问题[4]。因此,开发低乳糖或无乳糖乳制品对于满足居民的消费需求尤为重要。
目前,制备低乳糖或无乳糖乳制品的方法包括膜分离法[5-6]、酶法[7-10]、微生物发酵法[11]和基因工程法[12]等,其中,乳糖酶水解法是主要的制备方法。在利用乳糖酶水解乳糖制备低乳糖牛奶的过程中,为了防止牛奶品质发生变化,一般采用低温长时间的水解方式。该方法存在生产效率低和生产设备占用时间长等问题,进而造成生产成本偏高。为解决该问题,本课题组采用高压下乳糖酶水解乳糖生产低乳糖牛奶。该方法的优点是利用高压抑制牛奶中微生物生长,提高乳糖酶活性,可在较高温度下水解乳糖,提高乳糖水解效率,同时能够保证牛奶的品质。
乳糖酶广泛存在于动植物和微生物中,但商品化的乳糖酶多是采用微生物发酵生产[13-14]。源于微生物的乳糖酶,研究较多的是米曲霉和克鲁维酵母源乳糖酶[15-16]。目前针对乳糖酶的研究更多的是关注其酶学特性和稳定性[17-20],而对其结构变化与活性的关系研究较少,特别是在超高压处理过程中,乳糖酶活力是如何变化的,其变化与乳糖酶分子结构之间的关系如何,目前还鲜有研究。
乳糖酶中芳香族氨基酸残基(如色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)等)处于不对称微环境时,在紫外光谱区可产生光学信号。通过荧光强度分析能够反映Trp、Tyr和Phe等所处微环境的变化,从而研究蛋白质三级结构的精细变化,了解蛋白质的化学组成、蛋白质分子构象及其与小分子的相互作用等信息[21-22]。
本实验通过研究高压处理引发乳糖酶活力和荧光强度变化,进而推断乳糖酶活力与三级结构之间的关系,为高压处理乳糖酶水解乳糖制备低乳糖牛奶提供理论参考。
1 材料与方法
1.1 材料与试剂
中性乳糖酶(酶活力5 998.87 U/g) 天津海河乳业有限公司提供;邻硝基苯-β-D-半乳糖苷(O-nitrophenyl-β-D-galactoside,ONPG)、二水乙二胺四乙酸钠 北京Biotopped科学技术有限公司;邻硝基苯酚 山东西亚化学工业有限公司;氢氧化钠(NaOH) 天津市华东试剂厂;磷酸二氢钾(KH2PO4)、碳酸钠 天津市赢达稀贵化学试剂厂;三水磷酸氢二钾(K2HPO4·3H2O) 天津市化学试剂六厂;七水硫酸镁(MgSO4·7H2O)北京五七六零一化工厂;8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 美国Sigma公司。
1.2 仪器与设备
HPP.L2-800/2.5超高压设备 天津市华泰森淼生物工程技术有限公司;DC-2030节能型智能恒温槽 宁波新芝生物科技股份有限公司;U-5100紫外-可见分光光度计北京普析通用仪器有限责任公司;F-4600荧光光度计日本日立高新技术公司;VELP漩涡振荡器 北京德祥科技有限公司;DK-420型电热恒温水槽 上海精宏实验设备有限公司;FE20型pH计 梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 超高压处理乳糖酶
采用外接DC-2030节能型智能恒温槽的HPP.L2-800/2.5超高压设备处理样品。取5 g乳糖酶液装入聚乙烯密封袋中真空密封,将压力300 MPa、温度30 ℃、保压时间10 min作为相对固定的条件,研究不同压力(0.1、100、200、300、400、500、600 MPa)和温度(室温(18 ℃)、20、25、30、35、40、45 ℃)下处理不同时间(10、20、30、40、50、60 min)对乳糖酶活力的影响,各条件(压力、温度、时间)的对照组分别为0.1 MPa、室温(18 ℃)、0 min。
1.3.2 乳糖酶活力检测
参照赵华梅等[23]的实验,采用ONPG法测定乳糖酶活力。
1.3.3 乳糖酶的内源性荧光光谱扫描
将不同超高压条件下处理的乳糖酶溶液用pH 7.0的磷酸盐缓冲液(phosphate buffered saline,PBS)稀释至0.1 mg/mL。取3 mL样品,用F-4600荧光光度计进行内源性荧光测定。以激发波长280 nm,扫描发射波长300~400 nm的光谱,狭缝宽度为2 nm。
1.3.4 乳糖酶的外源性荧光光谱扫描
将不同超高压条件下处理的乳糖酶溶液用pH 7.0的PBS稀释至0.1 mg/mL。分别取4 mL,加入20 μL的ANS荧光探针溶液(5.0 mmol/L)。混合均匀室温下避光反应1 h后,采用F-4600荧光光度计进行荧光光谱扫描。选择激发波长284 nm,扫描发射波长290~420 nm的光谱,狭缝宽度为2 nm。
1.4 数据处理与分析
采用Origin 95C软件作图,采用SPSS 16软件通过皮尔逊双尾分析法对处理后样品的酶活力与荧光强度之间的相关性进行分析。
2 结果与分析
2.1 超高压处理对乳糖酶活性的影响
2.1.1 不同压力对乳糖酶活性的影响
真空密封后的乳糖酶溶液,在30 ℃和不同压力(0.1~600 MPa)下处理10 min后,乳糖酶活力变化如图1所示。在0.1~400 MPa压力范围内,酶活力呈上升趋势,并且在400 MPa时酶活力达到最大值,为6 783.20 U/g,相比于对照组(0.1 MPa组,酶活力5 986.87 U/g)酶活力提高了13.30%。压力在400~600 MPa范围内,酶活力随压力的提高呈现下降趋势;500 MPa和600 MPa时,酶活力分别为4 299.03 U/g和3 498.88 U/g,比对照组分别降低28.19%和41.56%。因此,温度30 ℃、保压时间10 min条件下,在实验压力范围内,乳糖酶较适宜的处理压力条件为400 MPa。
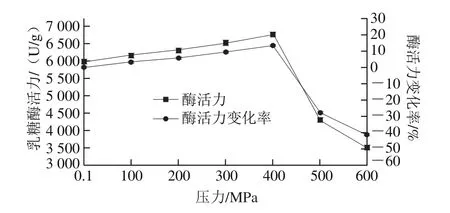
图1 30 ℃不同压力下超高压处理10 min对乳糖酶活力的影响Fig.1 Effect of ultrahigh pressure treatment at different pressures and 30 ℃ for 10 min on lactase activity
酶是蛋白质,通常具有多级结构,分子结构的变化与活性的关系密切相关。超高压处理是一种高强度动力作用,会改变酶分子的高级结构并影响其活性[24-26]。高压处理对蛋白质三、四级结构的非共价键产生作用。在压力的影响下,酶分子的空间结构以及酶活性部位的构象也发生改变,进而影响酶活力[27-28]。
2.1.2 不同处理时间对乳糖酶活性的影响
真空密封后的乳糖酶溶液,在温度30 ℃和压力300 MPa下分别处理10、20、30、40、50、60 min后乳糖酶活力变化如图2所示。在20 min内乳糖酶活力呈上升趋势,并且在20 min时酶活力达到最大值,为6 888.32 U/g,相比于对照组(0 min处理组,酶活力5 998.87 U/g)提高了14.83%。处理时间在20~60 min,酶活力随处理时间的延长呈下降趋势;但在30 min时,酶活力依然高于对照组;当时间继续延长,在40 min以后,酶活力低于对照组;40 min和50 min时,酶活力相差不大,分别为5 912.69 U/g和5 885.94 U/g,比对照组分别降低1.44%和1.83%。而处理时间延长至60 min时,酶活力急剧下降,为5 213.18 U/g,比对照组降低13.10%。该变化可能是由于高压造成乳糖酶分子结构变化而引发[25]。
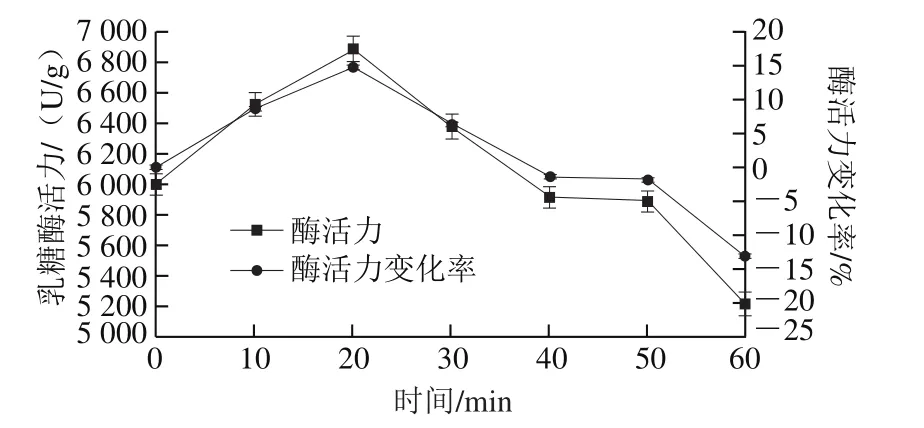
图2 300 MPa 30℃超高压处理不同时间对乳糖酶活力的影响Fig.2 Effect of ultrahigh pressure treatment time at 300 MPa and 30 ℃ on lactase activity
2.1.3 不同温度对乳糖酶活性的影响
真空密封后的乳糖酶溶液在压力300 MPa、不同温度(18、20、25、30、35、40、45 ℃)下处理时间10 min乳糖酶活力变化如图3所示。在18~30 ℃范围内,乳糖酶活力呈上升趋势,并且在30 ℃时酶活力达到最大值,为6 540.6 U/g,与对照组(室温组,酶活力6 086.56 U/g)相比提高了7.46%。30~35 ℃的温度范围内酶活力呈现下降趋势,但仍高于对照组。当温度提高至40~45 ℃时,酶活力继续呈现下降趋势,且酶活力低于对照组。因此,300 MPa处理10 min条件下,乳糖酶适宜的处理温度条件为30 ℃。综上,在一定压力下,温度变化可能引发酶结构的变化,进而引发酶活力的变化[29]。
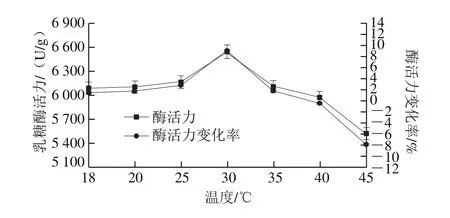
图3 300 MPa不同温度下超高压处理10 min对乳糖酶活力的影响Fig.3 Effect of ultrahigh pressure treatment at 300 MPa and different temperatures for 10 min on lactase activity
根据上述研究可知,在超高压处理过程中,压力、处理时间和处理温度均会引发乳糖酶活性的变化。在相关研究中,Masson等[30]通过研究指出,酶的活性可通过压力调节。Rivalain等[31]研究发现某些酶随着压力的增加会丧失活性。Trovaslet等[32]研究发现,在压力为100~400 MPa之间,马肝醇脱氢酶的催化活性急剧降低,该现象与其荧光特性和二级结构变化有关。Aertsen等[29]的研究结果显示,α-糜蛋白酶在470 MPa下的酶活力是常压下的6 倍;在360 MPa、50 ℃下处理30 min,α-糜蛋白酶活力显著增加。
2.2 超高压处理对乳糖酶内源性荧光光谱的影响
在蛋白质分子中能发射荧光的氨基酸有色氨酸-酪氨酸-苯丙氨酸,通常在发射波长为280 nm和295 nm处能检测到荧光光谱[33]。295 nm激发波长处仅有疏水性色氨酸残基被激发。280 nm激发波长处内源荧光主要来自疏水性色氨酸、苯丙氨酸和酪氨酸等残基[34]。有时蛋白质分子中从酪氨酸残基到色氨酸残基之间发生了能量转移,也会导致酪氨酸残基的荧光猝灭和色氨酸残基的荧光强度增加[35-36]。为了分析内源性荧光强度与乳糖酶活力变化的关系,选择280 nm作为激发波长,观察不同高压条件处理后乳糖酶内源性荧光强度的变化。同时,将内源性荧光强度的变化与酶活力的变化趋势进行拟合分析。
2.2.1 处理压力对乳糖酶内源性荧光强度的影响
在30 ℃、不同压力(0.1~600 MPa)下处理10 min,检测不同压力条件下乳糖酶内源性荧光光谱。由图4可知,在0.1~400 MPa范围内乳糖酶的最大发射波长处荧光强度随压力的升高而增加,400 MPa时最大发射波长为338 nm,荧光强度为4 223.33,比对照组(0.1 MPa)增加了7.45%;当压力大于400 MPa,随着压力继续增大,乳糖酶的最大发射波长处荧光强度逐步减小。另外,在0.1~200 MPa范围内,最大发射波长从335 nm蓝移至333 nm;300~600 MPa,最大发射波长从336 nm红移至338 nm。综上,在30 ℃不同压力下处理10 min,乳糖酶的内源性荧光强度随处理压力的不同而发生变化,且最大发射波长出现红移或蓝移现象,但红移或蓝移幅度较小。根据Burstein等[37]提出的色氨酸残基微环境基本特点可以推测,在该波长范围内发生红移或蓝移,主要是埋藏在非极性区域内的色氨酸等疏水性氨基酸暴露的结果。
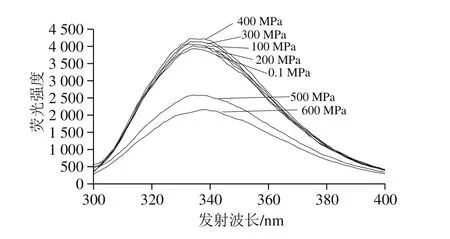
图4 30 ℃不同压力下超高压处理10 min乳糖酶在280 nm波长处激发的内源性荧光光谱Fig.4 Intrinsic fluorescence spectra of lactase treated by different pressures at 30 ℃ for 10 min at excitement wavelength of 280 nm
如图5所示,将该条件下处理乳糖酶的荧光强度与酶活力变化进行趋势拟合,二者的变化趋势基本一致,说明在该条件下处理的乳糖酶活力变化可能与其酪氨酸、色氨酸及苯丙氨酸的暴露程度有关。
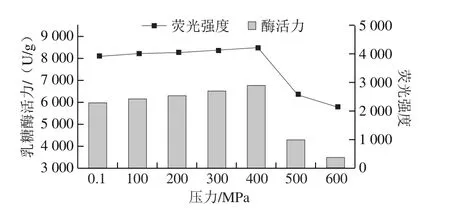
图5 30 ℃不同压力下超高压处理10 min乳糖酶的内源性荧光强度与酶活力的关系Fig.5 Relationship between intrinsic fluorescence intensity and activity of lactase treated at 30 ℃ and different pressures for 10 min
2.2.2 处理时间对乳糖酶内源性荧光强度的影响
真空密封后的乳糖酶溶液在30 ℃、300 MPa条件下分别处理0、10、20、30、40、50、60 min,测其荧光强度。由图6可知,在0~20 min内,随处理时间的延长,最大发射波长处荧光强度逐渐提高;在处理20 min时,荧光强度最大,为4 338。20 min后随处理时间的延长,最大发射波长处荧光强度逐渐降低。在处理30~50 min范围内,乳糖酶的最大发射波长处荧光强度与未处理组(0 min处理组)的无明显差异。另外,不同时间下,最大发射波长(335 nm)基本不变。
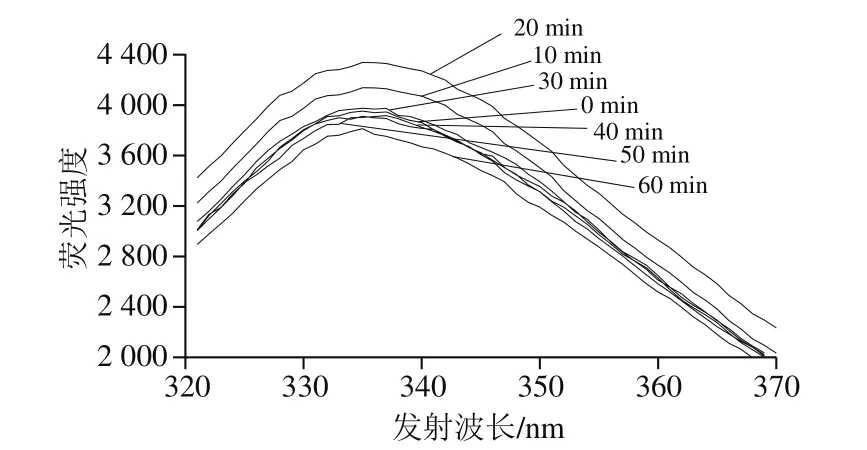
图6 30 ℃、300 MPa下超高压处理不同时间的乳糖酶在280 nm波长处激发的内源性荧光光谱Fig.6 Extrinsic fluorescence spectra of lactase treated at 30 ℃ and 300 MPa for different durations at excitement wavelength of 280 nm
在该条件下处理的乳糖酶,荧光强度变化和酶活力变化趋势并非完全一致(图7),特别是在40~60 min的时间范围内。出现该现象的原因,可能是在一定压力下处理不同时间,引发乳糖酶分子结构的变化,导致乳糖酶分子中酪氨酸、色氨酸及苯丙氨酸不同程度的暴露。
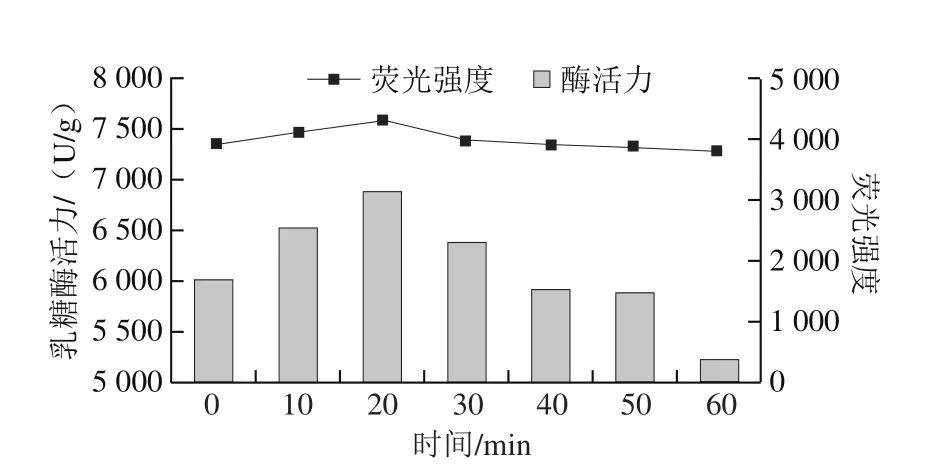
图7 30 ℃、300 MPa下超高压处理不同时间的乳糖酶内源性荧光强度与酶活力的关系Fig.7 Relationship between intrinsic fluorescence intensity and activity of lactase treated at 30 ℃ and 300 MPa for different durations
2.2.3 处理温度对乳糖酶内源性荧光强度的影响
将真空密封后的乳糖酶溶液在300 MPa和不同温度(18(室温)、20、25、30、35、40 ℃)下处理10 min,检测其内源性荧光强度的变化。由图8可知,当温度低于30 ℃时,随温度升高,最大发射波长处荧光强度逐渐增大,30 ℃时达到最大,为4 158,且最大发射波长为335 nm;在此温度范围内,随温度升高,最大发射波长从334 nm红移至336 nm。30~45 ℃范围内,随温度升高,最大发射波长处荧光强度逐渐下降,且最大发射波长在334~335 nm范围内。另外,25 ℃和35 ℃条件下处理乳糖酶的荧光强度无明显差异。综上,在实验设计的温度范围内,随温度变化,内源性荧光强度发生改变;根据发射波长移动变化分析,可能是非极性区域的色氨酸暴露所致[37-38]。由图9可知,最大发射波长处荧光强度与乳糖酶活力之间变化趋势较为一致。
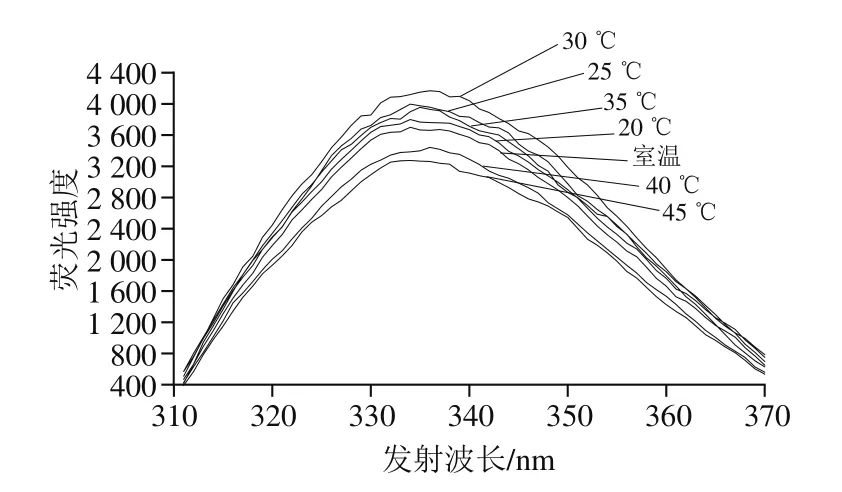
图8 300 MPa不同温度下超高压处理10 min的乳糖酶在280 nm波长处激发的内源性荧光光谱Fig.8 Intrinsic fluorescence spectra of lactase treated at different temperatures and 300 MPa for 10 min at excitement wavelength of 280 nm
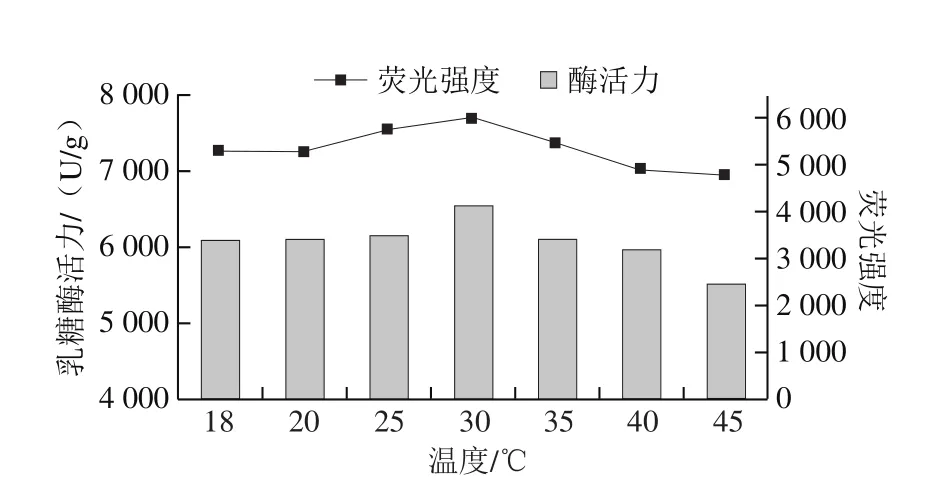
图9 300 MPa不同温度下超高压处理10 min乳糖酶内源性荧光强度与酶活力的关系Fig.9 Relationship between intrinsic fluorescence intensity and activity of lactase treated at 300 MPa and different temperatures for 10 min
2.3 超高压处理对乳糖酶的外源性荧光光谱影响
蛋白质高级结构的特征是疏水性与亲水性之间的平衡,蛋白质高级结构的稳定在很大程度上依赖于分子内的疏水作用。疏水基团的相互作用是维持蛋白质三级结构最重要的作用力之一,疏水性荧光探针ANS与蛋白质表面疏水性基团结合产生荧光的强度与蛋白表面暴露的疏水性氨基酸的数量相关[27]。因此,能够通过疏水性荧光探针ANS测定不同高压条件处理乳糖酶的疏水性,表征处理后乳糖酶三级结构的变化。同时,与相同处理条件下乳糖酶活力变化进行比较,揭示二者的关系。
2.3.1 处理压力对乳糖酶荧光强度的影响
在30 ℃不同压力(0.1~600 MPa)下处理10 min,检测乳糖酶分子表面疏水性氨基酸的荧光强度变化。由图10可知,与对照组(0.1 MPa处理组)相比,在100~400 MPa范围内,随压力升高,其最大波长处荧光强度呈上升趋势,400 MPa达到最高,与对照组相比差异明显,但与100、200 MPa和300 MPa下处理乳糖酶的荧光强度无明显差异。在400~600 MPa范围内,乳糖酶分子的荧光强度随压力升高而下降,且500 MPa和600 MPa时与0.1 MPa相比具有明显差异。上述结果可能是高压处理的过程中疏水氨基酸发生部分暴露和掩埋所致[32,36]。综上,高压处理对乳糖酶分子的三级结构有影响,且随着压力的变化而变化。由图11可知,在实验条件下处理后乳糖酶分子的荧光强度与酶活力的变化趋势具有很好的一致性。
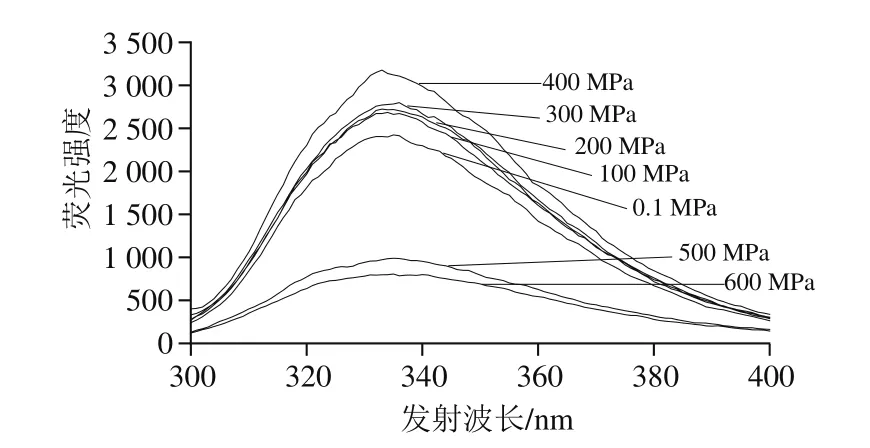
图10 30 ℃不同压力下超高压处理10 min的乳糖酶在284 nm波长处激发的外源性荧光光谱Fig.10 Extrinsic fluorescence spectra of lactase treated at 30 ℃ and different pressures for 10 min at excitement wavelength of 284 nm
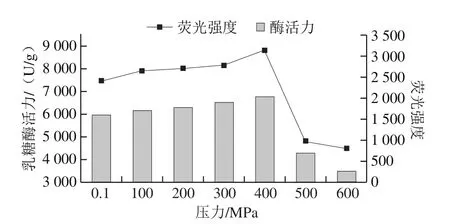
图11 30 ℃不同压力下超高压处理10 min乳糖酶外源性荧光强度与酶活力的关系Fig.11 Relationship between extrinsic fluorescence intensity and activity of lactase treated at 30 ℃ and different pressures for 10 min
2.3.2 处理时间对乳糖酶荧光强度的影响
将真空密封的乳糖酶溶液,在30 ℃、300 MPa条件下分别处理0、10、20、30、40、50、60 min,检测乳糖酶分子外源性荧光强度的变化。由图12可知,处理0~20 min,随时间延长,最大波长处荧光强度呈增加趋势,在20 min时最高,为2 856,且发射波长从336 nm蓝移至334 nm。当处理时间在20~60 min范围时,随着处理时间的延长,最大波长处荧光强度开始下降;当处理时间长于30 min时,随着处理时间的延长,荧光强度小于对照组(0 min处理组),但最大发射波长基本不变(333 nm)。综上可知,在一定压力和温度下,处理不同时间对乳糖酶的三级结构会产生影响。由图13可见,乳糖酶分子的荧光强度与其活力之间的变化趋势较为一致。
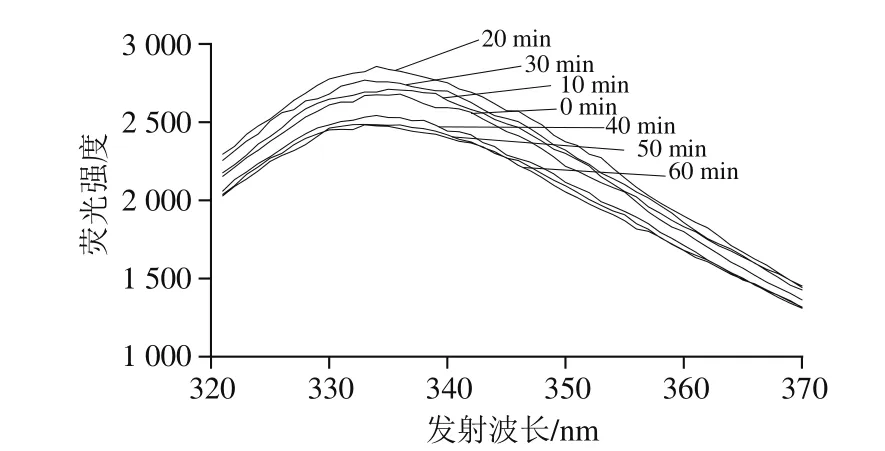
图12 300 MPa、30 ℃下处理不同时间的乳糖酶在284 nm波长处激发的外源性荧光光谱Fig.12 Extrinsic fluorescence spectra of lactase treated at 300 MPa and 30 ℃ for different durations at excitement wavelength of 284 nm
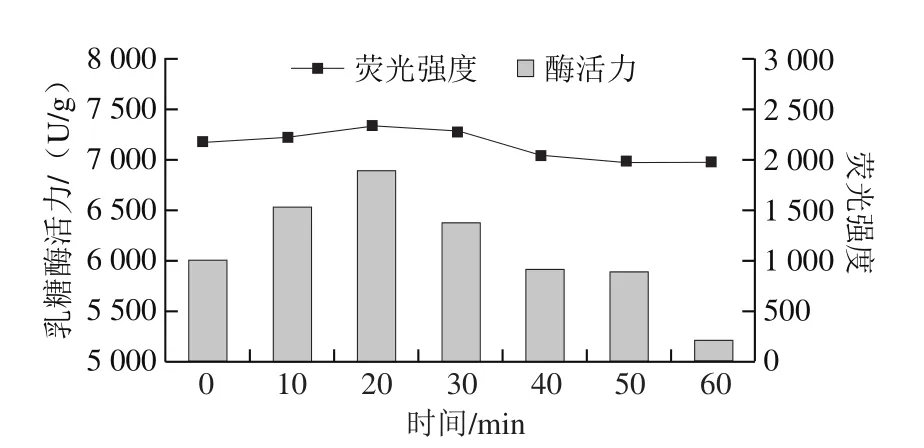
图13 300 MPa、30 ℃下超高压处理不同时间乳糖酶外源性荧光强度与酶活力的关系Fig.13 Relationship between extrinsic fluorescence intensity and activity of lactase treated at 300 MPa and 30 ℃ for different durations
2.3.3 处理温度对乳糖酶荧光强度的影响
将真空密封的乳糖酶溶液,在300 MPa和不同温度(18(室温)、20、25、30、35、40、45 ℃)条件下处理10 min,检测乳糖酶分子外源性荧光强度的变化。由图14可知,在18~30 ℃范围内,最大波长处荧光强度随着温度提高而增强,30 ℃达到最大。当温度高于30 ℃时最大波长处荧光强度呈下降趋势。此外,在300 MPa下处理10 min,室温、20 ℃和40 ℃处理乳糖酶的外源性荧光强度差异较小,其原因还需要进一步研究。但总体来看,处理温度对乳糖酶的三级结构有影响。由图15可知,实验条件下处理的乳糖酶活力与其外源性荧光强度变化趋势较为一致。
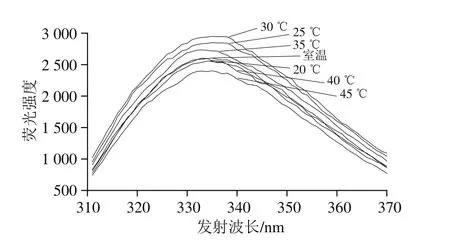
图14 300 MPa不同温度下超高压处理10 min的乳糖酶在284 nm波长处激发的外源性荧光光谱Fig.14 Fluorescence spectra of lactase treated at 300 MPa and different temperatures at excitement wavelength of 284 nm
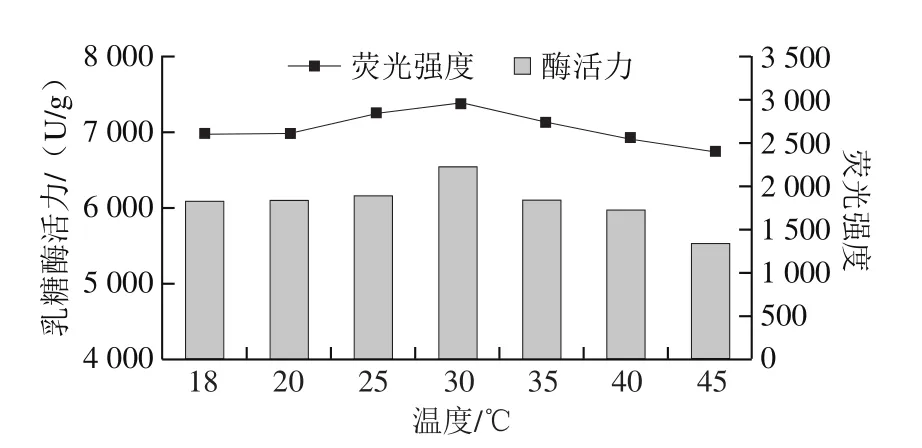
图15 300 MPa不同温度下超高压处理10 min乳糖酶的外源性荧光强度与酶活力的关系Fig.15 Relationship between extrinsic fluorescence intensity and activity of lactase treated at 300 MPa and different temperatures for 10 min
2.4 超高压处理引发乳糖酶活力变化与荧光强度之间相关性分析结果
由表1可知,在30 ℃不同压力下处理10 min引发的乳糖酶活力变化与乳糖酶分子内源性荧光强度和外源性荧光强度之间存在极显著相关性(P<0.01)。在300 MPa、30 ℃下处理不同时间引发的乳糖酶活力变化与其内源性和外源性荧光强度之间存在极显著相关性(P<0.01)(表2)。在300 MPa不同温度下处理10 min引发的乳糖酶活力变化与乳糖酶分子内源性和外源性荧光强度之间存在极显著相关性(P<0.01)(表3)。此外,不同压力条件下引发的内源性和外源性荧光强度之间存在显著或极显著相关性(P<0.05,P<0.01)。

表1 30 ℃不同压力下超高压处理10 min引发酶活力变化与内源性荧光和外源性荧光强度的相关性Table 1 Correlation between changes in intrinsic and extrinsic fluorescence intensity and lactase activity induced by treatment at 30 ℃for 10 min under different pressures

表2 300 MPa、30 ℃下超高压处理不同时间引发酶活力变化与内源性荧光和外源性荧光强度的相关性Table 2 Correlation between changes in lactase activity and intrinsic and extrinsic fluorescence intensity induced by treatment at 300 MPa and 30 ℃ for different durations

表3 300 MPa不同温度下超高压处理10 min引发乳糖酶活力变化与内源性荧光和外源性荧光强度的相关性Table 3 Correlation between changes in lactase activity and intrinsic and extrinsic fluorescence intensity induced by 10 min treatment at 300 MPa and different temperatures
综上,在实验所设计的条件下,不同压力、不同处理时间和处理温度均会引发乳糖酶活力的变化,该变化与乳糖酶分子的内源性和外源性荧光强度有极显著相关性(P<0.01),由此推断超高压处理乳糖酶引发酶活力变化与乳糖酶分子三级结构有关。类似研究发现,高压处理能够引发胰蛋白酶[34,39]、马肝醇脱氢酶[32]、α-糜蛋白酶[35]等多种蛋白酶的活力变化,均与其二级或三级结构的变化有相关性。
3 结 论
本实验通过不同超高压条件(压力、温度、时间)处理乳糖酶,结果发现不同处理条件能够引发其三级结构(氨基酸微环境)及乳糖酶活力的变化;疏水性氨基酸暴露程度与乳糖酶活力大小有关,其暴露程度越大,酶活力越大。通过相关性分析,发现乳糖酶活力的变化与乳糖酶分子的内源性和外源性荧光强度均有极显著相关性(P<0.01)。综上,乳糖酶活力变化与乳糖酶分子的三级结构有关。
- 食品科学的其它文章
- 花中多糖化学组成与生物活性研究进展
- 番茄碱的制备及其对乙酰胆碱酯酶的抑制作用
- 色氨酸抑制体外模型中晚期糖基化终末产物形成机理
- 松油烯-4-醇对荧光假单胞菌抑菌能力及作用机理
- Widely Targeted Metabolomic and Transcriptomic Analyses Reveal the Regulation of Trypsin on Antioxidant Enzymes and Saturated Fatty Acids in Hylocereus undatus Fruit during Storage
- 乙烯利处理‘赤霞珠’葡萄果实对其葡萄酒中酚类物质组分的影响

