咪喹莫特通过Akt/mTOR信号通路诱导人胃癌细胞SGC-7901发生自噬
姜 炅,董 蕾,宋亚华,王 晶,程 妍,戴社教(西安交通大学第二附属医院消化内科,西安 710004;通讯作者,E-mail:daishejiao@163.com)
Toll样受体(Toll-like receptors,TLRs)是一类模式识别受体,能够识别存在于病原微生物体内的病原体相关分子模式,产生一系列级联反应激活天然免疫,调节获得性免疫[1]。研究表明TLRs激动剂具有较强的抗肿瘤作用,不仅可以对抗感染,提高获得性免疫[2],还可以直接诱导肿瘤细胞发生程序性死亡[3-5]。咪喹莫特(imiquimod,IMQ)是一种人工合成的咪唑喹啉类异环胺类药物,是目前最为熟悉的选择性TLR7激动剂[6],被美国FDA批准用于治疗外阴疣,光化角化病及浅表基底细胞癌[7]。咪喹莫特的抗肿瘤作用主要表现在逆转肿瘤细胞产生的免疫抑制,通过刺激TLR7激活树突状细胞介导的MyD88依赖途径分泌INF-α,IL-6、TNF-α等炎症因子,实现调节免疫、治疗肿瘤的目的[6,8]。此外咪喹莫特还可以直接诱导肿瘤细胞发生凋亡,虽然TLR7不依赖于膜结合的死亡受体,但是过度表达Bcl-2或者抑制caspase信号途径的活化都可以抵抗咪喹莫特诱导的细胞凋亡[9,10]。近些年的研究发现,咪喹莫特对一些实体肿瘤如乳腺癌[11]、髓系白血病[12]、口腔癌[13]等也具有一定的抑制作用,并且咪喹莫特对肿瘤细胞的抑制作用是通过诱导多种形式的程序性死亡而实现的。
细胞自噬是不同于细胞凋亡的另外一种程序性死亡,在介导细胞增殖和死亡中具有重要作用。大量研究表明一些人类肿瘤出现自噬基因拷贝缺失、表达水平下调,提示调控自噬可能成为治疗肿瘤的方向之一[14],并且许多抗肿瘤药物正是通过诱导肿瘤细胞发生自噬而在肿瘤的治疗中表现出了良好的疗效。
我们先前的研究发现不同类型的胃癌细胞株中及胃癌组织中均有TLR7的表达,其激动剂咪喹莫特对SGC-7901细胞生长表现出良好的抑制作用并且能够诱导其发生凋亡[15]。除此之外,我们的实验还发现咪喹莫特存在诱导SGC-7901细胞发生其他类型程序性死亡的可能性,为了证实这一点,本研究在先前实验的基础上通过检测药物干预前后自噬相关基因表达变化探讨咪喹莫特抑制胃癌细胞增殖的深入机制。
1 材料和方法
1.1 材料
人胃癌细胞株SGC-7901由西安交通大学第一附属医院泌尿外科实验室提供。采用含有10%胎牛血清的RMPI-1640培养基培养,常规加入100 U/ml青霉素和100 μg/ml链霉素,37 ℃,5% CO2饱和湿度培养箱孵育细胞至对数生长期用于实验。咪喹莫特购自美国Enzo life Sciences公司;兔抗人LC3抗体、Beclin1抗体分别购自美国Sigma公司及Epitomics公司;mTOR、p-mTOR、p-Akt、p70S6K、GPDH和二抗均购自南京巴傲得生物公司;p62兔抗人、Akt鼠抗人抗体购自美国Santa Cruz公司;反转录试剂盒购自TaKaRa公司;本实验所采用引物由北京奥科生物公司设计并合成。
1.2 实验方法
1.2.1 RT-PCR法检测自噬相关基因表达改变 取对数生长期SGC-7901细胞以1×105/孔接种于6孔板,给予25,50,100 μg/ml咪喹莫特处理24 h,收集干预组及阴性对照组(0 μg/ml咪喹莫特)细胞,提取总RNA,紫外分光光度仪进行RNA含量及纯度鉴定,建立逆转录反应体系:37 ℃ 15 min(逆转录反应),85 ℃ 5 s(逆转录酶失活反应)。合成的cDNA按下述条件进行扩增:预变性94 ℃ 5 min,94 ℃ 30 s、54 ℃ 30 s、72 ℃ 30 s 35个循环,延伸72 ℃ 7 min。合成引物序列见表1。

表1 引物序列
1.2.2 Western blot法检测细胞自噬相关蛋白及Akt/mTOR通路相关蛋白表达变化 取对数生长期SGC-7901细胞以1×105/孔接种于6孔板,给予25,50,100 μg/ml咪喹莫特处理24 h,收集干预组及阴性对照组细胞;联合应用mTOR抑制剂雷帕霉素24 h,收集联合应用组(100 μg/ml咪喹莫特加100 nmol/L雷帕霉素)与100 μg/ml咪喹莫特组及阴性对照组细胞,PBS清洗2次,加入蛋白裂解液冰上裂解1 h,提取总蛋白,蛋白定量后分别取30 μg蛋白制备上样蛋白,8%或10%SDS-PAGE凝胶电泳后转移至PVDF膜,5%脱脂牛奶封闭2 h,先后加入一抗(LC3 1 ∶500,Beclin1 1 ∶1 000,p62 1 ∶500,p-Akt 1 ∶500,Akt 1 ∶200,mTOR 1 ∶500,p-mTOR 1 ∶500,p70S6K 1 ∶500。4 ℃孵育过夜,TBST清洗3次,对应二抗(山羊抗鼠二抗、山羊抗兔二抗1 ∶1 000)。室温下孵育2 h,TBST清洗3次,PBS清洗1次,暗室中等比例加入化学发光液A和B作用1~3 min,进行显影,定影及拍照。
1.2.3 透射电镜下观察细胞形态学改变 给与100 μg/ml咪喹莫特处理12 h,取干预组及阴性对照组对数生长期SGC-7901细胞以1×105/孔接种于6孔板,0.25%胰酶消化干预后细胞,1 500 r/min离心15 min,弃上清,1%四氧化锇固定,随后依次进行脱水、包埋、聚合及染色后,透射电镜下观察细胞超微结构的改变。
1.2.4 MTT法检测细胞增殖活性 取对数生长期SGC-7901细胞以5×103/孔接种于96孔板,联合应用mTOR抑制剂雷帕霉素24 h,收集联合应用组(100 μg/ml咪喹莫特加100 nmol/L雷帕霉素)与100 μg/ml咪喹莫特组及阴性对照组细胞,每孔加入20 μl(5 mg/ml)MTT继续培养3~4 h,弃上清,加入150 μl/孔DMSO室温震荡仪上震荡5 min,酶标仪490 nm波长处测定吸光度A值按以下公式计算细胞存活率。细胞存活率=(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.3 数据统计
2 结果
2.1 咪喹莫特诱导SGC-7901细胞自噬相关基因及蛋白表达改变
不同浓度组咪喹莫特处理24 h,LC3Ⅱ和Beclin1 mRNA及蛋白表达水平上调,与对照组相比,差异具有统计学意义(LC3Ⅱ:F=84.508、P=0.000,F=48.891、P=0.000;Beclin1:F=12.276、P=0.002,F=54.518、P=0.000),且随浓度增加表达水平相应上升。相反,p62 mRNA及蛋白表达水平随浓度增加依次下降,与对照组相比,差异具有统计学意义(F=22.786,P=0.000;F=81.208,P=0.000,见图1)。

与0 μg/ml组相比,*P<0.05图1 不同浓度咪喹莫特作用后LC3Ⅱ、Bclin 1和p62 mRNA及蛋白表达水平Figure 1 The mRNA and protein expression levels of LC3Ⅱ,Beclin1and p62 after treatment with imiquimod
2.2 咪喹莫特对SGC-7901细胞超微结构的影响
与对照组相比较,干预组细胞内线粒体轻度肿胀,部分线粒体嵴溶解,粗面内质网轻度扩张;细胞质内自噬小体(AVi)常见(见图2),自噬小体由双层膜包绕,膜内可见到完整的细胞器及细胞器碎片。

图2 透射电镜下观察咪喹莫特处理SGC-7901细胞12 h细胞自噬情况Figure 2 Autophagy of SGC-7901 cells after treated with imiquimod for 12 h under electron microscopy
2.3 咪喹莫特诱导Akt/mTOR信号通路相关蛋白表达改变
不同浓度咪喹莫特处理后各组总Akt和mTOR表达量无明显差异,磷酸化Akt和mTOR随剂量增加表达水平逐渐下降,其下游蛋白p70S6K表达也明显下降。与对照组相比,联合应用雷帕霉素组LC3Ⅱ和Beclin1表达水平明显上升,细胞增殖活性下降(P<0.05,见图3)。
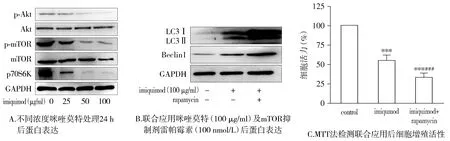
与对照组相比,***P<0.01;与咪喹莫特组相比,###P<0.01图3 咪喹莫特通过Akt/mTOR信号通路诱导SGC7901细胞发生自噬Figure 3 Imiquimod induced autophagy in SGC7901 cells through the Akt/mTOR signaling pathway
3 讨论
胃癌是世界上排名第4位的最常见的恶性肿瘤,由于其较高的发病率及死亡率使其成为致死性肿瘤中排名第2位的恶性肿瘤[16]。多数病人尤其是老年人在发现时已进入中晚期,临床治疗以氟尿嘧啶或铂类联合化疗为主,但疗效欠佳。近些年,以人表皮生长因子受体、血管内皮生长因子、免疫检查点等为靶点的靶向药物治疗已成为晚期胃癌的研究热点,虽然最大程度地提高了患者的生存率,控制了瘤组织进一步恶化,但术后复发、药物副作用及远期预后等整体疗效仍不能令人十分满意,因此开发及寻求新的更有效的辅助化疗药物是目前胃癌治疗的新方向[17]。
大量研究表明咪喹莫特具有直接诱导肿瘤细胞发生凋亡的作用,过度表达的Bcl-2或者抑制caspase信号途径的活化都可以抵抗咪喹莫特诱导的细胞凋亡[9]。体外培养人皮肤鳞癌细胞SCL-1,150 μg/ml咪喹莫特可以明显抑制SCL-1细胞增殖,早期凋亡比率上升,Fas基因表达上调而Bcl-2基因表达下调[18]。除此之外,咪喹莫特能够诱导结肠癌细胞发生自噬及自噬性死亡,而凋亡相关基因未见明显改变[19]。在对咪喹莫特抑制前列腺癌细胞增殖作用的研究中发现,咪喹莫特通过线粒体依赖途径诱导了TRAMP-C2细胞的直接凋亡[20]。上述研究表明咪喹莫特可以通过多种途径影响不同类型的肿瘤细胞发生不同形式的细胞死亡。我们先前的研究发现,采用不同浓度组咪喹莫特作用于SGC-7901细胞12~24 h,咪喹莫特对SGC-7901细胞的抑制作用呈时间及浓度依赖性[15]。100 μg/ml咪喹莫特在作用12 h时即可明显抑制细胞增殖活性,但咪喹莫特诱导SGC-7901细胞发生的凋亡效应在药物干预至少12 h之后,因此我们猜测咪喹莫特作用胃癌细胞早期可能先诱导发生了其他形式的死亡如Ⅱ型程序性死亡即自噬,然后进一步诱导发生细胞凋亡。
到目前为止透射电镜被认为是鉴定自噬的金标准,本实验通过透射电镜观察咪喹莫特处理12 h SGC-7901细胞超微结构的改变,结果发现细胞内存在大量囊泡性结构,在30 000倍视野下可以观察到这些囊泡结构多为双层膜包裹的细胞器如线粒体形成的AVi,在本阶段没有观察到明显的细胞凋亡形态学改变。而我们之前的研究表明,咪喹莫特处理24 h凋亡现象发生明显增多,细胞皱缩、核凝聚、边集,部分细胞可观察到典型的凋亡小体出现[21]。由此可见,咪喹莫特可以同时诱导SGC-7901细胞发生凋亡和自噬,并且自噬现象发生早于凋亡。
除了透射电镜外,检测自噬相关基因的改变也是鉴定是否发生自噬的途径之一。自噬的启动和运行包括自噬体双层膜结构的形成,自噬体与溶酶体的结合,自噬溶酶体的酸化、降解等过程均需要保守的自噬相关基因产物(Atg)的参与,LC3Ⅱ定位于自噬体内外膜,一直结合在自噬体膜上,直到自噬体与溶酶体融合,因此LC3Ⅱ被认为是细胞内自噬现象发生的标记物,LC3Ⅱ含量的多少在某种程度上反映了细胞自噬活性的强弱。Beclin1是另外一种和自噬关系密切的自噬基因,它是酵母Atg6/Vps30的同系物,在抑制肿瘤、延缓衰老、保护神经系统等方面发挥重要作用,同时定位在内质网上的Beclin1是诱发自噬的重要因子,Beclin1通过与Ⅲ型PI3K和UVRAG结合形成复合体调节其他Atg基因在自噬体形成中的定位,从而启动自噬过程。本实验发现不同浓度咪喹莫特作用SGC-7901细胞24 h,LC3Ⅱ和Beclin1 mRNA及蛋白水平明显上调,且随浓度增加表达水平相应上升,而p62表达水平随咪喹莫特浓度的增加呈现逐渐下降的趋势,进而进一步证实咪喹莫特确实可以诱导胃癌细胞发生自噬。
调控自噬的信号途径有很多种,其中Akt/mTOR信号通路是调控自噬最主要的途径之一[22]。在肿瘤发生、发展过程中,Akt/mTOR信号通路失调是一个频发事件,肿瘤中通常存在自噬能力下降和Akt/mTOR通路上调,因此目前针对该通路的抗肿瘤药物也逐渐被开发出来。本实验通过检测Akt/mTOR信号通路相关蛋白的表达水平发现,咪喹莫特可以使Akt和mTOR的磷酸化减少,其下游的信号分子p70S6激酶p70S6k表达下调,提示咪喹莫特可以负向调控该信号通路以发挥抑制肿瘤生长的作用,使用mTOR选择性的抑制剂雷帕霉素抑制该通路的活性不仅可以使SGC-7901细胞增殖活性进一步下降,而且可以促进自噬相关蛋白LC3Ⅱ和Beclin1的表达上调,提示Akt/mTOR信号通路介导了咪喹莫特诱导的细胞自噬及自噬性死亡。
综上所述,咪喹莫特可以诱导SGC-7901细胞发生自噬,其机制是部分抑制Akt/mTOR信号通路,激活自噬相关蛋白表达及自噬体的形成,从而达到抑制胃癌细胞生长的作用。肿瘤的发生发展过程错综复杂,单一环节的治疗效果有限,复合治疗具有更明显的优势,TLRs激动剂具有用量小、副作用少,与多种化疗药物合用有助于减轻用药负担,增加药物疗效,因此TLRs激动剂在基础研究和临床应用中都具有一定的潜在开发意义[23]。本研究在以往科研工作基础上进一步探讨了TLR7激动剂咪喹莫特抑制人胃癌细胞发生发展的分子机制,为日后进一步深入的研究奠定了理论基础,同时为胃癌的治疗提供了可能的新方向。

