miR-183通过抑制CAND1促进前列腺癌病理进程
张国颖 李俊 白宇 毕城伟 李瑞乾 赵斌
(昆明医科大学第三附属医院 云南省肿瘤医院泌尿外科,云南 昆明 650118)
前列腺癌具有早期不易察觉,预后性差等特点〔1〕,因此寻找有效的分子标记物指导早期诊断治疗是现阶段前列腺癌临床研究热点。Cullin-associated NEDD8-dissociated(CAND)1,是一种人体内由CAND1基因编码的蛋白质,已证实与细胞内蛋白质泛素化有关系〔2〕,有研究称蛋白质泛素化参与调节多种细胞生理功能,包括前列腺癌的许多疾病中均有发现蛋白质泛素化在细胞内的积累〔3,4〕。miRNA是长 21~23 nt 的一种非编码 RNA,它通过调控基因的表达,在肿瘤中抑癌或促癌作用〔5〕。多种研究表明,在前列腺癌的发生发展中miRNA起着重要的作用,但是miR-183在前列腺癌中的作用尚未阐明,本研究检测了miR-183在前列腺癌患者中的表达,并探究miR-183是否通过调控CAND1从而影响前列腺癌的发生发展,并有可能为前列腺癌诊断与预测提供新靶点。
1 对象与方法
1.1研究对象 选择2014年2月至2018年4月昆明医科大学第三附属医院云南省肿瘤医院泌尿外科收治的前列腺癌患者88例,平均年龄(66.28±14.91)岁,采集已被病理学检查证实的前列腺患者的癌组织及匹配的癌旁正常组织,-80℃保存,所有患者未接受任何治疗、放疗及化疗。
1.2细胞培养与转染 在含10%的胎牛血清(FBS)和100 U/ml青霉素-链霉素溶液的DMEM培养基中培养人类前列腺癌细胞系PC3、Tsu-Pr1、DU145、M12、22RV1及LNCAP。在含50 mg/L的牛脑垂体提取物(BPE)、5%L-谷氨酰胺及5 μg/L上皮生长因子(EGF)的角质形成细胞无血清培养基(KSFM)中培养对照组非肿瘤前列腺上皮细胞系人正常前列腺上皮细胞(RWPE)-1细胞。使用LipofectamineTM3000 转染试剂分别向对数期RWPE-1细胞中转染negative control miRNA、miR-183 mimics、miR-183 inhibitor mimics、miR-183 mimics+CAND1。
1.3采集外周血 采集患者静脉血5 ml,3 000 r/min离心10 min,随后将血浆与血细胞分别装到无RNA酶的EP管中,在低温(-80℃)冰箱中保存待用。
1.4定量实时聚合酶链反应(qRT-PCR) 按照Trizol试剂盒说明书中步骤提取总RNA,按照反转录试剂盒的说明书将总RNA进行RNA逆转录,合成cDNA。按照qRT-PCR 试剂盒说明书进行PCR。
1.5荧光素酶报告基因法 构建CAND1荧光素酶质粒:野生型 pMIR-WT和突变型质粒pMIR-Mut。通过miRNA靶点数据库targetscan对miR-183潜在的靶基因进行预测,为了验证miR-183是否可靶向调控CAND1,将miR-183 mimics,negative control miRNA mimics(Ncontrol),miR-183 inhibitor,野生型CAND1质粒及突变型CAND1质粒共转染进PC3细胞中,使用荧光素酶报告基因法检测各组荧光素酶活性。
1.6Western印迹 采用RIPA裂解液提取细胞或组织蛋白,遵照二喹啉甲酸(BCA)法测定蛋白浓度,加入缓冲液后变性蛋白。按每泳道以50 μg蛋白进行12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,然后将蛋白转移到聚偏氟乙烯(PVDF)膜上,5%脱脂奶粉37℃封闭1 h。加入一抗CAND1抗体(1∶500),内参GAPDH(1∶1 000),4℃孵育过夜。TBST漂洗3次后加入辣根过氧化物酶标记的二抗(1∶1 000),室温孵育1 h。电化学发光(ECL)液暗室发光显影,采集图像并分析。
1.7Transwell小室 将转染后的前列腺癌PC3细胞调整细胞密度为1×106个/ml。在上室加入100 μl细胞悬液;在下室加入600 μl含10%胎牛血清的培养基;置于37℃、5%CO2培养箱中培养24 h。取出小室后用磷酸盐缓冲液(PBS)淋洗3次;将小室置于95%乙醇中固定 5 min;在0.5%结晶紫染色液中染色10 min后,用 PBS 漂洗去除未结合细胞的染色液。用棉签轻拭去小室滤膜上层的细胞,在显微镜下观察滤膜下层细胞。
1.8CCK8实验 用培养液配成单个细胞悬液,按1×104个/孔接种于96孔板,每孔200 μl细胞悬液,常规培养24 h后,参照CCK-8试剂盒操作说明书操作向每孔加入10 μl CCK-8溶液,37℃孵育1~2 h后,用酶标仪测定450 nm处的吸光度。
1.9细胞划痕实验 空白对照组和miR-183 mimics转染组和miR-183 mimics+CAND1转染组的前列腺癌PC3细胞转染48 h后,将单细胞悬液接种于12孔细胞培养板。当细胞汇合度达到80%~90%时,用200 μl的移液器枪头在正中央位置划一直线,形成单层细胞间的划痕。将细胞培养板置于显微镜下观察并拍照。
1.10流式细胞术检测细胞周期 转染后细胞PC3细胞用预冷的PBS重悬,70%乙醇固定,4℃过夜。去除乙醇后,用PBS洗涤2次并加入100 μl RNaseA,37℃水浴30 min,接着添加400 μl PI染色并混匀,4℃避光30 min,最后用流式细胞仪检测细胞周期。
1.11统计学方法 采用SPSS22.0统计软件进行t检验和方差分析。
2 结 果
2.1miR-183在前列腺癌患者组织和各细胞株中的表达量 miR-183在前列腺肿瘤组织中表达量(6.22±1.25)明显较癌旁正常组织(5.56±0.50)升高。miR-183在多种前列腺癌细胞株(PC3、Tsu-Pr1、DU145、22RV1、LNCAP)中的表达量(3.92±0.37、4.52±0.44、4.52±0.45、3.05±0.29、3.32±3.30)与RWPE-1(1.00±0.00)相比均显著升高(均P<0.05)。miR-183可能参与前列腺癌的细胞调节功能,导致表达异常。
2.2前列腺癌患者临床病理特征及外周血中miR-183的表达量 Glcason评分>7的患者显著高于Glcason评分≤7的患者,TNM分期越高的患者表达量显著越高,淋巴结转移的患者明显高于无淋巴结转移的患者,远处转移的患者显著高于无远处转移的患者,前列腺癌危险因素越高的患者表达量越高,差异具有统计学意义(P<0.05)。不同年龄、血清PSA水平的患者miR-183表达量比较,无统计学差异(P>0.05)。见表1。
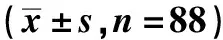
表1 前列腺癌患者的临床病理特征及血清miR-183的表达量
2.3miR-183通过结合CAND1的 3′-UTR来抑制CAND1的表达量 对于野生型CAND1质粒,miR-183 mimics转染组荧光素酶活性显著低于空白对照组,miR-183 inhibitor 转染组荧光素酶活性显著高于空白对照组(均P<0.05)。对于突变型CAND1质粒,荧光素酶活性均没有明显变化。见表2。双荧光素酶结果表明miR-183可抑制CAND1的表达。

表2 miR-183通过结合CAND1的 3′-UTR来抑制CAND1的表达量
2.4qRT-PCR及Western印迹检测miR-183与CAND1的调控作用 qRT-PCR结果显示,miR-183 mimics转染组CAND1 mRNA表达量(4.05±1.05)显著低于空白对照组(5.62±1.13);miR-183 inhibitor转染组CAND1 mRNA表达量(7.85±1.85)显著高于空白对照组。Western 印迹检测结果也显示,miR-183 mimics转染组中CAND1蛋白表达量(3.02±0.93)显著低于空白对照组(7.55±2.05),miR-183 inhibitor转染组CAND1蛋白表达量(10.34±2.12)显著高于空白对照组(均P<0.05)。见图1。

图1 Western印迹检测miR-183与CAND1的调控作用
2.5miR-183与CAND1对PC3细胞增殖、迁移及周期S期相关性 miR-183 mimics转染组的OD值(1.24±0.09)显著高于空白对照组(0.76±0.08),miR-183 mimics+CAND1转染组的OD值(0.29±0.03)显著低于miR-183 mimics转染组。miR-183 mimics转染组S细胞数、下室细胞数(192.2±11.6、19.5±2.8)显著高于空白对照组(94.6±6.4、8.1±1.9);miR-183 mimic+CAND1转染组S细胞数、下室细胞数(37.3±5.1、7.2±1.1)显著低于miR-183 mimics转染组(均P<0.05)。见图2。

图2 Transwall侵袭实验下室结晶紫染色(A,×400)和细胞划痕实验(B,×400)
2.6CAND1在前列腺癌肿瘤组织中表达量变化 前列腺癌组织中CAND1 mRNA表达量(3.34±1.88)显著低于癌旁正常组织(5.55±1.03)。前列腺癌细胞系PC3、Tsu-Prl、DU145、22RV1、LNCAP中CAND1 mRNA表达量(3.92±0.37,4.52±0.44,4.52±0.45,3.05±0.29,3.32±3.30)均显著低于非肿瘤前列腺上皮细胞系RWPE-1中CAND1mRNA表达量(7.55±2.05)。前列腺癌肿瘤组织中CAND1蛋白表达量(4.07±1.52)显著低于癌旁正常组织(6.19±1.87,均P<0.05)。见图3。CAND1对前列腺癌的病理发展有抑制。
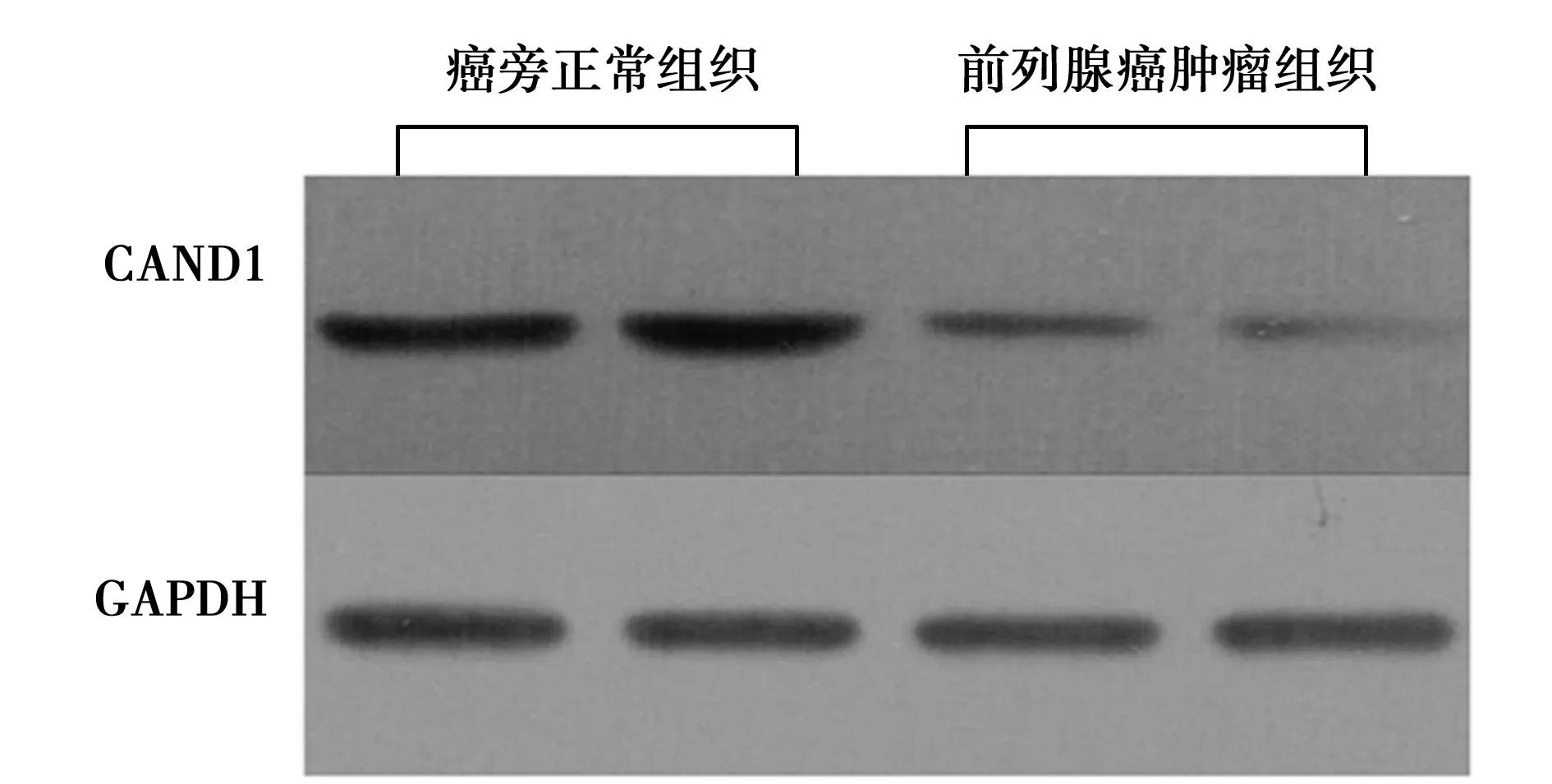
图3 CAND1在前列腺癌肿瘤组织和癌旁正常组织中mRNA表达
3 讨 论
现阶段仍然没有足够的证据表明使用PSA或前列腺穿刺活检等常见生物标记物进行筛查可以降低前列腺癌死亡率〔6~8〕。因此需要寻找新的生物标志物用于前列腺癌临床研究。
miRNAs影响包括增殖、分化、凋亡及细胞周期在内的许多重要的细胞学进程,在肿瘤的发生发展过程中起重要作用。研究表明多个miRNAs与已证实前列腺癌发病进程相关〔9,10〕。Feng等〔11〕研究发现miR-17-92基因簇可能是前列腺癌潜在诊断和预后生物标志物,而miR-17-92基因簇和血清PSA的组合可以提高前列腺癌诊断的准确性。Kurul等〔12〕发现在检测的let-7c,miR-21,miR-145,miR-182和miR-221 五种miRNA中,miR-221与低风险前列腺癌的生化复发相关性最大。Lu等〔13〕研究发现miRNA-186通过靶向调控YY1和CDK6来抑制前列腺癌细胞增殖和肿瘤生长。本文结果提示,外周血中miR-183的表达量对不同Gleason评分、TNM分期、淋巴结转移、远处转移及危险因素患者的临床特征是有具备影响的,miR-183有可能成为前列腺癌诊断与预测的潜在生物标志物。miR-183可能参与前列腺癌的细胞调节功能,导致多项检测表达水平异常。miR-183有可能成为前列腺癌诊断与预测的潜在生物标志物。
Korzeniewski等〔14〕研究发现CAND1 mRNA和蛋白质在前列腺癌中表达缺失。本文研究说明CAND1对前列腺癌的病理发展有抑制影响,而过表达miR-183可抑制CAND1 mRNA翻译水平及其蛋白表达,促进前列腺癌PC3细胞增殖、迁移及S期的聚集。同时,对miR-183进行抑制后,对CAND1产生抑制作用。
综上,CAND1对前列腺癌有抑制调控作用,同时过表达miR-183能够抑制CAND1 mRNA翻译及其蛋白表达,促进前列腺癌的病理发展,推测敲低miR-183可能成为前列腺癌诊断及治疗的新靶向。
——一道江苏高考题的奥秘解读和拓展

