MEBO对糖尿病大鼠创面自噬信号因子Beclin1、LC3、p62的调控作用
麻华胆 黄庆 郑爱甜 刘贤彬 李政 王琳 曾娜 吴标良
(右江民族医学院 1附属医院内分泌科,广西 百色 533000;2研究生学院)
糖尿病溃疡创面是糖尿病的常见并发症,主要发生于血糖控制不良患者,代谢紊乱导致溃疡创面愈合不良,在治疗上显得尤为棘手。湿润烧伤膏(MEBO)是一种中药制剂,富含β-谷甾醇、黄芩甙、小檗碱等药理成分及亚油酸、氨基酸、糖类等营养成分,具有改善循环、抗炎抑菌、化症止痛之功效并为细胞的增殖再生提供能量。实践表明,MEBO可促进糖尿病溃疡创面的愈合,然而,其作用机制尚未完全明了。自噬作为一种自我保护机制,在维持细胞存活、更新、物质循环和组织稳态方面起重要作用。研究显示,细胞自噬在创面愈合过程中的炎症反应、肉芽组织形成、再上皮化、创面重建等多环节均发挥重要作用〔1〕。本文拟分析MEBT/MEBO对糖尿病大鼠溃疡创面Beclin1、LC3、p62表达的影响及其潜在的作用机制。
1 材料与方法
1.1实验动物 SPF级Wistar雄性大鼠250只,3月龄,体重230~260 g,由长沙市天勤生物技术有限公司提供。本实验经右江民族医学院动物伦理委员会批准。
1.2主要试剂 康复新液:湖南科伦制药有限公司生产;MEBO:汕头市美宝制药有限公司生产;Beclin1、p-Beclin1、LC3A/B、p62抗体:Abcam公司生产;山羊抗兔Ig(100 μl)、β-actin抗体(100 μl):北京中杉金桥生物技术有限公司生产;Beclin1、LC3、p62、β-actin引物:上海捷瑞生物工程有限公司合成。
1.3创面模型的建立及创面处理方法 大鼠予适应性喂养1 w后分组。空白组只做备皮处理,对照组在背部建立常规创面模型,模型组、康复新组、MEBO组予腹腔注射链尿佐菌素(STZ)诱导糖尿病大鼠模型后行全层皮肤切除〔2〕。创面模型建立后予每日换药2次,对照组、模型组予以生理盐水纱布外敷,康复新组、MEBO组分别外敷康复新及MEBO纱布。各组于第1、5、11、18、25天各随机取10只大鼠,采集创面组织后处死。将采集到的样本分别用于制作苏木素-伊红(HE)染色切片、免疫荧光染色切片、透射电镜超薄切片及行qRT-PCR和Western印迹检测。
1.4记录创面面积并计算创面愈合率 分别于上述5个时相点,将刻度尺作为参照,对创面进行拍照,采用Image J软件测定未愈合创面的面积并计算愈合率,创面愈合率=(原始的创面面积-未愈合的创面面积)/原始的创面面积×100%。
1.5HE染色观察病理改变 予10%甲醛固定组织样本,48 h后依次脱水、透明、浸蜡包埋、切片、烤片、HE染色制片,光学显微镜下观察炎症细胞浸润、肉芽组织生长及再上皮化情况。
1.6组织切片观察Beclin1、LC3、p62免疫荧光染色 组织切片脱蜡水化后依次进行抗原修复、封闭、一抗孵育、二抗孵育、染色、封片,荧光显微镜下观察荧光细胞染色情况,每张切片随机选取3个视野(×400),用Image J测定其OD值。
1.7电镜观察细胞内自噬体 组织样本予戊二醛溶液4℃固定,再予1%锇酸固定、梯度脱水、组织浸透、树脂包埋,电镜下观察自噬体数目、形态及结构,每张切片随机选取3个细胞,每个细胞选取1个典型视野(×8 000),统计每个视野的自噬体,取其平均值进行对比。
1.8Western印迹检测Beclin1、p-Beclin1、LC3、p62的表达水平 按照Western印迹操作规程依次提取总蛋白,测定总蛋白质浓度并计算蛋白上样量。制作十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、加样、电泳、转膜、封闭后4℃孵育一抗过夜,翌日孵育二抗后显影。
1.9qRT-PCR分析Beclin1、LC3、p62mRNA的表达 液氮研磨待检组织,提取总RNA,测定总RNA浓度及质量。将测定合格的总RNA进行反转录,然后以cDNA为模板,进行PCR扩增。
1.10统计学分析 采用SPSS17.0软件进行单因素方差分析。
2 结 果
2.1创面愈合情况 治疗第5天,对照组创面轻微水肿,粉红色肉芽组织均匀分布,模型组、康复新组、MEBO组创面晦暗、水肿明显,表面痂皮覆盖,撕痂后可见少许肉芽组织形成。治疗第11天,各组创面红润,可见大片鲜红色肉芽组织形成,肉芽组织长势相当。治疗第18天,对照组创面基本愈合,仅留一点状疤痕;康复新组、MEBO组、模型组创面干燥,康复新组、MEBO组创面大部分上皮化,肉芽组织不明显,模型组仍可见颗粒状肉芽组织生长。治疗第25天,对照组、康复新组、MEBO组创面均已愈合,模型组创面接近愈合,见图1。
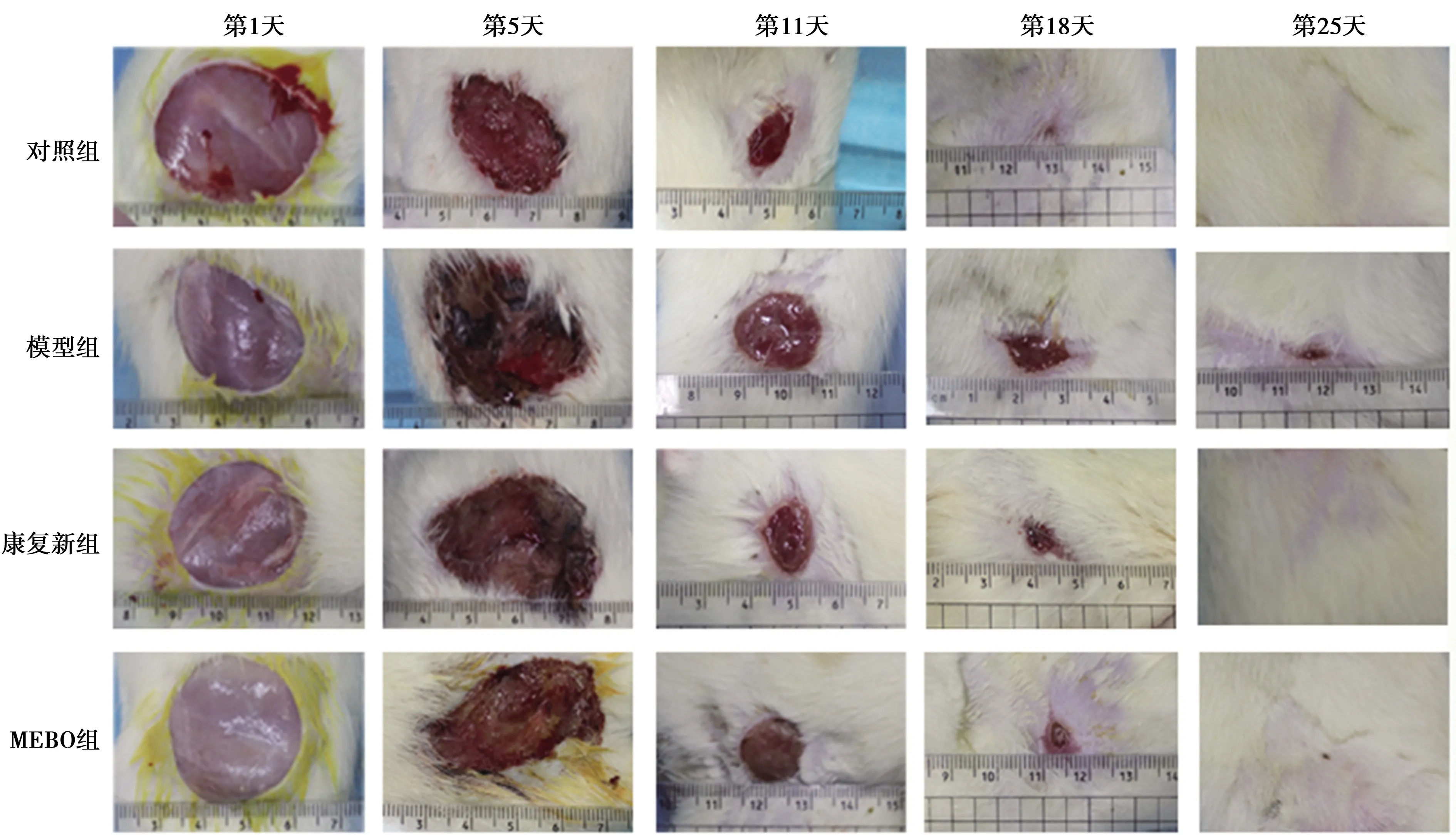
图1 4组治疗后不同时间点创面愈合情况
2.2创面愈合率 第5天,各组创面愈合率大致相当(P>0.05);第11天,模型组创面愈合率显著低于对照组、康复新组、MEBO组(P<0.05),对照组与康复新组、康复新组与MEBO组比较差异均无统计学意义(P>0.05);第18天,对照组>MEBO组>康复新组>模型组,差异有统计学意义(P<0.05);第25天,对照组、康复新组、MEBO组创面愈合率相当(P>0.05),模型组显著低于对照组、康复新组、MEBO组(P<0.05),见表1。
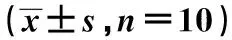
表1 4组治疗不同时间点创面愈合率比较
2.3创面组织病理形态学 治疗第5天,对照组、模型组、康复新组、MEBO组创面组织大量炎症细胞浸润,少许成纤维细胞及毛细血管形成,其中模型组水肿及炎性浸润最为明显。第11天,各组炎症细胞浸润均较前减轻,大量肉芽组织形成,仍以模型组的炎症细胞浸润最为明显,而成纤维细胞及毛细血管分布较对照组、康复新组、MEBO组稀疏紊乱。第18天,对照组可观察到完整表皮及皮肤附属器,康复新组、MEBO组毛细血管部分萎缩,成纤维细胞致密排列,模型组尚可见较为明显的毛细血管网,成纤维细胞排列仍较为紊乱。第25天,各组可见结构完整的皮脂腺、毛囊,组织表面表皮覆盖,见图2。
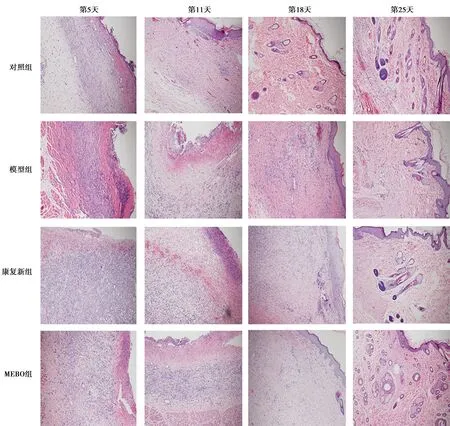
图2 4组治疗后不同时间点创面组织(HE染色,×100)
2.4Beclin1、LC3、p62免疫荧光染色结果 空白组各时相点及各组第1天创面组织内均观察到少量Beclin1、LC3阳性染色细胞;第5天起,创面模型各组可见大量阳染细胞,早期阳染细胞数明显多于晚期。荧光强度分析亦显示各组第5、11天OD值高于第18、25天,治疗第5天MEBO组OD值高于模型组,差异具有统计学意义(P<0.05)。p62阳性染色细胞在空白组及各组第1天创面组织中高度表达,第5天各组阳染细胞明显减少,此后,可见阳染细胞数回升,荧光强度分析显示各组第5、11天OD值低于第18、25天,治疗第5天MEBO组OD值低于模型组,差异有统计学意义(P<0.05),见图3~5、表2~4。
表2 5组治疗后不同时间点创面组织内Beclin1 OD值比较
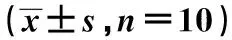
表3 5组治疗后不同时间点创面组织内LC3 OD值比较
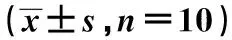
表4 5组治疗后不同时间点创面组织内p62 OD值比较
图3 5组创面组织Beclin1表达(免疫荧光,×400)
图4 5组创面组织治疗后不同时间点LC3表达(免疫荧光染色,×400)
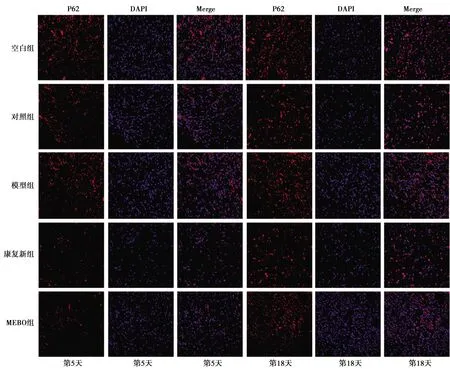
图5 5组治疗后不同时间点创面组织P62表达(免疫荧光染色,×400)
2.5创面组织自噬体检测结果 第1天,创面模型各组组织细胞内可见少量自噬体,第5天可观察到成纤维细胞内多个双层或多层膜结构的自噬体,部分自噬体内可见残留细胞器,其中以模型组细胞内自噬体数最少,随后各个时相点,各组自噬体数目逐渐减少,见表5、图6。
表5 各组治疗后不同时间点创面组织细胞内自噬体数量比较
2.6Beclin1、p-Beclin1、LC3、p62蛋白检测结果 除空白组以外,各组Beclin1、p-Beclin1的表达量及LC3Ⅱ/LC3Ⅰ比值上升后下降,对照组、康复新组、MEBO组于第5天表达最高,随后逐渐降低,模型组第5天或第11天的表达量最高,表达峰值延迟,治疗早期,MEBO组的表达量高于模型组,差异有统计学意义(P<0.05)。p62的表达量下降后上升,各组第5天的表达量最低,对照组、康复新组、MEBO组于第5天达到最低值后随即逐渐升高,模型组表达量回升延迟。治疗早期,MEBO组的表达量低于模型组,差异有统计学意义(P<0.05),见图7、表6~9。
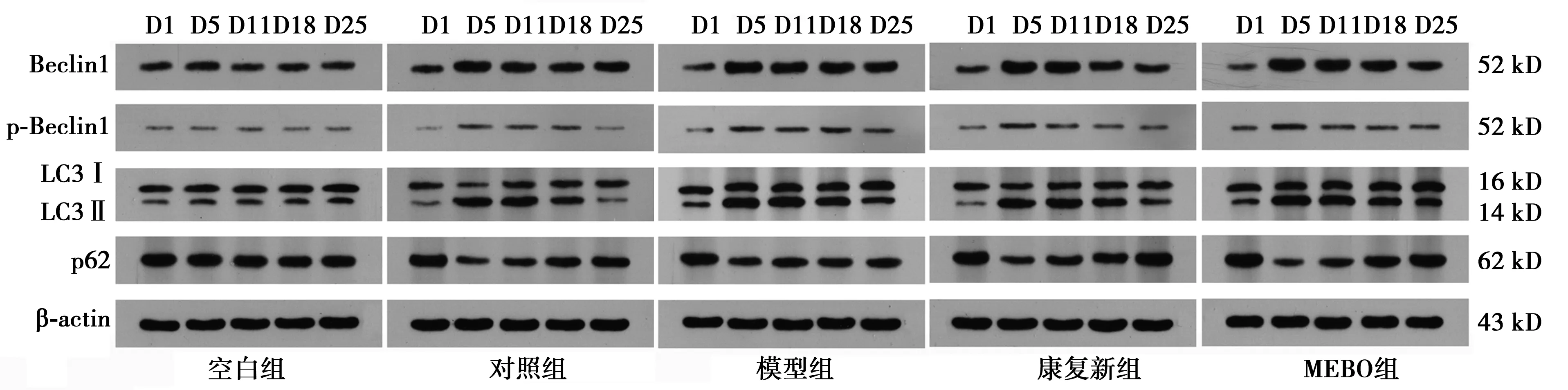
D1、D5、D11、D18、D25:第1天、第5天、第11天、第18天、第25天图7 5组治疗后不同时间点创面组织Beclin1、p-Beclin1、LC3、p62蛋白表达条带
表6 5组治疗后不同时间点创面组织内Beclin1蛋白表达水平比较
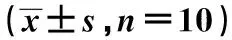
表7 5组治疗后不同时间点创面组织内p-Beclin1蛋白表达水平比较
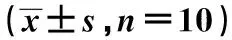
表8 5组治疗后不同时间点创面组织内LC3Ⅱ/LC3Ⅰ比值比较
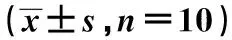
表9 5组治疗后不同时间点创面组织内p62蛋白表达水平比较
2.7Beclin1、LC3、p62 mRNA检测结果 除空白组以外,Beclin1、LC3 mRNA的表达上升后下降,各组于第5天的表达量最高,对照组、康复新组、MEBO组表达量达峰值后随即逐渐降低,模型组表达峰值延迟,于第11天表达量最高,治疗早期,MEBO组第5天表达量高于模型组(P<0.05)。p62 mRNA的表达先下降后上升,各组于第5天的表达量最低,对照组、康复新组、MEBO表达量达最低值后随即逐渐升高,模型组表达量回升延迟,治疗早期,MEBO组的表达量低于模型组(P<0.05)。见表10~12。
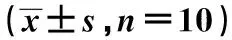
表10 5组治疗后不同时间点创面组织内Beclin1 mRNA表达水平比较
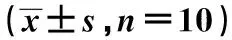
表11 5组治疗后不同时间点创面组织内LC3 mRNA表达水平比较
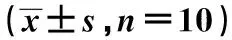
表12 5组治疗后不同时间点创面组织内p62 mRNA表达水平比较
3 讨 论
细胞自噬是真核生物进化过程中高度保守的降解系统,参与细胞的新陈代谢并维持细胞结构和功能稳定。Beclin1与自噬前体的形成有关,饥饿状态下,活化的ULK1将Beclin1的Ser 14位点磷酸化,从而提高Vps34复合体的活性,Vps34是哺乳动物中唯一的Ⅲ型磷脂酰肌醇激酶(PI3K-Ⅲ),催化磷脂酰肌醇(PI)磷酸化生成3-磷酸磷脂酰肌醇(PI3P),PI3P在内质网膜局部聚集并招募自噬相关蛋白从而促进自噬前体的形成〔3〕。LC3是一种自噬体膜相关蛋白,在自噬流中以LC3Ⅰ、LC3Ⅱ两种形式存在,LC3Ⅰ在Agt7和Agt3的作用下,与磷酯酰乙醇胺(PE)结合后形成LC3Ⅱ,LC3Ⅱ黏附于自噬体膜上,参与自噬膜的形成与延伸,同时,LC3Ⅱ与p62蛋白LC3识别序列(LRS)结构域结合后形成选择性自噬受体,介导泛素化蛋白的聚集〔4〕。p62是连接泛素-蛋白酶体系统(UPS)和自噬途径的受体蛋白,选择性与泛素化蛋白结合并转运至自噬体,之后自身随泛素化蛋白一起通过自噬途径降解〔5〕。因此,p62的蛋白水平与选择性自噬的活性呈负相关。
本研究结果表明糖尿病状态抑制创面的愈合并降低自噬水平。这与前期的研究结论一致,高糖环境〔6〕、胰岛素抵抗〔7〕、糖基化终产物的堆积〔8〕、免疫功能紊乱〔9〕等均与创面愈合不良相关。长期高糖暴露下,自噬相关蛋白的合成障碍〔10〕及线粒体、溶酶体功能损害,致自噬溶酶体生成障碍〔11〕是自噬抑制的主要原因。本研究结果还表明MEBO可有效促进创面愈合。生长因子和P物质的高表达〔12〕及增强表皮干细胞的活化、增殖〔13〕被认为是其主要作用机制。本文结果提示自噬水平的提高可能为MEBO促进创面愈合的机制之一。在创面形成初期,细胞处于高度的应激状态,加之新生血管尚未形成,创面组织缺血缺氧,细胞处于饥饿状态,mTORC1受抑制,引起ULK1的活化,活化的ULK1将Beclin1磷酸化,从而促进自噬前体的形成。LC3在自噬启动后加强蛋白剪切及泛素样反应,形成大量LC3Ⅱ,参与自噬前体的延伸及协助泛素化蛋白进入自噬溶酶体,因此,创面愈合早期Beclin1的磷酸化水平及LC3Ⅱ/LC3Ⅰ比值明显升高。p62作为选择性自噬的介导分子,其在创面愈合早期的低表达表明选择性自噬在此时处于活跃状态。自噬在创面愈合早期发挥重要作用〔1〕,一是活化中性粒细胞、提高巨噬细胞的吞噬能力并向M2转化,在增强固有免疫的同时及时启动组织修复;二是促进间充质干细胞的增殖和分化。启动创面修复后,自噬的激活有助于成纤维细胞的增殖与分化及角质形成细胞的迁移,加速新生血管形成。创面愈合晚期,自噬水平回落,可能为创面组织细胞的饥饿状态改善,对mTORC的抑制作用减弱,从而使Beclin1的磷酸化水平及LC3转化率逐渐降低,p62逐渐升高。关于模型组Beclin1、p-Beclin1的表达量及LC3转化率高峰延迟或后移的实验结果,推测在缺乏有效药物干预的情况下,模型组自噬水平在治疗早期偏低,致愈合效率低下,乃至治疗晚期,创面缺血缺氧仍未显著改善,对自噬的刺激作用未明显减弱,使得模型组Beclin1、p-Beclin1的表达量及LC3转化率在治疗晚期仍保持较高水平,这也是第25天模型组Beclin1、p-Beclin1的表达量及LC3转化率普遍高于康复新组和MEBO组的原因所在。在创面重建过程中,自噬的抑制可促进成纤维细胞的凋亡及减少胶原合成〔14〕,以减少瘢痕形成,因此,创面愈合晚期自噬水平的低下也可能与机体基于防止瘢痕形成而作出的适应性自噬下调有关。
综上,MEBO可有效促进糖尿病创面的愈合,对细胞自噬的调控可能为其作用机制之一。药物阻断溶酶体降解后再测定LC3Ⅱ的水平更能体现自噬的改变,但由于实验设计有限,未能在药物干预的条件下测定,有待进一步验证。

