基于3DEEM-PARAFAC研究连作花生不同健康状态下根际有机质组成特性
刘天顺, 李朋发, 李桂龙, 吴 萌, 刘 明, 刘 凯, 李忠佩*
1. 中国科学院南京土壤研究所/土壤与农业可持续发展国家重点实验室, 江苏 南京 210008
2. 中国科学院大学, 北京 100049
引 言
土壤有机质(soil organic matter, SOM)是影响作物产量的关键因子, 提高SOM含量、 改善SOM化学性质是提升耕地质量和生产力的有效途径[1]。 土壤可溶性有机质(dissolved organic matter, DOM)是SOM中生物活性最高的组成部分, 而其活性和生物功能在很大程度上由其化学组成结构决定[2-3]。 探究土壤DOM的化学性质对于明确DOM组分在土壤生物化学过程中扮演的角色、 理解DOM的生态功能具有重要意义。
花生是南方低丘红壤区旱地的主要经济作物和油料作物, 由于地质特点、 气候条件、 种植习惯等因素的影响, 连年连片种植的现象非常常见, 连作障碍问题日益突出。 对花生连续种植导致土壤环境恶化已有较多研究[4], 但是主要都集中在自毒物质的积累、 土壤养分失调和微生物区系失衡等方面。 作为根际土壤环境中各种生物和非生物过程的重要产物, 根际DOM组成与植物生长状态之间的关系却鲜有报道。 DOM是连接植物、 土壤微生物的关键物质[5], 其含量和结构可能与植物健康状态有密切关系。 因此探究花生根际土壤DOM的组成和结构特征, 对阐明植物-土壤系统的内在关联, 揭示连作条件下花生病害发生的机理具有重要价值。
三维荧光光谱(three dimension excitation-emission matrix fluorescence spectroscopy, 3DEEM)技术因其具有表征简便、 灵敏度高、 用量少、 不破坏样品结构等特点广泛用于表征DOM的荧光性质, 结合平行因子方法(parallel factor analysis, PARAFAC)能定性区分和定量测定DOM荧光组分含量和特征[6]。 本研究通过多点采集连作地花生的健康植株与发病植株, 利用3DEEM-PARAFAC方法研究DOM组成及荧光特性, 解析病理上不同健康状态花生根际土壤DOM的组成结构差异, 以期深入认识根际DOM特征及其与花生健康状态的关系, 为科学制定连作花生土传病害的调控方案提供新思路。
1 实验部分
1.1 研究区概况
采样区域选择在江西省鹰潭市余江县(116°55′E, 28°15′N)。 该区域属亚热带季风气候区, 年平均温度17.6 ℃, 年降雨量1 795 mm, 无霜期261 d。 土壤发育于第四纪红黏土和第三纪红砂岩风化物。
1.2 方法
1.2.1 样品采集
于2019年6月底在江西省余江县多点采集土壤和花生植株样本。 样点选择的条件为: (1)样地为多年连作花生地; (2)每块样地面积>667 m2; (3)每对花生病株和健康植株的采样地块应处于相邻位置; (4)病株采样地花生发病率>50%; 而健康植株采样地中花生应无明显发病症状。 基于以上原则, 分别选择9对发病病株和健康植株采样点, 共计18个样点。 每个采样点取10个样本(完整花生植株和土壤样本)组成一个混合样品, 采用抖落法收集植株根际土壤。 无菌塑料袋分别封装, 及时运回实验室。 土样简单处理后过4mm筛, 保存于4 ℃冰箱中备用, 尽快用于微生物量碳(MBC)和可溶性有机碳(DOC)以及三维荧光的测定; 另1份过2 mm筛, 自然风干, 用于土壤基础性质的分析。 称量花生全株鲜重代表花生生物量。
1.2.2 土壤基本性质测定
参考鲁如坤[7]《土壤农业化学分析方法》测定土壤pH、 土壤有机碳(SOC)、 全氮(TN)、 速效氮(AN)、 全磷(TP)、 速效磷(AN)、 全钾(TK)、 速效钾(AK)。
土壤微生物生物量碳(MBC)采用氯仿熏蒸-K2SO4浸提法测定, 提取液中的有机碳用碳氮自动分析仪(Multi N/C 3100, Analytik Jena, Germany)测定, 熏蒸与未熏蒸土壤有机碳含量差值计算为微生物量碳的值, 换算系数为0.45。 未熏蒸土壤的K2SO4提取液中有机碳作为溶解性有机碳(DOC)进行分析[8]。
1.2.3 三维荧光测定
DOM三维荧光测定[9-10]: 对提取的DOM溶液使用超纯水按比例稀释, 保证可溶性有机物在相同的浓度范围(以254 nm吸光度0.10为参照), 降低荧光猝灭作用。 三维荧光测量使用日立F-7000荧光光谱仪, 激发波长范围设置为200~450 nm, 发射波长范围设置为250~600 nm, 分别以5和1 nm为增量, 激发发射狭缝5 nm; 扫描速度为2 400 nm·min-1。 将样品的扫描数据减去超纯水的三维荧光数据, 以校正拉曼散射的影响。 利用吸光度数据对样品的荧光激发-发射矩阵(EEM)进行校正, 消除内滤效应, 样品的荧光强度用超纯水单位进行归一化。
根据以往的研究[6, 10-11], McKnight指数使用激发波长为370 nm时450与500 nm处的发射强度比值。 生物源指数(BIX)使用激发波长Ex为310 nm时380与430 nm处的发射强度的比值; 腐殖化指数(HIX)为激发波长255 nm处发射波长435~480 nm处荧光强度峰值与300~345与435~480 nm荧光强度峰值和荧光强度的比值。 荧光强度比值r为2个荧光峰值(荧光峰的最大荧光强度)的比值。
使用平行因子分析(PARAFAC)方法对荧光组分进行表征分析, PARAFAC方法可对复杂的DOM混合体系进行组分分解, 参考Stedmon等研究方法[12], 解析土壤DOM荧光组分和荧光特征。 用每个样品中各鉴定组分的最大荧光强度(Fmax)计算组分比例分数进行后续分析。 使用荧光组分构成和荧光指数表示荧光性质。
1.3 数据分析
采用Microsoft Excel 2019, R-3.6.3, Origin Pro2018和MATLAB 2020对实验数据进行统计分析。 利用MATLAB 2020软件和DOMFluor软件包(www.models.life.ku.dk)进行PARAFAC分析, 荧光组分特征峰在Origin Pro2018软件上利用峰值分析功能识别。 若无特别标注, 均使用t-test检验组间差异。 以下分析方法基于R语言, 利用corrplot包使用“spearman”方法进行相关性分析, vagen包进行主坐标轴分析(PCoA)和方差分解分析(VPA), ggplot2包绘图。 主坐标轴分析(PCoA)分析DOM荧光性质的组间变化, Adonis函数置换检验。 采用正向选择筛选对DOM荧光组分相关的因素。 采用方差分解分析获得解释变量对DOM结构的方差变异的解释贡献度。
2 结果与讨论
2.1 花生生物量与根际土壤基本性质
健康花生植株新鲜生物量平均为(159.67±11.98)g·株-1, 发病花生平均为(107.44±10.07)g·株-1, 发病组花生生物量明显低于健康组(p<0.01, 表1)。 花生病害显著影响花生生物量大小, 因此花生生物量是有效表征花生病害的生物学指标, 在后续分析中, 利用样本间生物量的变化来表征花生植株健康状况。
发病组与健康组花生根际土壤的各基础性质, 包括pH、 总氮(TN)、 总磷(TP)、 总钾(TK)、 速效氮(AN)、 速效磷(AP)、 速效钾(AK)、 有机质(OM)、 可溶性有机碳(DOC)以及土壤微生物量碳(MBC)均无显著差异(p>0.05, 表1)。

表1 花生生物量与根际土壤基本性质
植物发病与否与土壤的基本性质, 尤其是与单项指标之间, 可能并不存在直接的因果关系。 植物的健康状态很大程度上取决于土壤养分与微生物群落的平衡, 发病植物往往伴随着根际大量有害微生物的富集、 有益微生物的减少[4], 这可能是造成本研究中花生健康状态差异化的重要因素。 土壤微生物群落中病原菌-有益菌的均衡, 是土壤中各项环境因子综合作用的结果。 虽然本研究结果土壤基本性质组间未表现出显著差异, 但不能因此认定花生的健康状态与土壤基本性质无关, 明确它们之间的关系还需要进一步研究。
2.2 PARAFAC解析根际DOM三维荧光光谱
利用PARAFAC方法将三维荧光光谱识别为五种组分[13][图1(A)]。 组分1 (C1)在激发/发射波长255/347 nm处出现一个荧光峰(T峰), 其特征与类色氨酸组分相似。 组分2 (C2)在激发/发射波长255/441和345/441 nm处出现了两个荧光峰(A峰和C峰), 主荧光特征类似于富里酸。 组分3 (C3)在激发/发射波长235/414和320/ 414 nm处有两个荧光峰(A峰和M峰), 其荧光特征类似于微生物腐殖质[14]。 组分4 (C4)在激发/发射波长275/490 nm处有1个类腐殖质荧光峰(C峰), 相比于C2出现了较大“红移”, 腐殖质成分具有更高的分子量, 分子结构共轭度和化学稳定性更高, 分析认为主要是类胡敏酸成分, 定义为类腐殖酸。 组分5 (C5)在激发/发射波长225/334和275/334 nm处有两个荧光峰(B1峰和B2峰), 荧光特征类似于蛋白质类, 来自于自生过程, 通常认为是酪氨酸类蛋白质荧光。
为了验证PARAFAC模型的有效性, 采取基于两个半数集和全数集发射波长和激发波长载荷量的方法对模型进行验证[图1(B)], 各载荷量重合较好, 满足“解的唯一性”, 说明基于PARAFAC模型划分的DOM结构具有较高的可靠性。
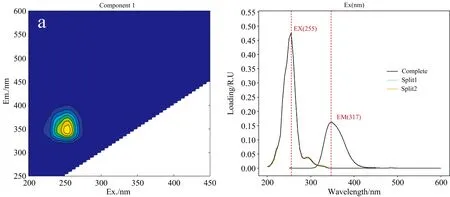
图1 DOM组分荧光谱图的PARAFAC模型输出及验证结果: 左侧图为(A); 右侧图为(B)
2.3 健康与发病花生根际土壤DOM荧光性质差异
花生健康组C1组分平均荧光强度占比超过50%, 而发病组仅约25%。 组间检验结果表明, 健康组中C1的相对荧光强度显著高于发病组, 而其他组分的相对荧光强度均为发病组显著高于健康组(p<0.05, 图2)。 荧光强度比值r(A/C)值可用来反映DOM中腐殖组分发育程度, 发病组r(A/C)均值为(2.16±0.16), 健康组均值为(4.02±0.55), 组间显著不同(p=0.005)。 类蛋白荧光与类腐殖质荧光的比值r(T/C)可用以评价内源贡献比重, 发病组r(T/C)均值为(1.11±0.10), 而健康组均值为(2.12±0.29), 组间r值显著不同(p=0.005)。
Mcknight指数可表征DOM的来源[10], Mcknight指数接近1.4时, DOM主要来自植物残体等植物源输入; McKnight指数接近1.9时, DOM主要来自于微生物过程, 如微生物代谢和降解产物、 微生物残体等。 花生根际土壤DOM的McKnight指数均在1.4~1.9之间, 但更接近于1.9(图2), 说明根际DOM成分具有微生物代谢和植物体残留的混合来源, 但主要来源于生物分解的内源过程, 分子芳香程度较低, 本研究中发病组与健康组之间的Mcknight指数差异不显著(p>0.05)。 BIX指数通常代表DOM的本地生物活性(即生物可利用性的高低), 反映了新产生的DOM在整体DOM中所占的比例。 发病组的BIX显著低于健康组(p<0.01, 图2), 说明健康组DOM较高的生物活性和新鲜度, 物质转化更为活跃。 HIX指数代表DOM的腐殖化程度, 健康组和发病组土壤DOM的HIX平均值分别为(1.87±0.25)和(0.98±0.09), 两组HIX指数均较低, 表明根际土壤 DOM 的腐殖化程度都不高, 主要由微生物活动产生。 然而, 健康组HIX指数显著高于发病组(p<0.05, 图2), 与BIX指数一致。
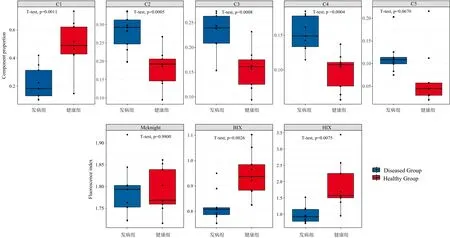
图2 荧光性质组间差异
依据“病害三角理论”, 病原菌对宿主的成功侵染是病原菌、 宿主和环境因素的综合结果[15], 健康与发病花生根际土基本性质无显著差异, 但DOM的各荧光组分在组间表现出了显著差异(图2)。 提高土壤有机质含量是公认的培肥土壤、 改善土壤性质的有效途径, 但在植株根际土壤有机质的组成特性可能比有机质含量更敏感。 健康花生根际土壤DOM的平均荧光总强度远高于发病组平均荧光总强度(数据未列出), 表明健康花生的根际土壤DOM中含有更高的有色可溶性有机物(CDOM)。 CDOM作为DOM主要活性成分, 是有机质转化过程的重要中间物质。 发病组CDOM含量较少, 可能是因为发病花生根系分泌物减少, 根际物质转化活动可能也处于较低水平。 DOM生物活性与其分子量和类蛋白组分的比例有关[16], 健康组DOM组分中C1类色氨酸组分显著高于发病组, 可能与有益微生物产生的大量蛋白类抑菌物质有关[17-18], 高蛋白质组分比例暗示着土壤较高的氮素生物有效性, 有利于微生物和植物生长。 除DOM的组成外, 健康植物与花生病株根际土壤DOM的荧光指标也存在显著差异(图2)。 健康花生根际土壤DOM的BIX和HIX指数更高, 说明其具有更强的生物活性、 新鲜度和腐殖化程度。 健康组根际DOM的类色氨酸峰T平均发射波长(349 nm)相较于发病组(346 nm)存在显著红移现象(p=0.022), 表明发病组根际DOM类色氨酸蛋白质芳香度及分子量小于健康组, 与HIX结果一致; 健康组r(T/C)比值显著高于发病组, 比值越大表明受微生物活动等内源活动影响越大, 物质转化越活跃, 结果与BIX指数一致。 高腐殖化程度和生物活性的DOM有利于土壤微生物尤其是有益微生物的生长, 是作物健康、 旺盛生长的重要保障[1]。 因此, 健康植株根际土壤DOM特性中高BIX和HIX指数可能是花生健康生长、 抵抗病原微生物入侵的重要指标。 基于Bray-Curtis距离的主坐标轴分析(PCoA)也显示(图3), 健康与发病花生根际土壤DOM荧光性质分异明显, 且主要在第一主轴分开, 使用3DEEM-PARAFAC表征的根际土壤DOM性质可有效区别花生健康状态。

图3 荧光性质主坐标轴分析
2.4 影响花生根际DOM组成的主要因素
植株生物量往往直接受病害影响而显著下降, 是花生健康状态的一个重要生物学表现。 相关性分析表明, DOM各荧光组分均与花生生物量呈显著相关性(p<0.01), 除C1与花生生物量呈显著正相关外, 其他组分均与花生生物量呈显著负相关(图4)。 根际土壤基本性质中, 仅有AP和AN与DOM的部分荧光组分存在显著相关性(p<0.05), 但相关性系数低于生物量与荧光组分的相关性。 Mcknight指数与花生生物量无显著相关性, 但与多数土壤性质指标有较强的正相关关系, 表明根际土壤营养元素与DOM来源密切相关, 偏向于微生物的内源过程产生, 即主要来源于有机质的分解转化过程。 BIX指数和HIX指数与花生生物量呈显著正相关(p<0.01), 而与土壤性质的相关性很弱。

图4 DOM荧光性质与花生生物量及土壤性质的相关性
利用正向选择和方差分解分别解析花生生物量与土壤性质对DOM组成变异的贡献。 正向选择结果中, DOM组成的变异对花生生物量有显著响应(R2=0.429,p<0.001); 而DOM组成的变异仅对土壤性质中的AP有显著响应(R2=0.217,p=0.031)。 方差分解结果表明, 花生生物量可极显著解释DOM组成变异(p<0.001), 且解释量高达40.00%; 土壤环境因子(AP)对DOM组成变异的解释量为7.46%, 但无显著性(图5)。 花生生物量与土壤环境因子的交互解释量为8.55%, 未解释部分为44.00%。

图5 DOM组成的方差分解
花生植株的生物量与根际DOM组成呈显著相关(图4), 且对根际DOM变异的贡献远高于土壤性质(图5), 说明花生根际DOM的组成变异主要受到植株的调控, 与花生生长发育状况密切相关。 花生在生长发育过程中向根际土壤中源源不断的输入根际沉积物, 含有种类繁多的有机物质, 作为土壤有机质的主要来源, 不仅与植物生长状况及土壤质量的变化关系密切[19], 而且植物可以通过改变根系分泌物来招募有益的根际群落影响根区微生物群落[20], 进而造成有机物质转化过程变化。 本研究中DOM组分与有效磷存在显著相关性, 虽然对DOM组成变异的直接解释量不显著, 但有效磷可能间接影响根区土壤-微生物互作关系, 本实验室已有工作认为土壤中有效磷对土壤菌群互作的影响可能是影响某些病害发生的途径。 因此, 协同调控DOM组分组成和有效磷含量可能是控制花生发病的有效途径。
根际土壤的DOM组成, 尤其是BIX和HIX指数可能影响花生植株的生长状况; 而花生植株的生长状况也直接调控根际土壤DOM的组成, 说明花生的生长状况与根际DOM组成之间存在相互调控的关系。 虽然本研究在DOM荧光光谱特征上揭示了根际荧光组分与花生生长状况的强相互作用, 但不能明确花生的健康状态在多大程度上调控了根际土壤的DOM组成, 及根际土壤DOM的组成差异在多大程度上影响了花生生长, 需要进一步研究。 但可以肯定的是, 本研究使用荧光光谱技术从根际土壤DOM组成的角度判别花生健康状态, 可为理解连作障碍的形成机制提供理论参考。
3 结 论
将荧光光谱学分析应用于根际土壤生物与非生物相互关系研究中, 结果表明使用3DEEM-PARAFAC方法可以有效表征不同健康状态花生根区DOM特性的差异。 虽然连作地花生健康和发病植株根际土壤的基本性质差异不明显, 但DOM的组成则显著不同。 健康植株根际土壤DOM特性中高BIX和HIX值表征的有机质高腐殖化与高生物活性可能是花生健康生长、 抵抗病原微生物入侵的重要因素。 花生生长状况与根际土壤DOM之间存在相互作用, 这可为认识花生土传病害发生机理提供新的视角。

