海带中抑藻活性化合物的分离及抑藻活性分析
孙颖颖 ,朱文轩 ,周静,庄丽雯,毛奕淋,赵秀芳,王长海
(1.江苏海洋大学 江苏省海洋生物技术重点实验室,江苏 连云港 222005;2.江苏海洋大学 江苏省海洋生物产业技术协同创新中心,江苏 连云港 222005;3.江苏省海洋资源开发研究院,江苏 连云港 222000;4.连云港市质量技术综合检验检测中心,江苏 连云港 222005;5.南京农业大学 资源与环境科学学院,江苏 南京 210095)
1 引言
赤潮已成为三大世界性近海污染问题之一,对近海水域生态环境和海洋养殖业造成了极大的威胁[1-2]。报道表明,在300 多种可形成赤潮的海洋浮游微藻中,超过70 种能产生毒素[3],藻毒素导致了鱼类、贝类和其他海洋生物的大量死亡[1],也会引发人类疾病,甚至导致死亡。国内外研究者提出了许多预防和控制赤潮的方法(Prevent and Control HABs Methods,PCM),包括物理法(黏土[4])、化学法(表面活性剂[5])、生物法(病毒[6]、细菌[7]和杀藻[8]或抑藻化合物[3,9])等。
近30 年来,分离自大型海藻的一些抑藻活性化合物,被认为是开发环境友好型赤潮微藻抑藻剂的理想材料之一[10-11]。例如,小珊瑚藻(Corallina pilulifera)中的溴仿[12]、江蓠(Gracilaria lemaneiformis)中的8-hydroxy-4E 和6E-octadien-3-on[13]、网地藻(Dictyota dichotoma)中的Dictyolactone[14]、叶状铁钉菜(Ishige sinicola)中的α-单甘酯[15]以及条斑紫菜(Porphyra yezoensis)中的gossonorol[16]等。在前期工作中,我们整理了1960-2019 年被Web of Science、Springer、Google Scholar 和CNKI 等数据库收录的大型海藻抑藻研究,发现120 多种可抑制赤潮微藻生长的大型海藻中,大型褐藻为40 种[10],它们依次归属于网地藻目(Dictyotales)、水云目(Ectocarpales)、墨角藻目(Fucales)、铁钉菜目(Ishigeales)、海带目(Laminariales)和线翼藻目(Tilopteridales)(图1)。其中,海带目的大型褐藻占20%,例如,腔昆布(Ecklonia cava)[17]、鹅掌菜(Ecklonia kurome)[18]、Eckloniopsis radicosa[15]、笼目海带或日本厚叶海带(Kjellmaniella crassifolia)[19]、海带(Laminaria japonica)[19-22]、掌状昆布(Laminaria digitata)[20]、皱海带(Laminaria religiosa)[23]、裙带菜(Undaria pinnatifida)[21]。
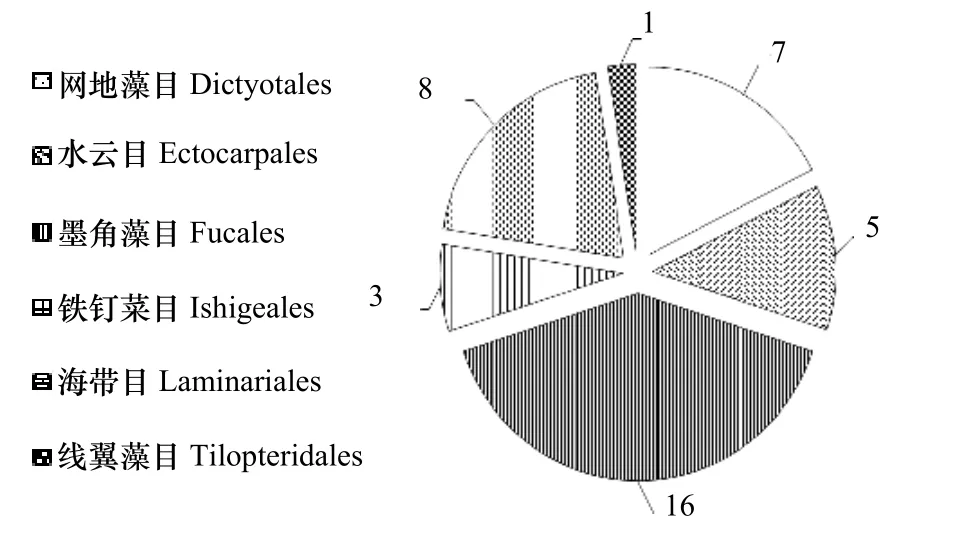
图1 可抑制赤潮微藻的大型褐藻的目类归属分布Fig.1 Distribution of brown marine macroalgae with antialgal activity against red tide microalgae according the orders
不同研究者已经发现海带(L.japonica)对某些海洋微藻具有一定的抑藻活性[19-22],李凤超[19]对海带中防污物质进行了初步分离和鉴定。然而,目前为止,并未见抑藻活性化合物从海带中分离获得。基于此,本文采用活性追踪分离方法,以米氏凯伦藻为抑藻检测对象,从海带中分离抑藻活性化合物。进一步,分析它们对塔玛亚历山大藻(Alexandriumtamarense)、强壮前沟藻(Amphidinium carterae)、赤潮异弯藻(Heterosigma akashiwo)、米氏凯伦藻(Karenia mikimotoi)、球形棕囊藻(Phaeocystis globsa)和中肋骨条藻(Skeletonema costatum)生长的抑制作用,获得每种化合物对赤潮微藻生长的半抑制效应浓度(EC50~96h),为环境友好型赤潮微藻抑藻剂的研发奠定实验基础和提供技术支撑。
2 材料与方法
2.1 实验材料
塔玛亚历山大藻、强壮前沟藻、赤潮异弯藻、米氏凯伦藻、球形棕囊藻和中肋骨条藻无菌株由上海光语生物科技有限公司提供,在f/2 培养基中培养,培养温度为(22±2)℃,光照强度为40 μmol/(m2·s),光暗比为12 h∶12 h。
天然海水静置1 个月以上,经脱脂棉和300 目筛绢过滤,高温灭菌、冷却,使用前将pH 和盐度分别调节至8.5 和30 备用。
海带半干品购置于江苏碧蓝海洋生物科技有限公司,自来水清洗后,室内自然晾晒2 d。50℃下烘干后,粉碎至0.3 mm 粒径备用。
2.2 抑藻活性化合物的分离纯化
2.2.1 提取
将海带干粉末2 000 g 和6 L 甲醇加入到动态热回流提取浓缩机(TX-NX-10)中,在30℃下浸提6 h。上述浸提过程重复3 次,合并浸提液。浸提液经过滤和减压蒸干,得到黑色黏稠状浸膏68.22 g。向此浸膏中加入90%甲醇水溶液300 mL,充分振荡,4℃下静置过夜,4℃下离心10 min、过滤,去除沉淀,获得上清液280 mL。60℃下减压蒸干后,溶解于蒸馏水中,配制浓度为80 g/L 溶液(提取物溶液)进行抑藻活性检测和液液萃取分离。抑藻活性检测时,提取物浓度依次设定为1.0 mg/mL、2.0 mg/mL、4.0 mg/mL、8.0 mg/mL和16.0 mg/mL。
2.2.2 液液萃取分离
将乙酸乙酯加入到上述提取物溶液中,萃取3 次,乙酸乙酯加入体积依次为60 mL、20 mL 和20 mL。乙酸乙酯层合并收集后,然后在40℃下减压蒸干,获得2.58 g 组分A。下层40℃下减压蒸发除去乙酸乙酯后,加入正丁醇萃取3 次,正丁醇加入体积依次为60 mL、20 mL 和20 mL。上层和下层均在60℃下减压蒸干,分别获得2.23 g 组分B 和11.34 g 组分C。上述3 种液液萃取分离组分,分别溶解于无水甲醇中,制备浓度为20 g/L 的溶液进行抑藻活性检测(液液萃取分离组分浓度设定为2 mg/mL)和硅胶柱层析分离。
2.2.3 硅胶柱层析分离
组分B 加载于硅胶柱(200~300 目,3.0 cm×40 cm)上,以氯仿和甲醇(体积比为1∶5,以下均为体积比)为洗脱液,流速为1.0 mL/min,每管接收馏分10 mL。组分C 采用硅胶层析柱(200~300 目,5.0 cm×80 cm)进行分离,氯仿和甲醇(1∶5)为洗脱液,流速为1.0 mL/min,每管接收馏分20 mL。洗脱2 倍柱体积后,所得馏分40℃下减压浓缩,进行硅胶GF254薄层层析检测,展开剂为氯仿和甲醇(1∶10)。合并相同馏分后,40℃下减压蒸干除去溶剂,获得再分组分B1和B2、再分组分C1、C2和C3。上述5 个组分分别称取10 mg,依次溶解于1 mL 甲醇溶液中,配制浓度为10 g/L 的溶液。进行抑藻活性检测时,再分组分浓度设定为1.0 mg/mL。结果表明,3 个再分组分(B1、B2和C2)对米氏凯伦藻具有较为明显的抑藻活性。
2.2.4 Sephadax LH-20 凝胶柱层析分离
将上述3 个再分组分分别加载于Sephadax LH-20 凝胶层析柱上(2.0 cm×25 cm),均以甲醇为洗脱液。洗脱2 倍柱体积后,所得馏分40℃下减压浓缩,经硅胶GF254薄层层析检测,合并、减压蒸干后,依次获得凝胶分离组分B11、B12、B13、B21(0.56 g)、C21和C22。将它们分别称取5 mg,溶解于0.5 mL 甲醇中,进行抑藻活性检测,浓度设定为0.25 mg/mL。结果表明,凝胶分离组分B13、B21和C21显著地抑制了米氏凯伦藻的生长(其中,B21已经完成分离纯化)。
2.2.5 薄层层析纯化制备
采用划线法将凝胶分离组分B13和C21加载于硅胶薄层层析预制板(100 mm×200 mm)上,分别以石油醚和乙酸乙酯(1∶2)及氯仿和甲醇(4∶1)为展开剂。经展开,凝胶分离组分B13和C21分别在硅胶预制板上呈现2 个清晰且相距较明显的条带。将相应条带分别刮下收集,用丙酮浸泡,过滤和减压蒸干后,制备得到样品B131(0.24 g)、B132(0.19 g)、C211(0.008 g)和C212(0.011 g)。适量称取5 个样品,分别溶解于甲醇溶液后,点样于硅胶GF254上,依次以氯仿和甲醇(1∶1)、环己烷和乙酸乙酯(1∶2)及正丁醇和醋酸和水(1∶1∶0.5)为展开剂进行展开,发现此5 个样品均呈现单一斑点;同时,采用通用型显色剂(10%硫酸溶液和碘)检测,发现它们同样呈现单一斑点,表明纯度达到了薄层纯。抑藻活性检测时,样品浓度设定为0.25 mg/mL。
2.3 结构鉴定
采用高分辨电喷雾质谱(HR-ESI-MS)和核磁共振谱(1H-NMR 和13C-NMR)鉴定样品结构。LTQObitrap XL 光谱仪测定HR-ESI-MS,Bruker AV Ⅲ 600质谱仪测定NMR(四甲基硅烷(TMS)为标准品)。
2.4 抑藻活性
2.4.1 分离纯化过程中抑藻活性检测
在分离纯化过程中,以米氏凯伦藻为抑藻活性测试微藻,接种细胞数量为(10~12)×104cells/mL。将待测组分溶解于甲醇后,移取1 μL 到微藻培养体系(米氏凯伦藻1 mL+f/2 培养基9 mL),终浓度按照以上相应分离过程进行设定。对照组为10 mL 培养体系中加入1 μL 甲醇,每个实验设定3 个平行样。所有培养瓶置于光照培养箱中进行培养,温度为(22±2)℃,光照强度为62 μmol/(m2·s),光暗比为12 h∶12 h,培养10 d。
2.4.2 抑藻化合物对赤潮微藻的抑藻活性分析
将化合物(市售,分析纯)溶解于甲醇溶液,配制浓度为250mg/mL,再依次稀释为50mg/mL、10mg/mL和2mg/mL。分别量取1μL上述溶液,加入到4999μL培养体系中(赤潮微藻500μL+f/2培养基4499μL),化合物终浓度依次为50μg/mL、10μg/mL、2μg/mL和0.4μg/mL。塔玛亚历山大藻、强壮前沟藻、赤潮异弯藻、米氏凯伦藻、球形棕囊藻和中肋骨条藻的起始细胞数量分别为(8~10)×104cells/mL、(20~24)×104cells/mL、(8~11)×104cells/mL、(10~14)×104cells/mL、(45~49)×104cells/mL 和(26~29)×104cells/mL。对照组为4 999 μL 培养体系中加入1 μL 甲醇溶液,每个实验设定3 个平行样。同时,设定相同浓度的硫酸铜作为阳性对照组。所有培养瓶置于光照培养箱中进行培养,培养4 d,其他培养条件同2.4.1 节。同时,显微镜下(×400)观察藻细胞形态。
2.5 实验指标测定
每日取样,计数赤潮微藻细胞数量,计算抑藻剂对赤潮微藻的生长抑制率(I),计算公式为
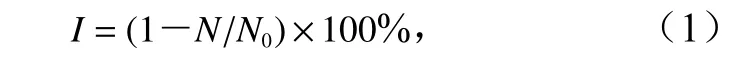
式中,N为处理组藻细胞数量;N0为对照组藻细胞数量。
采用文献[24]的方法计算硫酸铜和化合物对赤潮微藻生长的EC50~96h。
2.6 数据处理
实验数据采用SPSS 11.5 软件包进行独立样本检验统计分析,p<0.05 为显著性差异,p<0.01 为极显著性差异。
3 结果和分析
3.1 海带中抑藻活性化合物活性追踪的分离纯化
3.1.1 海带提取物对米氏凯伦藻生长的影响
从图2 可以看出,随浓度增加,海带提取物对米氏凯伦藻生长的抑制作用明显增强(p<0.05)。当浓度为8.0 mg/mL 时,提取物对米氏凯伦藻的生长抑制率为56.2%(第10 天)。结果表明,海带提取物具有明显抑制米氏凯伦藻的抑藻活性,需要进行后续分离。
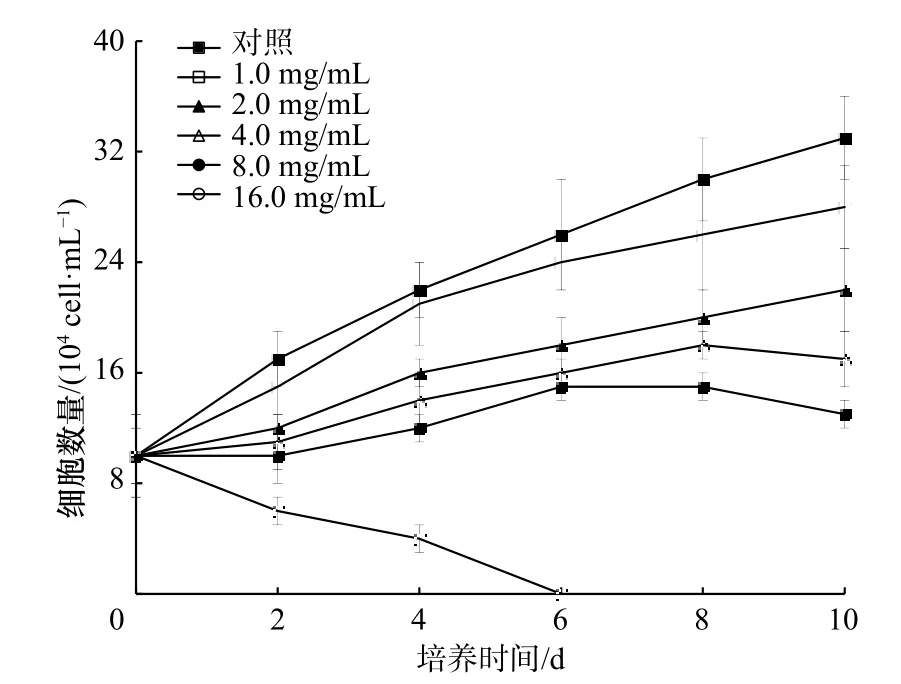
图2 海带甲醇提取物对米氏凯伦藻生长的影响Fig.2 Effect of the methanol extracts of Laminaria japonica on the growth of Karenia mikimotoi
3.1.2 液液萃取分离组分对米氏凯伦藻生长的影响
在图3 中,组分B 和组分C 明显抑制了米氏凯伦藻的生长(p<0.05)。第10 天时对米氏凯伦藻的生长抑制率超过76%。因此,将组分B 和组分C 进行硅胶柱层析分离。
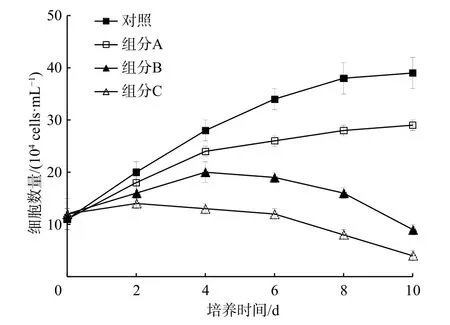
图3 液液萃取分离组分对米氏凯伦藻生长的影响Fig.3 Effect of several liquid-liquid extraction components from the methanol extracts on the growth of Karenia mikimotoi
3.1.3 硅胶柱层析和Sephadax LH-20 凝胶柱层析分离组分以及薄层层析纯化样品对米氏凯伦藻生长的影响
由表1 可知,组分B 和组分C 经硅胶柱层析分离后,得到5 个再分组分。抑藻活性检测表明,再分组分B1、B2和C2对米氏凯伦藻具有明显的抑藻活性(p<0.05)。
将上述3 个再分组分B1、B2和C2分别进行Sephadax LH-20 凝胶柱层析分离,组分B1分离为B11、B12和B13;组分B2分离为B21;组分C2分离为C21和C22(表1)。在6 个组分中,B13、B21和C21均对米氏凯伦藻生长表现出明显的抑制作用(p<0.05),其中B21薄层层析检测显示仅有1 个斑点。随后,将B13和C21进行硅胶薄层层析制备,
经薄层层析纯化制备,得到4 个样品,B131、B132、C211和C212(表1)。浓度为0.05 mg/mL 时,它们对米氏凯伦藻的生长表现出明显的抑藻活性(p<0.05)。
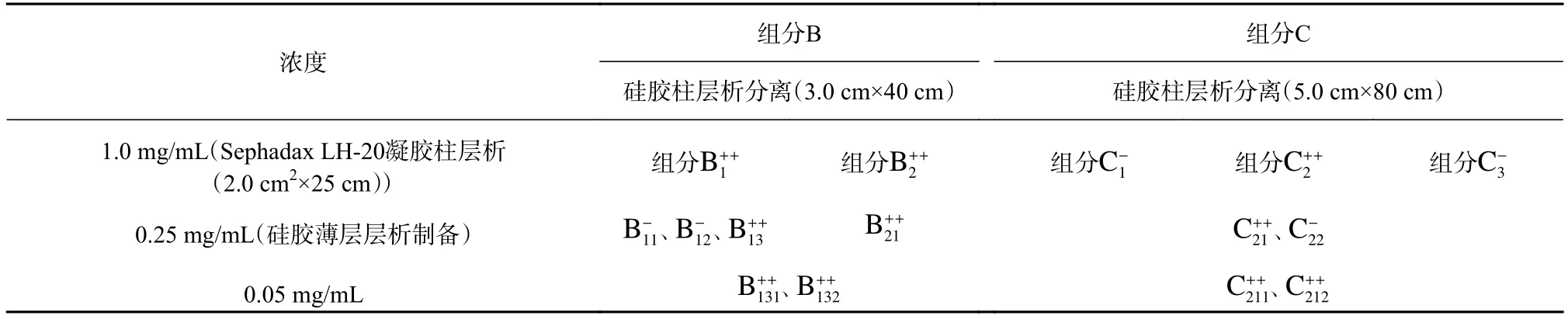
表1 组分B 和组分C 的分离纯化过程中抑藻活性检测Table 1 Antialgal activity test of the fractions B and C in the isolation and purification process
综上,采用一系列分离方法,从海带中纯化到对米氏凯伦藻的生长具有抑制作用的活性化合物,分离纯化具体过程见图4。
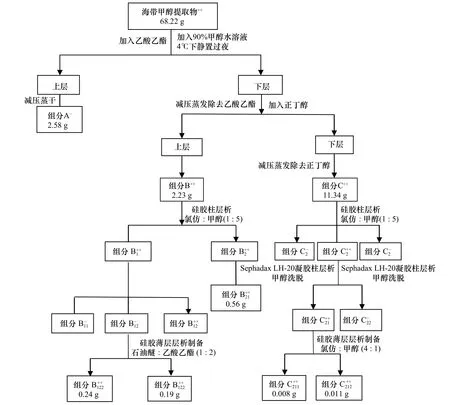
图4 海带中抑藻活性化合物的分离纯化Fig.4 Isolation and purification of the antialgal compounds from Laminaria japonica
3.2 结构鉴定
样品B131,无色粉末。1H-NMR (600 MHz,DMSOd6)δH:3.51 (2H,t,J=6.0 Hz,H-7);13C NMR (150 MHz,DMSO-d6)δC:177.2 (C-11)、41.8 (C-2)、23.4 (C-3)、30.4(C-4)、30.2 (C-5)、36.8 (C-6)、63.5 (C-7)。以上数据与文献[25]基本一致,故鉴定样品B131为7-羟基庚酸。
样品B132,无色粉末。1H-NMR (600 MHz,DMSOd6)δH:0.88 (3H,t,J=6.6 Hz,H-14)、2.35 (2H,m,H-2);13C-NMR (150 MHz,DMSO-d6)δC:177.9 (C-1)、33.8 (C-2)、24.9 (C-3)、29.2 (C-4)、29.4 (C-5)、29.9 (C-6)、29.7(C-7)、29.6 (C-8)、31.4 (C-9)、29.5 (C-10/11)、32.1 (C-12)、22.8 (C-13)、14.3 (C-14)。这些数据与十四酸的光谱数据基本一致[26],因此,将样品B132鉴定为十四酸。
样品B21,白色粉末。1H-NMR (600 MHz,DMSOd6)δH:2.32 (2H,t,J=7.8 Hz,H-2)、1.63 (2H,m,H-3)、0.87 (3H,t,J=7.2 Hz,H-16);13C-NMR (150 MHz,DMSO-d6)δC:179.3 (C-1)、34.2 (C-2)、25.1 (C-3)、29.5(C-4)、29.6 (C-5)、29.8~30.1 (C-6~12)、29.8 (C-13)、32.3 (C-14)、23.1 (C-15)、14.5 (C-16)。样品B21的核磁共振谱的数据与文献[27]基本一致,因此,鉴定其为十六酸。
样品C211(白色蜡状固体),1H-NMR (600 MHz,DMSO-d6)δH:2.31 (2H,t,J=7.8 Hz,H-2)、1.63 (2H,m,H-3)、1.28 (28H,m,H-4~H-17)、0.88 (3H,t,J=7.2 Hz,H-18);13C-NMR (150 MHz,DMSO-d6)δC:177.1 (C-1)、34.0 (C-2)、31.9 (C-16)、29.1~29.7 (C-4~C-15)、24.7(C-3)、22.7 (C-17)、14.5 (C-18)。这些数据与文献[28]一致,故将样品C211鉴定为十八酸。
样品C212,无色油状物。1HNMR (600 MHz,MeOD)δH:0.86 (3H,t,J=6.6 Hz,H-18)、1.23 (8H,m,m,H-4~H-7),1.24 (20H,m,H-12~H-17)、1.61 (2H,m,H-3)、1.94(4H,m,H-8,11)、2.33 (2H,t,J=7.2 Hz,H-2)、5.28 (2H,dd,J=8.4,5.4 Hz,H-9,H-10)。以上数据与油酸的核磁共振谱数据基本一致[29]。
3.3 5 种化合物对6 种赤潮微藻的抑藻活性分析
在图5 中,5 种化合物对6 种赤潮微藻生长表现出明显的选择性抑制作用,其中7-羟基庚酸表现出最为强烈的抑制作用(p<0.05),且这种抑制作用随着浓度的增加而明显增强(p<0.05)。第4 天,在浓度为50 μg/mL 时,7-羟基庚酸对塔玛亚历山大藻、强壮前沟藻、赤潮异弯藻、米氏凯伦藻、球形棕囊藻和中肋骨条藻的生长抑制率分别为53.3%、84.3%、71.2%、72.3%、74.4%和87.5%;十四酸明显地抑制了强壮前沟藻、米氏凯伦藻和中肋骨条藻的生长(p<0.05),在浓度50 μg/mL 时,对它们的生长抑制率超过52%(第4 天);十六酸仅明显抑制了强壮前沟藻的生长(p<0.05),对强壮前沟藻的生长抑制率为52.5%(50 μg/mL,第4 天),对其他5 种赤潮微藻的生长抑制率低于40%;十八酸和油酸对6 种赤潮微藻没有明显的生长抑制作用(p>0.05),在浓度为50 μg/mL 时,对它们的生长抑制率低于40%。
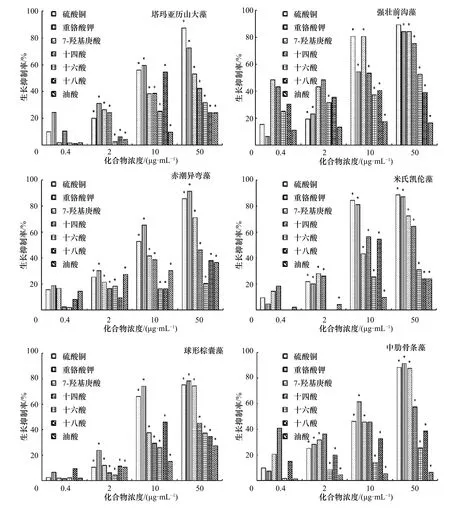
图5 不同化合物对6 种赤潮微藻生长的抑制作用Fig.5 Growth inhibition of the different compounds against six species of red tide microalgae
进一步,计算得出了7-羟基庚酸等5 种脂肪酸对6 种赤潮微藻生长的半抑制效应浓度(EC50~96h)(表2)。硫酸铜和重铬酸钾是藻类毒性实验中常用的阳性对照组,硫酸铜对6 种赤潮微藻生长的EC50~96h在表2列出,由前期研究可知,重铬酸钾对强壮前沟藻、赤潮异弯藻、米氏凯伦藻、球形棕囊藻和中肋骨条藻生长的EC50~96h依次为3.9 μg/mL、36 μg/mL、16 μg/mL、38 μg/mL 和2.7 μg/mL[9,30]。除十四酸、十六酸和十八酸对塔玛亚历山大藻生长的EC50~96h已被报道[31],7-羟基庚酸等5 种脂肪酸和硫酸铜对赤潮微藻生长的EC50~96h是第一次被明确。在本文中,十四酸和十六酸对塔玛亚历山大藻生长的EC50~96h与已有报道非常接近[31],但十八酸对塔玛亚历山大藻生长的EC50~96h与已有报道相差很大[31],具体原因目前还在分析中。
国际经合组织(OECD)指出,当EC50~96h分别为小于1 μg/mL、1~10 μg/mL、10~100 μg/mL 和大于100 μg/mL时,化合物对藻类具有极高毒性、高毒性、中等毒性和极低毒性[32]。根据此标准,7-羟基庚酸、十四酸和十六酸对6 种赤潮微藻具有中等或高等毒性,其中7-羟基庚酸对塔玛亚历山大藻和强壮前沟藻、十四酸对强壮前沟藻均为高毒性。与重铬酸钾对赤潮微藻生长的EC50~96h比较,7-羟基庚酸和十四酸对强壮前沟藻、赤潮异弯藻、米氏凯伦藻和球形棕囊藻生长的EC50~96h更小,十六酸对米氏凯伦藻生长的EC50~96h更小,这表明7-羟基庚酸和十四酸在抑制强壮前沟藻等4 种赤潮微藻、十六酸在抑制米氏凯伦藻上比重铬酸钾更具有抑藻优势。同时,从表2 可以看出,7-羟基庚酸和十四酸对强壮前沟藻的EC50~96h明显小于硫酸铜对该赤潮微藻的EC50~96h。综合来看,7-羟基庚酸和十四酸在抑制强壮前沟藻上具有明显优于重铬酸钾和硫酸铜的抑藻优势。
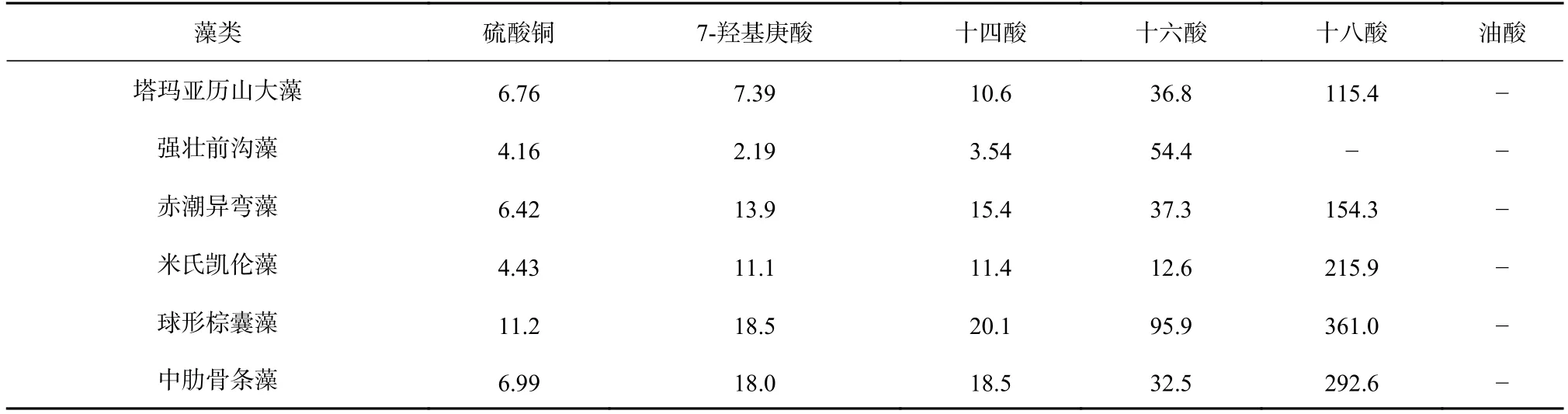
表2 不同化合物对6 种赤潮微藻生长的半抑制效应浓度(EC50~96h,单位:μg/mL)Table 2 Different compounds isolated from Laminaria japonica for the six species of red tide microalgae (EC50-96h,unit:μg/mL)
同时,我们发现在脂肪酸作用下,藻细胞形态发生了某些明显变化。在7-羟基庚酸作用下,强壮前沟藻、赤潮异弯藻、米氏凯伦藻和球形棕囊藻细胞形态改变见图6。在图6 中,能清晰看到强壮前沟藻和赤潮异弯藻细胞膜模糊、类似溶解,横鞭毛脱落,形状改变明显;米氏凯伦藻细胞破碎;球形棕囊藻细胞变长、伴有色素体缺陷等现象。在十四酸和十六酸能明显抑制的赤潮微藻中,藻细胞形态也发现了这些类似的变化。
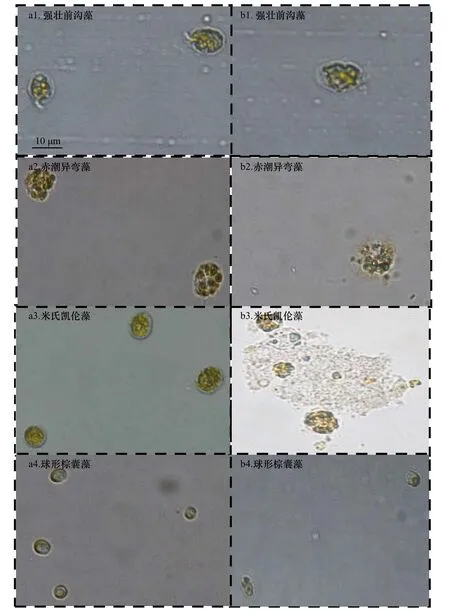
图6 7-羟基庚酸对4 种赤潮微藻细胞形态的影响Fig.6 Effect of 7-hydroxyheptanic acid on the photographs of the four species of red tide microalgae
4 讨论
大型海藻是抑制赤潮微藻活性化合物的良好来源之一[32-35],某些抑藻活性化合物结构已经被鉴定,例如,α-亚麻酸[23,36]、dictyolactone[14]、α-单甘酯[15]、二十二碳酸甲酯[12]等。这些研究表明,大型海藻中抑藻活性化合物结构多样,包括脂肪酸、萜类和其他化合物[12,14-15,23,37-38]。目前,已经从葡萄藻(Botryococcus braunii)[14]、褐藻(Cladosiphon okamuranus)[39]、小珊瑚藻(Corallina pilulifera)[39]、江 蓠(Gracilaria lemaneiformis)[13]、裂片石莼(Ulva fasciata)[23]、孔石莼(Ulva pertusa)[9]和浒苔(Ulva prolifera)[40-41]等大型海藻中分离到脂肪酸类抑藻活性物质(图1)。在本文,采用抑藻活性追踪分离方法(图2 至图4,表1),第一次从海带中分离到7-羟基庚酸、十四酸、十六酸、十八酸和油酸(纯度为薄层纯),其中7-羟基庚酸、十四酸和十八酸是第一次从大型海藻中分离获得。十六酸已从葡萄藻[34]、江蓠[13]、肠浒苔(Ulva intestinalis)[41]和浒苔[40]中分离得到;在龙须菜(Gracilaria lemaneiformis)分离到油酸[42]。
目前,脂肪酸对淡水微藻生长的抑制作用[43-47]和对赤潮微藻生长的抑制作用[12,23,31,34-35,39-41,48-49]已有一些研究报道。在本文中,除塔玛亚历山大藻和赤潮异弯藻外,7-羟基庚酸、十四酸、十六酸、十八酸和油酸对强壮前沟藻、米氏凯伦藻、球形棕囊藻和中肋骨条藻生长的抑制作用是第一次被研究。在脂肪酸对淡水微藻—分散藻羊角月牙藻(Selenastrum capricornutum)急性毒性研究中,研究者认为,脂肪酸的抑藻作用与脂肪酸的碳链长度有关[47]。尹玉丽[31]指出,饱和脂肪酸对塔玛亚历山大藻生长抑制强弱的顺序依次为十四酸、十六酸、十八酸。何宗祥和张庭廷[44]及姜闻新等[45]也认为,脂肪酸的抑藻作用与脂肪酸碳链长度有关。在本研究中,我们发现7-羟基庚酸和十四酸的抑藻活性要明显强于其他3 种脂肪酸的抑藻活性,十六酸、十八酸和油酸仅具有微弱的抑藻活性。然而,十六酸、十八酸和油酸对试验赤潮微藻的抑藻活性并未有明显的强弱差异(图5)。因此,本文研究结果仅在一定程度上符合“脂肪酸碳链越短,抑制作用越强”的说法。同时发现,在浓度为50 μg/mL 时,7-羟基庚酸对强壮前沟藻、赤潮异弯藻、米氏凯伦藻、球形棕囊藻和中肋骨条藻的生长抑制率与硫酸铜和重铬酸钾对此5 种赤潮微藻的生长抑制率接近(第4 天,图3)。
在脂肪酸对微藻生长的抑制作用机理研究中,某些研究者认为,脂肪酸主要通过细胞膜上离子通道的途径产生抑制作用[32,50-51],具体为脂肪酸引起离子通道结构变化,导致细胞膜通透性发生改变,某些重要离子,譬如Ca2+流出,致使藻细胞内与这些离子相关的生理活动受到影响,从而引发藻细胞死亡。进一步研究指出,由于藻细胞质膜中十六酸、亚油酸等脂肪酸含量较高,外加这些脂肪酸时,它们更易与质膜结合导致其构像发生变化,致使藻细胞离子通道结构发生变化[52]。因此,某些研究指出,脂肪酸对微藻生长的抑制作用与试验微藻细胞的脂肪酸组成有关系[44-45,49]。在本研究中,我们发现不同脂肪酸作用下藻细胞出现细胞膜模糊、细胞破碎或色素体缺陷等现象(仅列出7-羟基庚酸作用下藻细胞形态的某些改变,图6),很明显藻细胞受到了脂肪酸不同程度的影响。6 种试验赤潮微藻中,除强壮前沟藻脂肪酸组成未见报道外,其他5 种赤潮微藻中,十六酸含量最高,多数含有十四酸和十八酸,仅塔玛亚历山大藻和赤潮异弯藻含有油酸[53-57]。5 种脂肪酸对6 种赤潮微藻的抑藻强弱顺序为7-羟基庚酸、十四酸、十六酸、十八酸、油酸,根据本文现有结果尚无法确定本文试验的赤潮微藻脂肪酸组成与脂肪酸对它们的生长抑制作用之间的关系,还需要在后续工作中进行研究。
表2 表明,7-羟基庚酸、十四酸和十六酸对6 种试验赤潮微藻具有中等或高等毒性,其中7-羟基庚酸和十四酸对试验的赤潮微藻具有更为强烈的毒性。与硫酸铜和重铬酸钾对试验赤潮微藻生长的EC50~96h相比,7-羟基庚酸和十四酸对强壮前沟藻生长的EC50~96h影响更小。这就表明,在抑制强壮前沟藻上,7-羟基庚酸和十四酸更具有抑藻优势。同时,与以往研究相比[9-10,16],7-羟基庚酸对强壮前沟藻生长的EC50~96h不仅小于孔石莼、条斑紫菜和江蓠中分离到的抑藻活性化合物对该种赤潮微藻生长的EC50~96h,而且也小于硫酸铜和重铬酸钾对强壮前沟藻生长的EC50~96h。硫酸铜和重铬酸钾能迅速杀死赤潮微藻,然而,它们对非赤潮微藻的杀灭或抑制作用,会影响整个生态系统。7-羟基庚酸作为海带生长过程中产生的代谢物,在自然条件下能降解,不会长期积累,生态安全性好,可替代硫酸铜和重铬酸钾,有望成为一种新型的环境友好型赤潮微藻抑藻剂。
我们的一个前期研究总结了近20 年大型海藻抑藻活性化合物[10],发现分离自江蓠的gossonorol 和7,10-epoxy-ar-bisabol-11-ol[31]对强壮前沟藻生长的EC50~96h与本研究中7-羟基庚酸和十四酸对该赤潮微藻生长的EC50~96h较为接近,gossonorol 和7,10-epoxyar-bisabol-11-ol 是倍半萜类化合物、7-羟基庚酸和十四酸是脂肪酸,从结构上来看,羟基很可能是产生抑制作用的基团。此4 种抑藻活性化合物的分离纯化过程有一定的相似性,均是采用溶剂浸提、液液萃取、硅胶柱层析或薄层层析分离等方法,但具体分离过程并不相同。让人遗憾的是,先前工作和本研究都没有进行抑藻机理分析,它们在对赤潮微藻生长的抑制效应方面是否存在相似性尚不得知,需要后续进行深入研究。
近50 年来,利用大型海藻与赤潮微藻间抑制作用来生物防控赤潮微藻的研究有了长足进步,取得了一系列研究成果。然而,大型海藻抑藻活性化合物分离纯化研究仍然非常欠缺,致使利用大型海藻抑藻活性化合物开发环境友好型赤潮微藻抑藻剂受到了极大限制,因此,亟需海洋科学领域的研究者开展相关研究来解决这个问题。
5 结论
(1)采用活性追踪的分离方法,第一次从海带中分离纯化得到7-羟基庚酸、十四酸、十六酸、十八酸和油酸,纯化为薄层纯。
(2)7-羟基庚酸具有较为广泛的抑藻活性,在浓度为50 μg/mL 时,第4 天时对塔玛亚历山大藻、强壮前沟藻、赤潮异弯藻、米氏凯伦藻、球形棕囊藻和中肋骨条藻的生长抑制率超过53%。十四酸(50 μg/mL)也对强壮前沟藻、米氏凯伦藻和中肋骨条藻的生长表现出明显的抑制作用,对它们的生长抑制率超过57%(第4 天)。
(3)明确了7-羟基庚酸、十四酸、十六酸、十八酸和油酸对塔玛亚历山大藻、强壮前沟藻、赤潮异弯藻、米氏凯伦藻、球形棕囊藻和中肋骨条藻生长的半抑制效应浓度EC50~96h。发现7-羟基庚酸和十四酸在抑制强壮前沟藻上比硫酸铜和重铬酸钾更具有抑藻优势。
致谢:感谢中国医学科学院药用植物研究所马国需博士对样品结构解析的帮助。

