蛇床子素介导Toll样受体4/核因子-κB通路调控肾癌小鼠免疫系统抑制肿瘤细胞增殖和迁移的作用机制
王晨 藏春光
肾癌是最严重的恶性肿瘤之一,转移性肾癌治疗难度大,是导致治疗失败和死亡的重要因素,且肾癌的发病率和死亡率具有上升趋势[1]。研究显示免疫抑制在肿瘤的发生和进展中起重要作用,临床表现为CD4+/CD8+T淋巴细胞表达水平比值的降低,使肿瘤细胞躲避机体免疫系统的监控[2]。蛇床子素(Osthole,7-甲氧基-8-异戊氧基香豆素)是在蛇床子中提取的活性单体,有研究表明蛇床子素对多种类型的恶性肿瘤具有抑制作用,如乳腺癌、胆囊癌等,但其对肾癌的影响仍不清楚。近来有研究结果显示,蛇床子素可以调节机体免疫功能[3]。Toll样受体4/核因子-κB(TLR4/NF-κB)信号通路不但参与肾癌细胞的增殖和转移,也参与机体的免疫水平调控[4]。本研究主要分析蛇床子素介导TLR4/NF-κB信号通路调控肾癌小鼠免疫系统抑制肿瘤细胞增殖和迁移的作用。
材料与方法
1.材料:人肾癌细胞786-0(ATCC公司,美国),DMEM培养基血清和抗体(Invitrogen公司,美国),BALB/C裸鼠(上海斯莱克实验动物中心,中国),蛇床子素(Sigma公司,美国),TLR4/NF-κB信号通路抑制剂AXO-102(Selleck公司,中国),RNAspin Mini(GE Healthcare,美国),Bestar qPCR RT和BestarTMqPCR试剂盒(DBI Bioscience公司,德国),BCA试剂盒(武汉博斯特生物技术有限公司,中国),一抗和山羊抗免疫球蛋白G(IgG)二抗(1∶1000稀释,#ab6721;Abcam公司,美国),PVDF膜(Bio-Rad公司,美国),ECL显色试剂盒(Thermo Fisher公司,美国)。显微镜(Carl Zeiss公司,德国),流式细胞仪及小鼠CD4+和CD8+T淋巴细胞表型抗体试剂(Becton Dickinson公司,美国)。
2.方法
(1)分组和建模:通过皮下注射的方式构建肾癌裸鼠模型,将DMEM培养基中处于对数生长期的786-0细胞重新配置成浓度为1×107个/ml的细胞溶液,所有小鼠在左侧前肢皮下注射细胞溶液0.2 ml,在建模后第7天时可触摸到有瘤体生成提示建模成功。随机选择45只建模成功的小鼠,再随机分为模型组、蛇床子素组和蛇床子素+AXO-102组,每组15只。在建模后第8天,蛇床子素组和蛇床子素+AXO-102组小鼠均使用蛇床子素灌胃,剂量为100 mg/kg[5],每日1次。蛇床子素+AXO-102组小鼠使用蛇床子素灌胃的基础上再使用AXO-102灌胃,剂量为50 ng/kg,每2日1次。模型组给予相同体积的生理盐水灌胃。在建模后第28天,处死小鼠取出肿瘤组织。
(2)检测指标和方法
①肿瘤生长情况:每天观察小鼠肿瘤生长情况,在第28天统计肿瘤体积,用游标卡尺测量皮下肿瘤体积并使用下式计算:体积=[(长度×宽度)/2]3×0.523 6。取出肿瘤组织后称取肿瘤质量。
②免疫组化染色检测Ki-67蛋白表达水平:制作肾组织或肿瘤组织切片。将切片放在涂有0.1%聚L赖氨酸的载玻片上,用二甲苯脱蜡,用梯度醇(100%至70%)逐渐水合,并用磷酸盐缓冲液洗涤。随后,柠檬酸钠缓冲液(pH=6.0)处理组织切片进行热诱导修复。室温下,将玻片用30%的过氧化氢溶液处理10 min以封闭内源性过氧化物酶。用磷酸盐缓冲液冲洗后,在室温下用5%牛血清白蛋白封闭玻片10 min,然后将它们与anti-Ki-67(1∶100稀释)抗体在4 ℃孵育过夜。用磷酸盐缓冲液洗涤后,将每张玻片与特定的生物素化二抗在37 ℃孵育60 min。然后与3,3-二胺联苯胺和苏木精进行复染。显微镜下观察,通过半定量法分析并计算染色强度以表示Ki-67蛋白表达水平。染色强度=染色评分(0~3分)×染色范围(0~4分)。染色评分标准:未染色为0分;弱染色为1分;中度染色为2分;强染色为3分。染色范围标准:阳性细胞率≤5%为0分;6%~25%为1分;26%~50%为2分;51%~75%为3分;>75%为4分。
③蛋白质免疫印迹法(Western blot)检测蛋白表达水平:将肿瘤组织研磨后收集总蛋白并通过BCA试剂盒检测浓度。应用SDS-PAGE(110 V,100 min)分离30 μg总蛋白。分离后将蛋白质转移到PVDF膜上,并在膜上添加1∶500稀释的anti-MMP2和anti-MMP9抗体并孵育过夜。然后在室温下加入1∶5 000稀释的HRP标记的二抗,4 ℃下孵育2 h。通过ECL检测蛋白印迹带,GAPDH作为内参。通过检测灰度分析MMP2和MMP9蛋白、TLR4和NF-κB蛋白的表达水平。
④流式细胞术检测T细胞亚群水平:通过眼眶取血法收集小鼠外周血。将外周血经过密度梯度离心后抽吸淋巴细胞层,获得单个淋巴细胞悬浮液。细胞采用20 μl预冷的1×BD Mouse缓冲液在暗室、4 ℃条件下固定30 min,然后洗涤固定剂并收集细胞。细胞中加入200 μl通透缓冲液,并将细胞在37 ℃下避光孵育30 min。洗涤后将细胞与20 μl小鼠CD4+和CD8+T淋巴细胞表型抗体试剂或对照抗体在室温下孵育30 min。然后将抗体洗掉,将细胞重悬并通过流式细胞仪进行检测小鼠外周血中CD4+和CD8+T淋巴细胞表达水平,并计算CD4+/CD8+T淋巴细胞表达水平比值。
⑤RT-qPCR检测肿瘤组织中TLR4和NF-κB mRNA相对表达水平:肾组织或肿瘤组织中总RNA通过TRIzol获得,通过miScript试剂盒合成互补DNA(条件7 ℃ 60 min,95 ℃ 5 min,40个循环),利用MiScriptSYBR-Green PCR试剂盒检测互补DNA(条件95 ℃ 10 s,55 ℃ 30 s,72 ℃ 30 s,40个循环)。使用Agilent Stratagene Mx3000P序列检测系统进行RT-qPCR分析。U6用作miR-33a的内源参照,通过2-ΔΔCq分析RNA的相对表达水平。
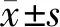
结 果
1.3组小鼠肿瘤体积和质量比较:建模后第28天3组小鼠肿瘤体积和质量比较差异均有统计学意义(P<0.05)。蛇床子素组和蛇床子素+AXO-102组小鼠的肿瘤体积和质量均显著低于模型组,且蛇床子素+AXO-102组显著低于蛇床子素组(P<0.05)。见表1。

表1 3组小鼠肿瘤体积和质量比较
2.3组小鼠Ki-67蛋白表达水平比较:模型组小鼠Ki-67蛋白表达水平为8.92±0.95,蛇床子素组为4.74±0.51,蛇床子素+AXO-102组为2.06±0.25,3组小鼠Ki-67蛋白表达水平比较差异均有统计学意义(P<0.001)。蛇床子素组和蛇床子素+AXO-102组小鼠Ki-67蛋白表达水平均显著低于模型组,且蛇床子素+AXO-102组显著低于蛇床子素组(P<0.05)。见图1。
3.3组小鼠MMP2和MMP9蛋白表达水平比较:3组小鼠MMP2和MMP9蛋白相对水平比较差异均有统计学意义(P<0.05),蛇床子素组和蛇床子素+AXO-102组小鼠MMP2和MMP9蛋白表达水平均显著低于模型组(P<0.05),蛇床子素+AXO-102组著低于蛇床子素组(P<0.05)。见图2和表2。
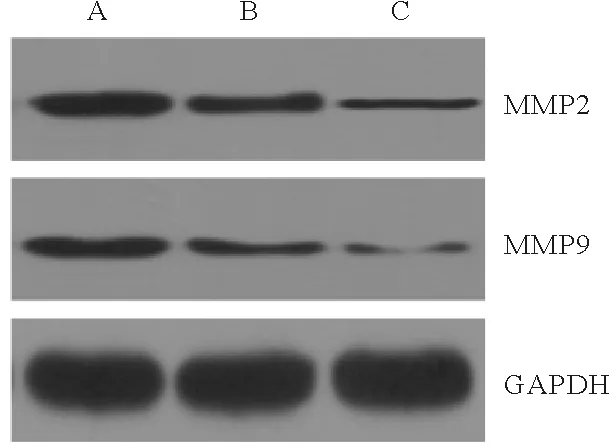
注:A:模型组;B:蛇床子素组;C:蛇床子素+AXO-102组图2 Western blot检测3组小鼠MMP2和MMP9蛋白表达水平
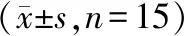
表2 3组小鼠MMP2和MMP9蛋白表达水平比较
4.3组小鼠CD4+、CD8+T淋巴细胞表达水平及CD4+/CD8+T淋巴细胞表达水平比值比较:3组小鼠CD4+T淋巴细胞表达水平和CD4+/CD8+T淋巴细胞表达水平比值比较差异均有统计学意义(P<0.05)。蛇床子素组和蛇床子素+AXO-102组的CD4+T淋巴细胞表达水平和CD4+/CD8+T淋巴细胞表达水平比值均显著高于模型组,且蛇床子素+AXO-102组显著高于蛇床子素组(P<0.05)。见表3。

表3 3组小鼠CD4+、CD8+T淋巴细胞表达水平及CD4+/CD8+T淋巴细胞表达水平比值

注:A:模型组;B:蛇床子素组;C:蛇床子素+AXO-102组图1 免疫组化染色检测3组小鼠Ki-67蛋白表达水平[亲和素-生物素-过氧化物酶复合物(ABC)法染色,×200]
5.3组小鼠TLR4和NF-κB mRNA相对表达水平比较:3组小鼠TLR4和NF-κB mRNA相对表达水平比较差异均有统计学意义(P<0.05)。蛇床子素组的TLR4和NF-κB mRNA相对表达水平显著低于模型组,蛇床子素+AXO-102组TLR4和NF-κB mRNA相对表达水平显著低于模型组和蛇床子素组(P<0.05)。见表4。

表4 3组小鼠TLR4和NF-κB mRNA相对表达水平比较
6.3组小鼠TLR4和NF-κB蛋白表达水平比较:3组小鼠TLR4和NF-κB蛋白表达水平比较差异均有统计学意义(P<0.05)。蛇床子素组TLR4和NF-κB蛋白表达水平显著低于模型组(P<0.05),蛇床子素+AXO-102组TLR4和NF-κB蛋白表达水平显著低于模型组和蛇床子素组(P<0.05)。见表5。

表5 3组小鼠TLR4和NF-κB蛋白表达水平比较
讨 论
肾癌已成为世界上常见的恶性肿瘤,调查显示2017年中国有48 210例新病例和17 168例死亡病例,分别占全球病例的12.27%和12.39%[6]。肾癌主要指肾细胞癌,其比例为90%~95%。近年来,肾癌的发病率逐年增加,与10年前相比上升了2%~3%[7]。然而目前尚无治疗肾癌的特效方法。
近年来,治疗肾癌的植物源性药物在全世界引起了越来越多的关注,其具有安全性、有效性和不良反应小等特点。蛇床子素是一种从草本植物蛇床中提取的天然香豆素,已证明其具有多种功能,包括抗炎、抗骨质疏松、降血糖、抗血栓形成和肝保护[8]。近年来研究发现其具有抗肿瘤作用,如蛇床子素可通过抑制PI3K/AKT通路水平降低胃癌细胞的增殖能力[9]。在宫颈癌中,蛇床子素可通过抑制ATM/NF-κB通路来促进细胞凋亡,并提高宫颈癌细胞的放射敏感性[10]。蛇床子素也可通过与内质网-线粒体轴相互作用并促进卵巢癌细胞的凋亡[11]。本研究采用动物实验分析蛇床子素对肾癌的影响,通过皮下注射的方式构建荷瘤裸鼠模型,通过蛇床子素灌胃干预,结果显示蛇床子素灌胃不但可以抑制肿瘤体积和质量的增长,还可以降低组织中增殖蛋白(Ki-67)和迁移相关蛋白(MMP2、MMP9)的表达水平。这提示蛇床子素可以显著抑制肾癌细胞的增殖和转移,可能成为治疗肾癌的新方法,但是其调控机制仍需要进一步研究。
TLR4是先天免疫反应中的重要蛋白质,在许多重要的肿瘤细胞和免疫细胞中都有表达,也与中药的抗肿瘤功能有关[12]。TLR4可介导下游膜复合物的结合并促进TAK1磷酸化并从膜中释放,活化的TAK1导致NF-κB活化[13]。NF-κB分子被释放并转移到细胞核中,并与靶基因结合以促进炎症因子的表达,轻微的炎症是肿瘤细胞增殖和转移所必需的,TLR4/NF-κB通路也是引起肿瘤转移的关键通路之一[14]。本研究结果显示蛇床子素可显著抑制肾癌肿瘤组织中TLR4和NF-κB mRNA和蛋白的表达水平。为进一步验证蛇床子素的抗肾癌作用与TLR4/NF-κB通路有关,本研究还通过AXO-102来抑制TLR4/NF-κB通路,结果显示其可进一步促进蛇床子素对增殖和迁移的抑制作用。张宇等[15]研究发现蛇床子素可通过抑制TLR4/NF-κB通路缓解颈动脉内膜增生。也有研究发现蛇床子素通过下调脑外伤中的TLR4/NF-κB通路减轻炎症[16]。这提示蛇床子素通过抑制TLR4/NF-κB通路来抑制肾癌细胞的增殖和转移。
蛇床子素也具有关键的免疫调控作用,而免疫抑制也是影响肿瘤增殖和转移的重要因素。相关研究显示在肾细胞癌患者中CD4+T淋巴细胞表达水平降低而CD8+T淋巴细胞表达水平升高,且CD4+/CD8+T淋巴细胞表达水平比值与手术的预后相关[17]。本研究结果显示蛇床子素组小鼠CD4+T淋巴细胞表达水平和CD4+/CD8+T淋巴细胞表达水平比值均显著高于模型组,并且蛇床子素+AXO-102组的CD4+T淋巴细胞表达水平和CD4+/CD8+T淋巴细胞表达水平比值均显著高于蛇床子素组。Zhang等[18]的研究发现,蛇床子素可显著提高CD4+/CD8+T淋巴细胞表达水平比值,并认为蛇床子素可以增强肝癌荷瘤小鼠中T细胞介导的抗肿瘤免疫反应。Yao等[19]的研究也显示蛇床子素可通过抑制NF-κB/内皮生长因子(VEGF)信号传导途径,蛇床子素是潜在的血管生成抑制剂和免疫系统增强剂,可能是治疗恶性肿瘤的的先导化合物。以上研究结果均提示蛇床子素抗肾癌的作用也与提高CD4+/CD8+T淋巴细胞表达水平比值、增强机体免疫功能缓解免疫抑制有关。
综上所述,在肾癌裸鼠模型中,蛇床子素不但可通过抑制TLR4/NF-κB通路抑制增殖和迁移,还可以提高CD4+/CD8+T淋巴细胞表达水平比值,缓解免疫抑制状态。但本研究未纳入对照组,不能更直接体现蛇床子素的作用效果,关于蛇床子素在肾癌中的作用和调控T淋巴细胞的分子机制仍需要进一步的研究。

