福建省宁德地区沙门菌感染的流行病学特征、耐药性及毒力基因分析
彭云娟,傅芬蕊,钟文,黄丽雯
福建省宁德师范学院附属宁德市医院检验科, 福建 宁德 352100
沙门菌是导致人群食物中毒的重要食源性致病菌之一,全球每年约有300万人死于其所致急性肠胃炎[1],我国每年约有3亿人因其感染而患病[2]。沙门菌的血清型约有2 610 种,其中大多数具有广泛致病性[3]。沙门菌通常通过位于毒力岛或质粒上的毒力基因编码一系列毒力因子来达到感染宿主的目的,这些毒力因子可相互作用而致病。例如,avrA、ssaQ、sodC1、mgtC、gipA等毒力基因在沙门菌中普遍存在,且部分基因存在水平转移的可能性。近年来,福建省宁德地区发生了多起食物中毒事件,其中绝大多数与沙门菌感染有关,因此对宁德地区沙门菌感染的流行病学特征、分子分型、耐药性和毒力基因进行分析具有重要意义,但迄今尚无相关文献报道。本研究以从宁德地区分离得到的364株沙门菌作为分析对象,对其流行病学特征、分子分型、耐药性和毒力基因进行研究,以期为宁德地区食源性疾病的溯源和防治提供一定的参考依据。
1 材料与方法
1.1 菌株来源
本研究中沙门菌菌株均由宁德市各大医院于2015—2020年分离获得,共364株,其中325株来自宁德市医院,其余39株分别来自宁德市中医院及宁德市人民医院。2015年分离获得65株,2016年分离获得74株,2017年分离获得49株,2018年分离获得55株,2019年分离获得44株,2020年分离获得77株。
1.2 试剂和仪器
主要试剂和仪器有SBG增菌液(美国BD)、麦康凯琼脂培养基(英国Oxoid)、HE琼脂培养基(北京陆桥)、XbaI内切酶(美国New England Biolabs)、蛋白酶K(美国Amresco)、诊断血清(丹麦SSI)、药敏检测板(上海星佰)、CHEF Mapper脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)仪(美国Bio-Rad)、Gel Doc XR+凝胶成像系统(美国Bio-Rad)、VITEK 2 Compact全自动细菌生化鉴定仪(法国梅里埃)。引物由上海桑尼生物科技有限公司合成。LMQ.C-80EP型高压蒸汽灭菌锅由山东新华医疗器械股份有限公司提供。
1.3 方法
1.3.1 分离与鉴定将标本保存液接种至SBG增菌液,37 ℃孵育24 h,然后分别接种于麦康凯琼脂培养基和HE琼脂培养基,36 ℃培养24 h。查看细菌的生长状态,使用VITEK 2 Compact全自动细菌鉴定仪对可疑菌落进行菌种鉴定,获得沙门菌属。
1.3.2 血清分型选取鉴定为沙门菌的菌株,在营养琼脂平板上进行单个菌落传代,采用沙门菌检测血清进行O相凝集,采用Swarm琼脂对菌落进行H相凝集及鞭毛诱导,以生理盐水作为空白对照,根据Kauffmann-White表确定血清型。
1.3.3 耐药性分析按世界卫生组织(World Health Organization,WHO)推荐的K-B纸片扩散法对沙门菌进行药敏试验。首先制备接种菌液,制作接种平板,贴纸片并孵育。培养后将平板取出,用游标卡尺测定抑菌环直径,根据抑菌圈直径的大小判断药敏试验结果,以大肠埃希菌(ATCC 25922)为质控菌株。
1.3.4 PFGE分型[4]参照中国细菌性传染病分子分型实验室监测网络(PulseNet China)中的沙门菌PFGE标准操作程序,以沙门菌标准菌株H9812作为PFGE分子量标准,将沙门菌密度调整为4.5麦氏浊度,制成细菌胶块,再裂解细菌,洗胶块,选用XbaI内切酶37 ℃酶切3 h,电泳19 h,电泳液温度14 ℃。电泳结束后,用GelRed对胶块进行染色,去离子水洗脱,采用Bio-Rad凝胶成像系统拍照。采用BioNumerics 7.6软件进行聚类分析,非加权配对算术平均法(unweighted pair-group method with arithmetic mean,UPGMA)进行聚类图构建,最优化值和条带位置差异容许度均设定为1.5%。
1.3.5 毒力基因检测参照文献[3],合成9对扩增引物,用以检测沙门菌的9个毒力基因。引物由上海桑尼生物科技有限公司合成,引物序列、扩增片段大小如表1所示。聚合酶链反应(polymerase chain reaction,PCR)反应体系(25 μL):10×Taq Buffer [含(NH4)2SO4和Mg2+] 2.5 μL、2.5 mmol/L MgCl21.5 μL、2 mmol/L dNTP Mix 2 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,退火30 s,72 ℃延伸60 s,35个循环;72 ℃延伸10 min,4 ℃ 保存。将PCR产物在1%琼脂糖凝胶中电泳,之后在凝胶成像系统中观察结果并拍照。

表1 毒力基因检测的扩增引物[3]
1.4 统计学分析
采用SPSS19.0处理数据,计数资料以百分率(%)表示,采用χ2检验进行分析,P<0.05代表有显著性差异。
2 结果
2.1 364株沙门菌的流行病学分析
本研究共分离获得364株沙门菌。流行病学分析结果显示,男性沙门菌感染率显著高于女性(P<0.05),0~10岁组人群感染率显著高于其他年龄组(P<0.05),农村人群感染率显著高于城市人群(P<0.05)。结果具体如表2所示。
2.2 364株沙门菌的血清分型
对364株沙门菌进行血清分型,共分出22个血清型。其中:鼠伤寒沙门菌、肠炎沙门菌、斯坦利沙门菌占比居前3位,分别为57.42%、16.21%、6.87%,为主要血清型。结果具体如表3所示。

表2 364株沙门菌的流行病学分析
2.3 沙门菌主要血清型对部分抗生素的耐药性分析
对鼠伤寒沙门菌、肠炎沙门菌、斯坦利沙门菌进行耐药性分析。结果显示,除环丙沙星外,鼠伤寒沙门菌对其他抗生素均有一定的耐药性,且对氨苄西林、磺胺异噁唑、四环素、链霉素的耐药率较高;肠炎沙门菌对氨苄西林、磺胺异噁唑、四环素、链霉素、甲氧苄啶的耐药率较高;斯坦利沙门菌对试验用抗生素的耐药率均未超过50%,对头孢他啶、环丙沙星、头孢噻肟、头孢吡肟未表现出耐药性。结果具体如表4所示。

表3 364株沙门菌的血清分型
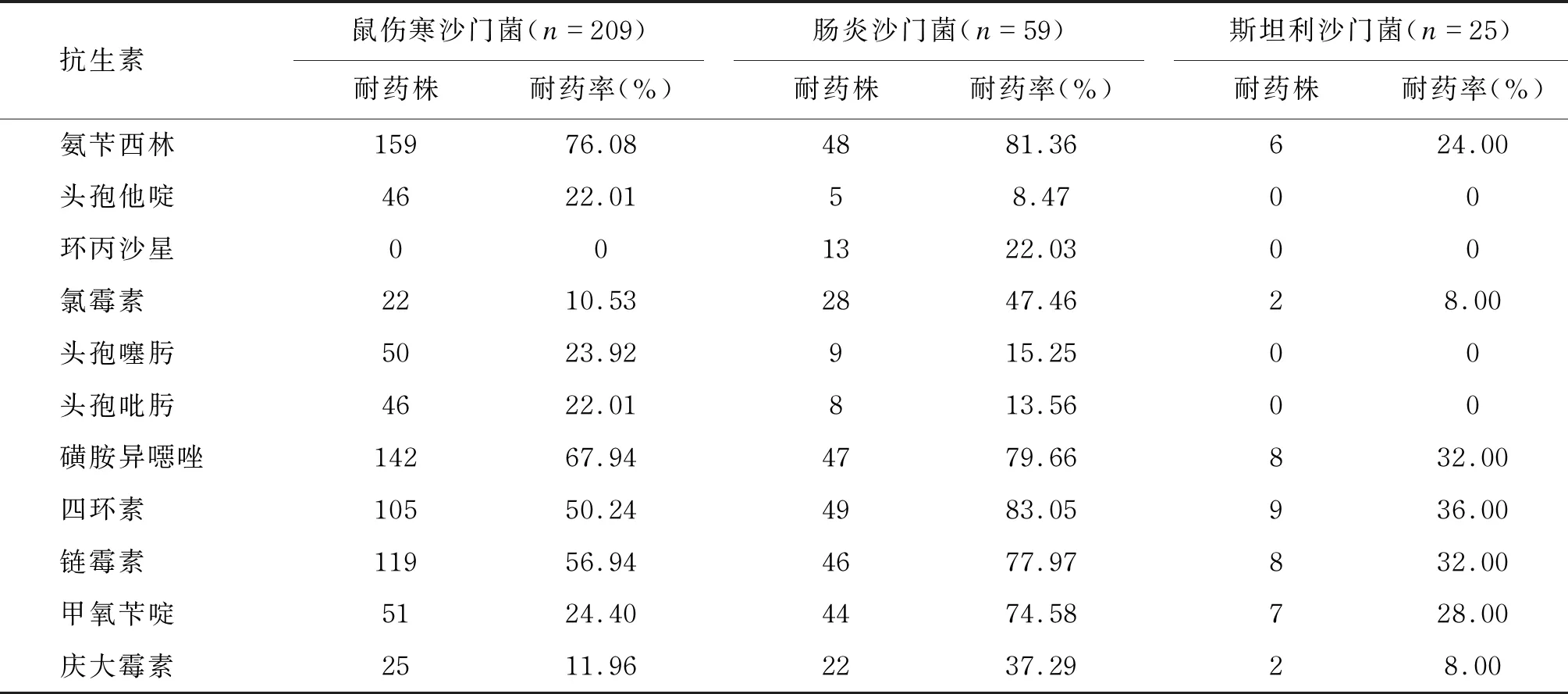
表4 沙门菌主要血清型的耐药性分析
2.4 364株沙门菌的PFGE分子分型特征
经聚类分析PFGE图谱,结果显示364株沙门菌共有212种带型。按时间分布如下:1~3月 6.25%、4~6月19.53%、7~9月40.60%、10~12月33.60%。按地区分布如下:蕉城区18.25%、东侨区14.35%、漳湾区12.58%、金涵区39.64%、古田县8.45%、霞浦县4.26%、其他区域2.47%。按人群年龄结构分布如下:≤1岁组28.30%,1~2岁组24.18%,2~8岁组20.88%,8~18岁组0.82%,18~50岁组9.89%,>50岁组15.93%。带型相似度为44.52%~100.00%,优势带型为B53,共23株,且全部为肠炎沙门菌。84株鼠伤寒沙门菌共分离出25种带型,带型相似度为92.45%;79株肠炎沙门菌共分离出38种带型,带型相似度高达98.64%,其中2018年的19株肠炎沙门菌带型相似度为100.00%,高度同源。结果具体如图1所示。
2.5 364株沙门菌毒力基因检测结果
对364株沙门菌进行毒力基因检测,结果显示avrA、ssaQ、sodC1、mgtC、gipA的携带率均为100.00%,ssiD、sopE、sopB、spvC的携带率分别为90.66%、 94.23%、 92.03%、 63.74%(详见表5)。

图1 364株沙门菌的PFGE分子分型特征

表5 364株沙门菌毒力基因检测结果
3 讨论
沙门菌是导致人类食物中毒和细菌性感染性腹泻的主要病原菌之一,且已演化出一系列逃逸宿主天然免疫应答的策略[5-6]。本研究针对从福建省宁德地区近5年来分离获得的364株沙门菌的流行病学资料进行分析,发现男性沙门菌感染率显著高于女性(P<0.05),这与李帼宁等[7]的研究结论一致。其原因可能与男性,特别是男性儿童较易尝试和接触不洁净的食物有关。同时,0~10岁人群的感染率远远高于其他年龄段人群(P<0.05),构成比超过2/3,提示儿童是沙门菌的主要易感人群,应对此予以足够重视并重点保护。其中,又以2岁以下幼儿的感染率最高,构成比接近40%。这可能是因为幼儿肠道免疫功能未完全发育成熟,对细菌等致病微生物的抵抗力较弱,更容易发生肠道传染病[1]。农村人群的沙门菌感染率显著高于城市人群(P<0.05),这可能与农村暴露于自然外环境的机会更多,食物和水源更易受动物粪便等污物的污染,卫生条件较于城市仍较差,且与牲畜等动物接触机会较多有关。对沙门菌的基因分型进行分析,364株沙门菌共分离出212种带型,显示出宁德地区沙门菌的遗传多样性,鼠伤寒沙门菌、肠炎沙门菌的带型相似度均在90%以上,显示出高度同源性。肠炎沙门菌的带型相似度高达98.64%,表明近5年来宁德地区发生的食物中毒较大可能来源于同一分子分型的肠炎沙门菌感染,应引起相关部门的高度重视,可以此为依据进行溯源追踪研究,避免肠炎沙门菌的暴发感染。
对364株沙门菌的血清分型进行分析,结果显示22个血清型中鼠伤寒沙门菌、肠炎沙门菌、斯坦利沙门菌占比位居前3位,与世界卫生组织全球沙门菌监测网数据显示的趋势[8]基本相符。高红梅等[9]曾对我国部分地区2014—2018年腹泻患者的监测结果进行分析,结果显示肠炎沙门菌和鼠伤寒沙门菌在非伤寒沙门菌血清型中占比最高,与本研究结果一致。邱玉锋等[10]对福建省部分地区2010—2016年腹泻患者的菌株血清型进行分析,结果显示肠炎沙门菌和鼠伤寒沙门菌也位居前两位。此外,本研究中斯坦利沙门菌的分离率也较高,有资料显示该血清分型的沙门菌曾在武汉等地的腹泻患者中显示出流行趋势[11]。李帼宁等[7]对沈阳市康平县进行沙门菌流行病学调查,结果显示斯坦利沙门菌的分离率较高,达23.46%,本研究中该血清分型的分离率为6.87%,显著低于康平县的数据,但依然在血清型分析中居第3位。
分析沙门菌的3种主要血清型对主要抗生素的耐药性,结果显示沙门菌对第3、4代头孢菌素有较高的敏感率,可作为治疗沙门菌感染的首选药物。对四环素、氨苄西林、磺胺异噁唑、链霉素、甲氧苄啶显示出较高的耐药率,可能与沙门菌属中许多菌株共同存在的耐药基因岛SGI1有关[12]。一直以来,氨苄西林、磺胺异噁唑被认为是治疗沙门菌感染的有效药物,但不合理使用抗生素情况的广泛存在,导致沙门菌对其耐药性越来越强,并表现出来回波动的特点[13-14]。本研究还显示,肠炎沙门菌对抗生素的耐药性总体上略高于鼠伤寒沙门菌和斯坦利沙门菌。结合宁德地区沙门菌的基因分型结果,发现肠炎沙门菌的带型相似度极高,有可能在该地区作为最主要血清型远超5年,在长期临床治疗中该血清型对氨苄西林等药物表现了较强的耐药性。这提示在未进行沙门菌血清型分析之前,可优先选用肠炎沙门菌耐药性较低的药物(如头孢他啶)进行治疗,可降低初次抗菌药物使用即耐药的概率。
沙门菌的致病性是由其所携带的大量毒力因子(结构性毒力因子、肠毒素、毒力岛及Ⅲ型分泌系统等)的相互作用所致,与其毒力相关的基因在沙门菌中普遍存在,且某些基因存在水平转移的可能性[15-16]。本研究结果显示,宁德地区沙门菌毒力基因avrA、ssaQ、sodC1、mgtC、gipA、ssiD、sopE、sopB的携带率均在90.00%以上,只有spvC的携带率较低,但也达到了63.74%。有研究曾对2008—2012年上海市肠炎沙门菌分离株的毒力基因进行检测,发现毒力基因sopE、avrA、spvC的携带率分别为 100.0%、98.9%、78.9%[17],与本研究的结果接近。肖蕊等[18]对62株食源性沙门菌分离株的毒力基因进行检测,共检测出mogA、ssel、mgtC、siiE、sopB5种毒力基因,其中mgtC、sopB的携带率分别为75.81%和51.61%。宁德地区沙门菌的毒力基因携带率均较高,可作为宿主溯源的基础数据,为该地区细菌致病性机制研究提供参考。
综上所述,福建省宁德地区沙门菌感染人群集中在10岁以下儿童,男性高发,具有一定的遗传多样性,且毒力基因的携带率较高,相关部门应对此予以重点关注。

