猪睾丸组织的形态学观察、细胞凋亡和巴豆酰化修饰
孟碟方,赵怡凡,方俊博,马增友,武曼曼,秦 歌,彭 辉 (福建农林大学 动物科学学院/蜂学学院,福建 福州 350002)
凋亡是一种程序性细胞死亡[1],细胞凋亡或程序性细胞死亡在生殖器官中更明显,可以在睾丸内的多个部位发生[2-4]。在雄性睾丸发育与精子发生过程中,细胞凋亡在控制生殖细胞数量和清除缺陷生殖细胞方面起着重要作用[5-6]。在增殖过程中染色体异常的精原细胞会在凋亡后被清除,在多种家畜中也已经报道过自发性精原细胞凋亡的情况。生殖细胞的成熟与支持细胞密切相关,一般支持细胞的凋亡率较低,早期过量产生的精原细胞最终会选择性凋亡以平衡生殖细胞/支持细胞的比率[7-8]。在成年大鼠中A2-A4型精母细胞会发生凋亡[8-9],从而保持恒定数量的细胞进入减数分裂期。
研究表明,赖氨酸酰化作用包括赖氨酸乙酰化、丙酰化、丁酰化、琥珀酰化、丙二酰化、戊二酰化、巴豆酰化(crotonylation,Kcr)和β-羟基异丁酰化等。其中赖氨酸Kcr是一种进化上保守的组蛋白标记,最初在组蛋白上发现,进一步研究表明大量非组蛋白也可以发生Kcr修饰。Kcr作为一种新型的酰化修饰,是由酰基转移酶以巴豆酰辅酶A为底物,将巴豆酰基团转移到赖氨酸残基上而产生的一种新型修饰。该修饰类型在人类体细胞和小鼠雄性生殖细胞基因组中首次发现,并在雄性生殖细胞中富集[10],参与启动雄性单倍体细胞基因的表达[11]。Kcr修饰多发生在参与RNA加工、核酸代谢、染色体组织和基因表达的核蛋白上,多种蛋白功能和细胞过程受Kcr的调控[12]。
本试验研究不同发育阶段猪睾丸组织的形态学变化以及精子发生过程中细胞凋亡情况和Kcr修饰水平。该研究结果为揭示猪精子发生过程中的形态变化及调控机制提供参考,也为深入研究哺乳动物精子发生过程中的分子机制奠定基础。
1 材料与方法
1.1 实验动物2,4,6,8月龄杜洛克公猪睾丸取自福建某种猪场。
1.2 主要试剂DAPI染色液、TUNEL细胞凋亡检测试剂盒、SDS-PAGE凝胶配制试剂盒、Western blot相关试剂和免疫荧光染色试剂购自碧云天生物技术有限公司;免疫印迹二抗Odyssey®Demo Kit Ⅱ购自LI-COR公司;Anti-crotonyllysine rabbit pAb抗体、H2BK34cr pAb和H2BK20cr pAb购自杭州景杰生物科技有限公司。
1.3 睾丸组织切片制备猪睾丸组织在PBS中清洗2次,加入4%多聚甲醛溶液进行固定,1 d后取出用蒸馏水冲洗12 h。睾丸组织依次放入由低到高浓度的酒精中脱水,经过二甲苯透明和石蜡包埋,将组织块固定在切片机上切出厚约5 μm的切片,展片和捞片后放入60℃左右恒温烘干箱烘干备用。
1.4 HE染色用二甲苯除去睾丸切片中残存的石蜡,再将切片放入从高到低浓度的酒精中,之后置于蒸馏水中2 min。取出切片在苏木精染液中染色3~8 min,用蒸馏水冲洗5 min。再将切片置于1%盐酸酒精中分化数秒,蒸馏水冲洗后再用0.6%氨水返蓝,蒸馏水冲洗,在伊红染色液中染色2~3 min。染色后的切片经无水乙醇脱水、二甲苯透明、滴上树胶、盖上盖玻片封片。
1.5 TUNEL染色切片水化后滴加不含DNase的20 mg/L蛋白酶K,室温处理15~30 min,用PBS冲洗切片3~5次。配制TUNEL检测液,标记为TdT酶∶荧光标记液∶TUNEL检测液=1∶9∶10。每张切片滴加50 μL TUNEL检测液覆盖组织样品,室温避光孵育1 h。PBS冲洗切片3次,滴加DAPI染色液室温避光染色10 min。最后将抗荧光淬灭封片液滴加在切片上进行封片,在荧光显微镜下观察,随机选取5个视野,计算凋亡指数。凋亡指数=凋亡细胞数/总细胞数×100%。
1.6 睾丸蛋白样品的制备剪取100 mg左右的睾丸组织放入离心管中,加入1 mL组织裂解液(IP)和蛋白酶抑制剂(PMSF)混合液(IP∶PMSF=100∶1)以及钢珠,将离心管置于预冷过的高通量组织研磨仪中,70 HZ,60 s进行研磨。研磨后的混合液在4℃离心机13 000×g,离心10 min。吸取上清液加入Loading bufferr充分混合,100℃水浴锅中孵育10 min,-20℃保存。
1.7 免疫印迹制备12%SDS-PAGE凝胶,吸取等量的蛋白样品加入凝胶电泳泳道,电压设置为上层胶80 V/30 min,下层胶120 V/1 h进行电泳。根据目的蛋白的大小将凝胶裁下,用湿转法将凝胶上的蛋白转移到NC膜上。将NC膜正面向上放入含有5%脱脂奶粉的TBS/0.1% Tween 20(TBST)溶液中,室温封闭3 h。封闭结束后,用TBST溶液按相应比例稀释目的蛋白抗体(anti-crotonyllysine rabbit pAb按1∶1 000稀释;H2BK34cr pAb和H2BK20cr pAb按1∶2 000稀释),NC膜正面向上浸没在一抗稀释液中4℃过夜孵育。TBST洗NC膜3次,每次5 min。再用TBST溶液按1∶20 000比例稀释IRDye®近红外荧光二抗,室温避光孵育2 h。TBST室温避光洗3次,每次5 min。Actin作为内参,用双色红外激光成像系统Odyssey CLx进行曝光拍照。
1.8 免疫荧光睾丸组织切片脱蜡后,通过不同浓度乙醇对切片进行水化处理。免疫染色洗涤液冲洗切片3次,每次5 min,使用含0.2%Triton X-100的PBS液体室温孵育20 min通透打孔。之后用免疫染色洗涤液冲洗切片1次,在组织上滴加专用封闭液室温封闭4 h。用一抗稀释液按1∶500稀释Kcr泛抗体,在切片组织上滴加一抗4℃过夜孵育。用免疫荧光洗涤液洗3次,每次5 min。荧光二抗按1∶500稀释,室温避光孵育2 h。用免疫荧光洗涤液冲洗切片3次,每次5 min。DAPI染色液染核,染色时间5 min。用免疫荧光洗涤液冲洗切片3次,每次5 min,最后在切片上滴加荧光抗淬灭剂后进行封片,通过LEICA荧光显微镜观察并拍照。
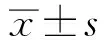
2 结果
2.1 不同发育阶段猪睾丸组织的形态学观察猪睾丸组织切片HE染色显示,随着月龄的增加,精细管由不规则形状逐渐发育成近圆形(图1A),管腔直径显著增大(图1B);管腔内支持细胞逐渐发育、体积增大并呈不规则椎体。被支持细胞包裹的生精细胞从4月龄开始分裂,排列逐渐有序表示精子发生正常进行(图1A)。
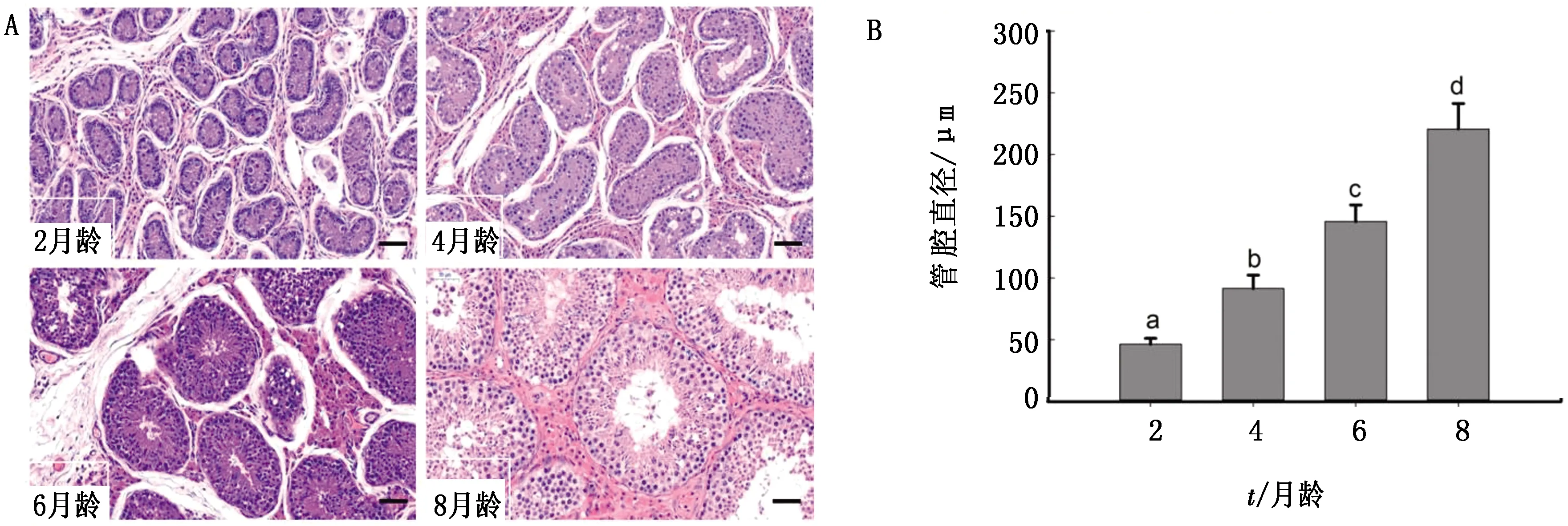
A.不同发育时期猪睾丸切片HE染色(比例50 μm);B.不同发育时期猪睾丸精细管管腔直径
2.2 不同发育阶段猪睾丸内细胞凋亡变化为了研究睾丸细胞凋亡变化情况,对睾丸组织进行凋亡染色。如图2A所示,不同发育阶段猪睾丸细胞均有少量的TUNEL阳性生精细胞。就凋亡指数而言,4,6月龄组的凋亡指数显著高于2,8月龄组(P<0.05)。
2.3 不同发育阶段猪睾丸蛋白Kcr修饰水平为了检测猪睾丸蛋白Kcr修饰水平,提取不同发育阶段猪睾丸蛋白进行免疫印迹分析。如图3A所示,利用Kcr泛抗体检测猪睾丸蛋白Kcr修饰水平时,每个泳道都检测出多个条带,说明每个发育阶段的睾丸中都有较多的蛋白质发生Kcr修饰,其中大部分条带随着月龄增加而逐渐减弱。利用H2BK20cr和H2BK34cr位点特异性抗体分别检测H2BK20和H2BK34位点的Kcr水平,如图3B所示,H2BK20和H2BK34位点的Kcr修饰水平随着月龄增加而逐渐降低。
2.4 不同发育阶段猪睾丸Kcr蛋白定位将不同发育阶段猪睾丸制成组织切片,通过免疫荧光试验进一步研究Kcr蛋白在猪睾丸组织中的定位。由图4可知,在不同月龄的猪睾丸中,睾丸间质细胞、足细胞和生精细胞内都存在Kcr修饰,随着月龄的增加,整体修饰水平有下降的趋势。
3 讨论
猪睾丸组织切片HE染色表明,从2~6月龄猪睾丸精细管管腔内支持细胞逐渐发育、体积增大并呈不规则椎体。被支持细胞包裹的生精细胞从4月龄开始分裂产生精细胞。在啮齿类动物中,支持细胞数量在睾丸分化后持续增加,直到大鼠出生后15 d 和小鼠青春期早期,此后数量保持不变[13-16]。在家畜上,睾丸支持细胞的增殖发生在公羊出生后的6~12周[17-19],公猪出生后的17周前后[20],公牛出生后的20周左右[21]。在精母细胞进入第1次减数分裂前,支持细胞之间通过特殊连接形成血液-睾丸屏障[22-24],该屏障的形成是精子发生的关键,任何延迟都会阻止减数分裂的开始[24-25]。

A.蓝色荧光为细胞核染色;绿色荧光为凋亡细胞染色(比例尺50 μm);B.凋亡指数的统计
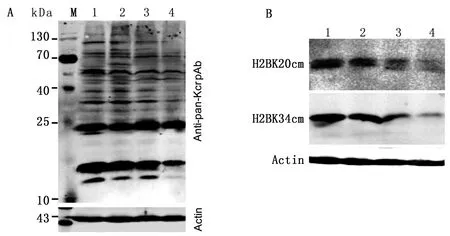
A.Kcr蛋白在不同发育阶段猪睾丸细胞中的表达;B.H2BK20和H2BK34在猪睾丸中的Kcr修饰水平。M.蛋白Marker;1.2月龄;2.4月龄;3.6月龄;4.8月龄

图4 Kcr蛋白在不同发育阶段猪睾丸中的定位(比例尺50 μm)
在精子发生过程中,生殖细胞经历有丝分裂、减数分裂和细胞变形产生成熟的精子。在形成精子的过程中,细胞核和染色质会发生变化。组蛋白由特异性变体到过渡蛋白,最后被鱼精蛋白所取代,导致精子染色质的高度浓缩状态[26]。精子发生的正常完成和成熟精子的最终数量取决于发育中的生殖细胞和支持细胞的相互作用。猪睾丸组织的TUNEL染色表明4,6月龄这2个月龄的凋亡细胞数量相较于2,8月龄时显著增加,说明从4月龄开始生精细胞开始减数分裂,支持细胞已发育成熟,为维持生殖细胞和支持细胞比例的平衡,部分精原细胞出现凋亡。
Kcr是最近发现的蛋白新型修饰类型,真核细胞中的组蛋白和非组蛋白都能发生Kcr修饰。HAWKINS等[27]鉴定了人类组蛋白上130个修饰位点,包括63个已知和67个新的组蛋白标记,其中有28个Kcr位点,首次发现组蛋白Kcr修饰可以作为活性基因转录起始位点的标记和被预测为增强子的区域。在减数分裂后的雄性生殖细胞中,组蛋白Kcr的增加促进了X连锁单倍体细胞特异性基因的表达,作为减数分裂后活性性染色体相关基因的特异性标记[10]。为进一步研究猪睾丸蛋白中的Kcr修饰情况和Kcr蛋白的定位,本试验使用抗Kcr的泛抗体进行免疫印迹和免疫荧光检测,免疫印迹结果显示大部分蛋白条带随着猪月龄的增加而减弱,说明整体Kcr修饰水平有下降的趋势,造成该结果的一个原因可能为在精子发生过程中组蛋白逐渐被鱼精蛋白取代所致。BAKER等[13]使用抗Kcr的泛抗体在核心组蛋白H2B检测到Kcr信号,在核小体外表面发现了新的PTM位点,包括H2BK116的单甲基赖氨酸和甲酰赖氨酸,推测这些位点极有可能对转录和表观遗传调控产生重要影响。在哺乳动物中,已经确定了7个组蛋白H3 Kcr修饰位点(H3K4、H3K9、H3K18、H3K23、H3K27、H3K56和H3K-122)和3个组蛋白H4 Kcr修饰位点(H4K5、H4K8和H4K12)[10,28]。在植物中,用Kcr泛抗体和H3K14cr特异性抗体进行水稻幼苗组蛋白Kcr的全基因组检测,鉴定了4个组蛋白Kcr修饰位点,分别为H3K14、H3K79、H4K31和H4K79[29]。本研究挑选组蛋白H2BK20和H2BK34这2个位点进行Kcr修饰水平分析,结果显示随着月龄的增加,猪睾丸组织Kcr修饰水平逐渐降低,提示精子发生过程中组蛋白逐渐被鱼精蛋白所取代,组蛋白上Kcr修饰逐渐减少。
本研究利用免疫荧光技术检测Kcr蛋白在猪睾丸组织中的定位,结果显示在睾丸细胞中均能检测到Kcr蛋白定位,提示Kcr蛋白在多种类型细胞中均存在且发挥一定的作用。在同一种类型细胞中,Kcr蛋白在细胞质和细胞核中也均有定位,说明除了组蛋白能发生Kcr以外,大量的非组蛋白也能发生Kcr。随着猪月龄的增加,切片的免疫荧光强度减弱趋势明显,该观察结果与免疫印迹的结果一致。研究表明蛋白的Kcr修饰参与哺乳动物精子的发生,但具体的调控机制还不清楚,本研究后期将利用多种方法进一步揭示Kcr蛋白在猪睾丸发育过程中的功能。

