增龄对大鼠心成纤维细胞生长和功能的影响*
王 琰 许亚平 王 前 罗欢欢 赵育洁 牛思泉 胥 良 郭志坤,4△
(郑州市第七人民医院,1 心内科,2 郑州市心脏结构研究重点实验室,郑州 450006;3 新乡学院护理学院,新乡 453003;4 新乡医学院河南省医用组织再生重点实验室,新乡 453003)
心成纤维细胞(cardiac fibroblasts,CFs)约占心细胞的70%,对维持心正常结构和功能起重要作用。CFs 增殖能力强,即使在缺氧环境中,仍保持较高的增殖代谢能力[1],此功能在心血管栓塞导致的心肌损伤修复中至关重要,可快速修复心损伤,防止心破裂和心力衰竭等。CFs 还分泌一些细胞因子,如内皮素[2]、白介素[3]、前列腺素[4]、促红细胞生成因子[5]等,参与组织的损伤修复和血管新生等。此外,成纤维细胞还具有多项分化潜能,可分化为肌腱细胞、骨细胞、软骨细胞、脂肪细胞和心肌细胞等[6-8]。这些研究结果提示,CFs 很可能在心肌修复过程中参与心肌再生。已有研究表明[9],低等生物斑马鱼、蝾螈等发生心肌损伤时,可形成暂时性纤维瘢痕,而后心肌组织可完全再生,替代瘢痕组织;而心肌损伤发生在成年哺乳动物时,损伤部位则形成永久性纤维疤痕,严重影响心功能和预后[10-11]。因此心肌梗死后如何诱导激发包括CFs 在内的多种心肌再生因素是当前研究的热点之一。本课题组前期研究显示新生大鼠CFs 可表达多种干细胞表面标志物[12],具有一定的干细胞功能特性,随培养代次的增加活化成为肌成纤维细胞的数量增加[13]。本研究通过分析不同时间段CFs 生长和功能的变化,探讨增龄对CFs 的潜在影响,旨在为心肌修复的基础研究和临床应用提供实验依据。
1 材料和方法
1.1 原代大鼠CFs 的获取、培养及传代
120 只健康SD 大鼠购自新乡医学院实验动物中心,雌雄不限。其中新生大鼠(60 只,新生组)以75%乙醇消毒,1月龄(30 只,1月龄组)和3月龄(30 只,3月龄组)大鼠利用10%水合氯醛麻醉后备皮,75%的乙醇消毒后,置于无菌解剖板上,于胸骨剑突下稍左侧,迅速打开胸腔,切取心尖部组织,置于预冷的 DMEM 中,漂洗3 次,去除血液。在5 mL 玻璃瓶中加入2 mL 预冷的 HBSS,将心尖组织转入5 mL 玻璃瓶,用眼科剪将其剪成约1 mm3的小块,弃上清液,加入消化酶溶液(0.07%胰蛋白酶和0.05%Ⅱ型胶原酶溶液),置于培养箱8 min,每隔4 min 轻轻晃动玻璃瓶,8 min 后收集上清液。再次加入1.5 mL 消化酶溶液,置于培养箱8 min,每隔4 min 轻轻晃动玻璃瓶,重复以上步骤,共消化11~13 次至心肌组织块松软。加入5 mL 含10% FBS 的DMEM 培养基,轻轻吹打残余组织块,直至组织块基本消失,收集上清液置于含10% FBS 的DMEM 培养基中。1 000 r/min 离心5 min,弃上清液,沉淀中加入5 mL 培养基轻轻吹打重悬细胞,将重悬的细胞过200 目细胞筛,将细胞移入25 cm2的培养瓶进行差速贴壁2 次,每次45 min。贴壁的细胞主要是成纤维细胞,加入5 mL 含10% FBS 的 DMEM 培养基,置入37 ℃、5% CO2细胞培养箱培养,24 h后首次换液,以后每2 d 换液1 次。待细胞汇合至80%~90%时,以0.25%胰蛋白酶(Amrescao,美国)按1∶2 消化传代。
1.2 免疫荧光染色鉴定CFs
将各组第3 代CFs 消化重悬,以3 000~5 000个细胞/孔接种于96 孔板,待细胞汇合约80%,4%多聚甲醛固定细胞30 min,0.3% Triton X-100 破膜10 min,10%山羊血清封闭40 min,加入兔来源一抗盘状结构域受体2(discoindin domain receptor 2,DDR2)(1∶50,Santa),每孔70 μL,4 ℃孵育过夜,加入Cy3 山羊抗兔二抗,室温避光孵育1 h,按每孔50 μL 加入10 μg/mL DAPI 染核,室温避光孵育15 min,荧光显微镜下观察拍照。
1.3 MTT 法检测细胞增殖
将各组第3 代 CFs 消化重悬,以3 000~5 000个细胞/孔接种于 96 孔板,24 h 贴壁稳定后开始检测。自贴壁24 h~贴壁第6 天,每天取1 板96 孔板,于各孔内加入5 g/L 的 MTT(Sigma,美国)10 μL和含10%胎牛血清的 DMEM(Hyclone,美国)90 μL,37 ℃孵育4 h,加入150 μL 的 DMSO,摇床上缓慢避光振荡10 min。用酶标仪测量各孔490 nm 波长处的吸光度值(OD 值)。取均值分析。
1.4 免疫荧光染色检测 CFs 的表面标志物
将各组第3代 CFs 消化重悬,以5 000~10 000个细胞/孔接种至96孔板,待细胞汇合达70%左右时,给予免疫荧光染色检测。4%多聚甲醛避光固定30 min,0.3% Triton X-100 破膜10 min,10%山羊血清封闭40 min,分别加入兔来源一 抗nanog(1 ∶500,Abcam)、sox2(1 ∶500,Abcam)、oct4(1∶500,Abcam)、scal-1(1∶500,Abcam)、c-kit(1∶500,Abcam),以每孔70 μL加入96 孔板,阴性对照为PBS 代替一抗,4 ℃过夜孵育,加入 Cy3 抗兔二抗,室温避光孵育1 h,每次3 min,以每孔50 μL 加入10 μg/mL DAPI 染核,室温避光孵育15 min,荧光显微镜下观察拍照。每个蛋白标志物的免疫荧光结果取6 个复孔,随机选取5~7 个视野,利用 Image J 6.0 软件测量平均光密度值,即光密度总和与面积比值,进行半定量分析。
1.5 免疫细胞化学显色检测 CFs 的表面标志物
将各组第3代 CFs 消化重悬,以5 000~10 000个细胞/孔接种至96孔板,待细胞汇合达70%左右时,给予免疫细胞化学检测。4%多聚甲醛避光固定30 min,A试剂(3% H2O2)室温作用细胞8 min,滴加B试剂(血清封闭液)室温作用20 min,分别加入兔来源一抗nanog(1∶500,Abcam)、sox2(1∶500,Abcam)、oct4(1∶500,Abcam)、scal-1(1∶500,Abcam)、c-kit(1∶500,Abcam),阴性对照为PBS代替一抗,4 ℃孵育过夜,加入C试剂(生物素标记山羊抗兔),室温避光20 min,DAB显色,苏木精复染,常规脱水、透明、封片。倒置显微镜下观察拍照。
1.6 成脂、成骨和成心肌诱导分化
将各组第3代 CFs 消化重悬,以5 000~10 000个细胞/孔接种至96孔板,待细胞汇合达70%左右时,分别加入成脂、成骨、成心肌诱导液。成脂、成骨诱导液每2~3 d更换1次;成心肌诱导液24 h后更换完全培养基,之后每2~3 d更换完全培养基。成脂诱导7~9 d,4%多聚甲醛固定细胞,利用油红O染色试剂盒(Solarbio,北京)染色,显微镜下观察拍照;成骨诱导21 d,4%多聚甲醛固定细胞,利用茜素红染色试剂盒(Solarbio,北京)染色,显微镜下观察拍照;成心肌诱导21 d,利用免疫荧光染色 cTnT,荧光显微镜下观察拍照。
1.7 统计学处理
利用 SPSS 20.0 软件进行数据分析,计量资料以±s表示,两样本间比较采用独立样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠 CFs 的形态特征
分离培养的大鼠CFs 贴壁生长,细胞呈长梭形、圆形或多角形,新生组细胞多呈圆形、长梭形,1月龄组和3月龄组细胞多呈多角形。原代、第1 代CFs 生长较快,第2 代、第3 代CFs 生长速度较前减慢。
2.2 不同时间段大鼠CFs DDR2 表达
免疫荧光染色显示,3 组大鼠CFs 均表达DDR2,符合心成纤维细胞特性(图1,见封二)。
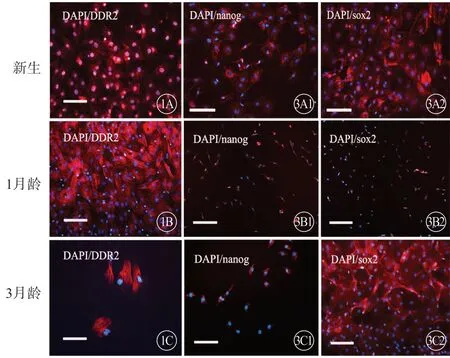
图1 3 组大鼠CFs DDR2 表达,免疫荧光显色,倒置荧光显微镜,蓝色代表细胞核,红色代表Cy3 标记的DDR2.
2.3 大鼠 CFs 生长曲线比较
3 组大鼠CFs 总的生长趋势一直处于平稳上升,但上升幅度不同。培养24 h 贴壁稳定后至贴壁48 h,3 组CFs 生长速度无明显差异;2~3 d新生组CFs 生长速度与1月龄组和3月龄组差异无统计学意义(P>0.05);3~4 d 3 组CFs 的生长速度差异达高峰,新生组高于1月龄组和3月龄组,差异有统计学意义(P<0.05),但1月龄组和3月龄组生长速度差异无统计学意义;4~5 d 3 组CFs 的OD 值较前无明显变化,1月龄组的生长速度高于3月龄组,而新生组仍高于1月龄组和3月龄组;5~6 d 新生组 CFs 的曲线变化不大。提示不同年龄CFs 在4 d 均进入生长平台期,但各年龄段仍存在增殖差异(图2)。

图2 3 组大鼠CFs 的细胞生长曲线
2.4 大鼠 CFs 5 种表面标志物表达
免疫荧光染色结果显示,3 组大鼠第3 代CFs均表达 nanog、sox2、oct4、scal-1、c-kit 表面标志物(图3~5,见封二),但存在年龄差异。新生组CFs 的表面标志物表达水平均高于1月龄组和3月龄组(P<0.05,P<0.01),1月龄组多种表面标志物的表达水平均高于3月龄组,差异均有统计学意义(P<0.05,P<0.01)(图4)。
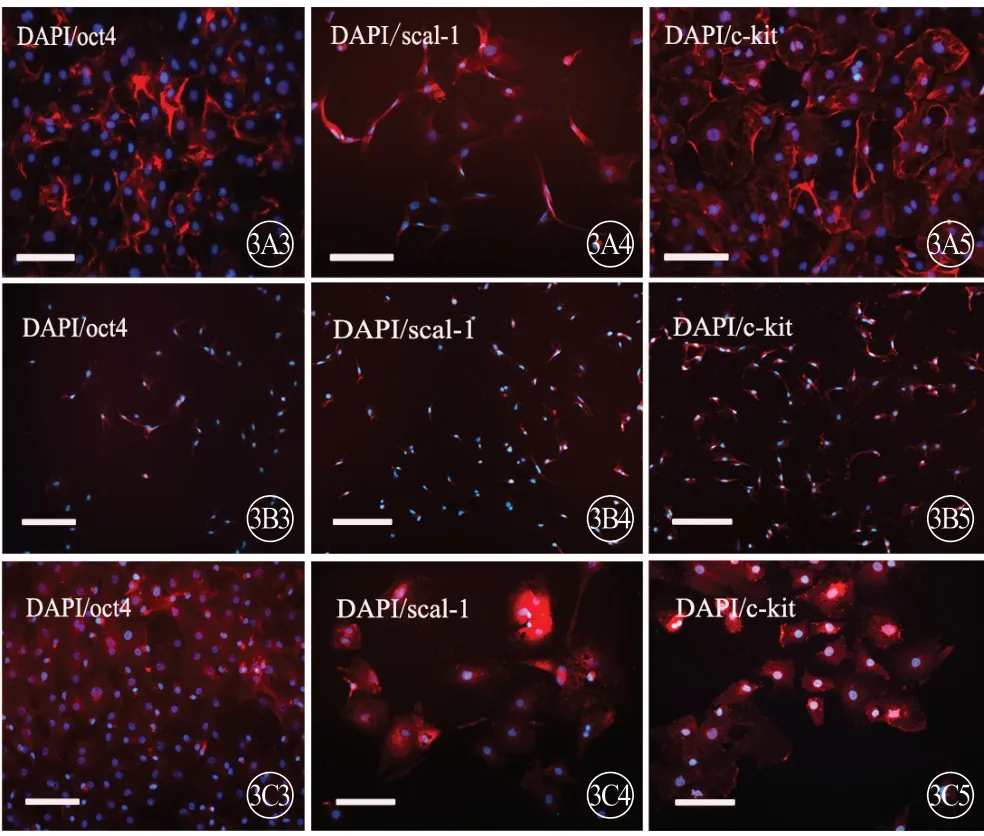
图3 3 组大鼠CFs 的5 种干细胞表面标志物(nanog、sox2、oct4、scal-1、c-kit)表达,免疫荧光显色(蓝色代表细胞核,红色代表Cy3 标记的nanog、sox2、oct4、scal-1、c-kit),标尺=200 μm。A:新生组;B:1月龄组;C:3月龄组.
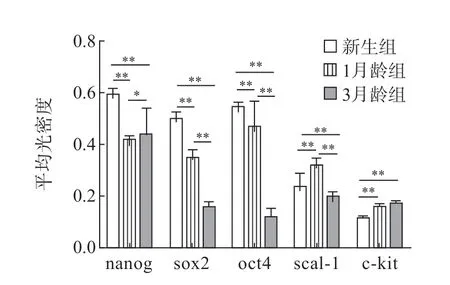
图4 3 组大鼠CFs 的表面标志物表达比较
免疫细胞化学显色结果显示,3 组大鼠CFs 均表达 nanog、sox2、oct4、sca-1、c-kit 表面标志物,表达部位位于细胞质内(图5,封二)。

图5 3 组大鼠第3 代CFs 5 种干细胞表面标志物表达,免疫组织化学显色,标尺=200 μm。A:新生组;B:1月龄组;C:3月龄组.
2.5 大鼠 CFs 的多向分化比较
3 组大鼠 CFs 成脂诱导后,均有红色脂滴生成,表明CFs 有成脂分化能力(图6,见封二);成骨诱导后,茜素红染色显示有红色钙结节沉着形成,说明CFs 有成骨分化能力(图6,见封二);成心肌诱导后,免疫荧光染色显示cTnT 表达阳性,提示CFs有成心肌分化能力(图7,见封二)。
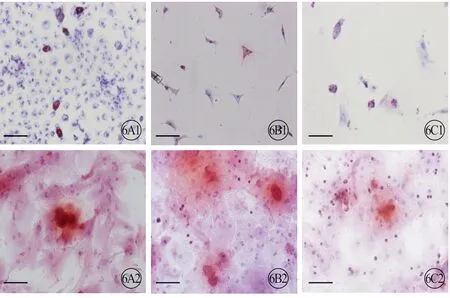
图6 3 组大鼠CFs 的成脂(A1、B1、C1)及成骨(A2、B2、C2)诱导。油红和茜素红染色(红色代表脂滴,蓝色代表细胞核)。标尺=100 μm。A:新生组;B:1月龄组;C:3月龄组.
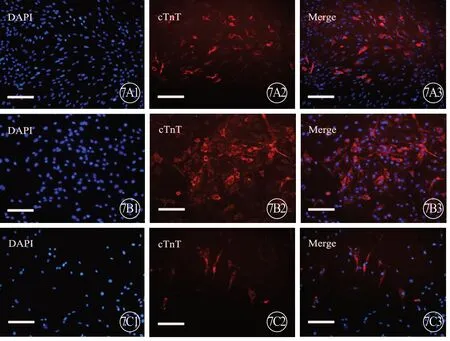
图7 3 组大鼠CFs 成心肌诱导,免疫荧光显色(蓝色示细胞核,红色代表 cTnT 阳性表达)。标尺=200 μm。A:新生组;B:1月龄组;C:3月龄组.
3 讨论
CFs 作为心肌损伤修复中的主要参与细胞,其体外培养可表达干细胞的表面标志物,并可诱导为脂肪细胞、骨细胞和软骨细胞等[6-7],表明CFs 具有高度的幼稚性和多向分化潜能,这为进一步研究CFs 参与心肌再生提供了实验依据。此外CFs 可通过分泌一些细胞因子,如内皮素[2]、白介素[3]、前列腺素[4]、促红细胞生成因子[5]等,参与组织损伤修复和血管新生等。研究显示[14],利用MyoD 修饰成纤维细胞可将其转化为骨骼肌,而将Gata4、Mef2c 和Tbx5 基因修饰CFs 可使其转化为心肌样细胞[15]。这些研究结果为CFs 转分化为心肌细胞奠定了实验基础。CFs 作为心肌损伤修复的主要细胞之一,其功能特性是否随增龄增加而发生改变?目前研究较少。本研究对CFs 的生长速度、多种表面干细胞标志物的表达,以及成脂、成骨、成心肌的多向分化能力检测显示,CFs 的生长速度、多种表面标志物表达和多向分化能力随增龄变化而逐渐下降,其中形态变化和生长速度变化明显。此变化是否反映了CFs 随年龄的增长逐渐发生“老化”,以及参与心肌修复和再生的能力是否逐渐降低?了解这一点对全面判断CFs 的生物学特性,阻止CFs 的老化进程,更好地利用和发挥其心肌再生能力都十分关键。
本课题组最近的研究显示,新生大鼠CFs可表达nanog、sox2、c-kit、scal-1、Tbx5、CD73、CD34、cMyc、klf4、Gata4、oct4、Mef2c 等表面标志物[16],本研究结果再次证明CFs 在不同年龄段均表达nanog、sox2、oct4、scal-1 和c-kit,而以上这些标志物大多都是干细胞标志物。一般认为,能够同时表达3 种以上的干细胞标志物可视为干细胞,因此,笔者认为CFs 具有干细胞特征和高度的幼稚性,是组织分化修复良好的种子储备细胞。本研究和以往研究的不同在于证明了CFs 存在明显的年龄差异。本研究结果显示nanog 分子表达,新生组>3月龄组>1月龄组,随增龄变化先表达下降,后稍上升,但低于新生组;sox2、oct4 的表达,新生组>1月龄组>3月龄组,随增龄变化而下降。这3 个分子对于维持胚胎干细胞亚全能性起关键作用,整体表达随年龄增长而下降,可能与成纤维细胞“干性”减弱有关。而scal-1 的表达,1月龄组>新生组>3月龄组;c-kit 的表达,1月龄组和3月龄组>新生组,但1月龄组和3月龄组表达无差异。由此可见,除scal-1、c-kit 外,新生组其余表面标志物的表达均高于1月龄组和3月龄组,随增龄变化而下降,而scal-1 的表达随增龄变化先升高后下降,c-kit 的表达随增龄变化而升高,在成年后表达趋于稳定。这2 个分子既往被作为心干细胞的表面分子标志物,在成纤维细胞中的表达特点可能与细胞老化导致自身调节“干性”表达升高有关。因此,年龄对细胞表面标志物的表达虽有影响,但并不稳定,无明显的规律性变化。本研究对CFs 成脂、成骨、成心肌诱导结果证实,虽然各组细胞均有多向分化潜能,但成脂能力随年龄增长而下降,成心肌能力随年龄增长先增强,而后有所下降。对各组间分化差异比较显示3月龄组分化潜能与新生组和1月龄组差异无统计学意义。综上提示增龄可影响CFs 的形态变化、生长速度和多种表面标志物表达水平,但对其多向分化能力影响无明显差异,说明CFs 在年龄变化过程中一直保持着较为旺盛的分化能力,这为更好地研究和利用CFs 提供了新的思路。

