灰肉红菇与其相似类群子实体下土壤真菌多样性探究
祁亮亮 吴小建 李俐颖 莫长明 郎宁 陈振妮
摘 要:灰肉紅菇是广西等地特色野生食用菌,生于锥属植物林地,但其与相似类群子实体下土壤真菌多样性研究并不系统,土壤真菌功能未见报道。本研究在广西浦北县同一样地,以灰肉红菇(H)及其相似类群(玫瑰红菇JH,毒红菇FH;白黄乳菇DZ)子实体下土壤为研究对象,采用高通量测序技术,明确土壤真菌的多样性及群落组成、优势类群及其功能。结果表明,H、JH、FH、DZ子实体下土壤真菌均匀度相似,但H丰富度最高,红菇属(H、JH、FH)土壤真菌的丰富度高于乳菇属(DZ);H、JH、FH、DZ共有OTUs 463个,H特有121个;门水平上,H子实体下土壤真菌中子囊菌门与担子菌门丰度较JH、FH、DZ高,DZ与H、JH、FH在球囊菌门、芽枝霉门丰富度上呈极显著差异;属水平上,H子实体下土壤真菌红菇属、丝盖伞属丰度较JH、FH、DZ高,DZ中青霉属、Saitozyma、黄丝曲霉属较其他组别丰度高,大团囊菌属、喇叭菌属、小球腔菌属、Paraphaeosphaeria、丝盖伞属等与H关联度高,与JH、FH、DZ关联度较低,但H、JH、FH、DZ土壤真菌属的丰度无显著性差异;特定物种丰度方面,H中Gliocephalotrichum humicola、Talaromyces ruber、玫瑰红菇较其余组别丰度高,排名前十的物种无显著性差异,但H子实体下土壤真菌Aspergillus citocrescens在同属间(H,FH,JH)两两比较丰度差异达到显著水平。功能方面,H具有共生作用的土壤真菌丰度较高,JH、FH、DZ具有腐生作用的土壤真菌丰度相对较高。本研究为进一步研究灰肉红菇的土壤微生态及核心微生物组奠定了基础。
关键词:灰肉红菇;土壤真菌;多样性;高通量测序;功能预测
中图分类号:S154.3 文献标识码:A
Diversity Research of Soil Fungi under Fruiting Bodies ofRussula griseocarnosaand Its Related Species
QI Liangliang WU Xiaojian LI Liying MO Changming LANG Ning CHEN Zhenni
1. Microbiology Research Institute, Guangxi Academy of Agriculture Sciences, Nanning, Guangxi 530007, China; 2. Guangxi Crop Genetic Improvement and Biotechnology Laboratory, Nanning, Guangxi 530007, China
Abstract:Russula griseocarnosa, a wild edible fungus, is a local product of Guangxi and other places. It is often found on the ground under the forest ofCastanopsis sp.. However, the diversity of the fungi under the fruiting bodies ofR. griseocarnosaand its related groups is not thoroughly studied, and the function of the fungi has not been reported. In this study, the fungi under fruiting bodies ofR. griseocarnosaand its related species (R. roseaJH,R. emeticFH;Lactarius alboscrobiculatusDZ) were studied on the same quadrat in Pubei, Guangxi and the high-throughput sequencing technology was used to clarify the diversity, community composition, dominant groups and functions of soil fungi. The fungal evenness under fruiting bodies of H, JH, FH and DZ was similar, but the fungal richness of H was the highest. The abundance of the fungi in H, JH and FH, which belonged to Genus ofRussula, was higher than that in DZ. H, JH, FH and DZ together had 463 OTUs, and 121 OTUs were found only in group H. At the phylum level, the abundance of Ascomycetes and Basidiomycetes in H was significantly higher than that of others, there was a significant difference between DZ and H, JH, FH in the abundance of Glomeromycota and Blastocladiomycota. At the genus level, the abundance ofRussulaandInocybeunder the fruiting body of H were higher than that of the other groups, the abundance ofPenicillium,SaitozymaandTalaromycesin DZ was higher than that of H, JH, FH. AndElaphomyces,Craterellus, Leptosphaeria, ParaphaeosphaeriaandInocybewere positively correlated with H and negatively correlated with JH, FH and DZ, but there was no significant difference in the abundance between H, JH, FH and DZ. Based on the abundance analysis of specific species, In H,Gliocephalotrichum humicola,Talaromyces ruberandR. roseawere more abundant than other groups. There were no significant differences among the top 10 species in H, JH, FH and DZ, the abundance of soil fungusAspergillus citocrescensunder fruiting body of H was significantly different among the same genera (H, FH, JH). In function, the abundance of soil fungi with symbiotic effect in H was higher, while the abundance of soil fungi with saprophytic effect in JH, FH and DZ was relatively higher. This study further laid a theoretical foundation for the study of soil microecology and core microbiome ofRussula griseocarnosa.
Keywords: Russula griseocarnosa; soil fungi; biodiversity; high-throughput sequencing technology; function prediction
DOI: 10.3969/j.issn.1000-2561.2022.02.024
灰肉红菇(Russula griseocarnosa X. H. Wang, Zhu L. Yang & Knudsen),又名正红菇、大红菌、红椎菌等[1-2],在分类上隶属于红菇目(Russulales)、红菇科(Russulaceae),是一种在中国及东南亚部分地区深受欢迎的野生食用菌[3]。灰肉红菇属外生菌根真菌[2],出菇期土壤pH 5.6~7.0[4-5],林间温度25~27℃,空气相对湿度80%~100%,郁闭度约0.8[6],子实体形成阶段需与锥[Castanopsis chinensis (Sprengel) Hance]形成菌根[7-8]及稳定的土壤微生态环境。研究表明,土壤细菌和真菌与宿主的关系至关重要[9],但是土壤真菌在与植物根际接触的区域(如子实体下土壤)作用更加显著[10-11]。灰肉红菇菌根周围土壤真菌包括子囊菌门、担子菌门、未知真菌[12];相对于马尾松林、桉树林、荔枝林,广西灰肉红菇生境下土壤真菌多样性最低,担子菌门以及红菇属真菌物种丰度较高[13];而蒙古白丽蘑[Leucocalocybe mongolica(S. Imai) X. D. Yu & Y. J. Yao]子实体下土壤真菌丰度最高的为镰刀菌属(Fusarium)[14],蘑菇圈上Sphingobacteriaceae科和Sphingomonadaceae科的丰度最高[15],特有真菌为印度二分枝毛壳[Dichotomopilus indicus (Corda) X. Wei Wang & Samson][16]、假山毛榉木齿菌[Xylodon nothofagi (G. Cunn.) Hjortstam & Ryvarden]等[17]。然而,灰肉红菇虽是特色野生食用菌,但其与相似类群子实体下土壤真菌多样性研究并不系统,土壤真菌功能未见报道。本研究基于高通量测序技术,通过对灰肉红菇及其相似类群子实体下土壤真菌进行分析,明确其土壤真菌多样性及群落組成,确定其优势类群,探讨物种功能。结果可为灰肉红菇子实体下土壤微生态、核心微生物等研究提供依据。
1 材料与方法
1.1 样地选择及相似类群确定
土壤采集地点位于广西浦北县龙门镇滑竹村灰肉红菇监测样地(22°7′32″ N, 109°22′37″ E)。以灰肉红菇(R. griseocarnosa, H)、玫瑰红菇(R. rosea, JH)、毒红菇[R. emetica, FH]、白黄乳菇(Lactarius alboscrobiculatusDZ)等红菇科物种[18]子实体下土壤真菌为研究对象,共计4个组别。
1.2 土壤样品采集与保存
除去表层腐殖质后,从1.1所述物种的菌柄基部沿菌丝走向取子实体下土壤(深度0~5 cm),每个取样点重复取样3份,每份土样约200 g,标记后装入无菌自封袋中,4℃运输,–40℃保存、备用。
1.3高通量测序
土壤样品用干冰送至北京诺禾致源科技股份有限公司进行DNA提取、PCR扩增及高通量测序。扩增片段为真菌ITS2区[19]。根据所扩增区域的特点,基于IonS5TMXL测序平台,利用单端测序(single-end)方法,构建小片段文库进行单端测序。通过对reads剪切过滤[20],获得有效序列,以97%的一致性(identity)进行OTUs(operational taxonomic units)聚类,而后对OTUs代表序列进行物种注释、丰度及多样性分析、特定物种分析及物种功能注释等。
2 结果与分析
2.1土壤样品测序结果
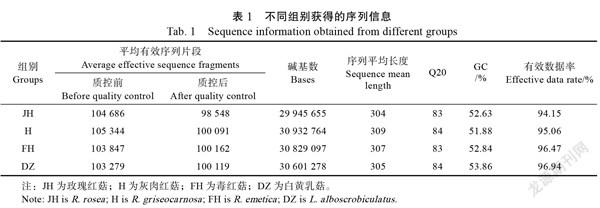
通过对土壤真菌高通量测序分析,有效序列片段经质控及去嵌合体后平均有效片段数在98 548~ 100 162之间,序列长度为304~309个碱基,Q20为83~84,GC含量为51.88%~53.86%,质控后序列有效数据率为94.15%~96.74%(表1),符合后续分析要求。
2.2 样品测序深度及均匀度、丰富度分析
稀释曲线(rarefaction curve)能够反映在一定测序深度上物种多样性是否趋于稳定。如图1所示,当测序深度大于60 000条后,曲线基本趋于稳定,本研究质控后最低测序深度为98 548条,远大于60 000条,说明测序深度能够反映出样本土壤真菌的多样性。
等级聚类曲线(rank abundance)垂直方向平滑程度可反映物种均匀度,而水平方向上的宽度可反映物种丰富度,跨度越大,则物种丰富度越高。由图2可以得出,4个组别在垂直方向上平滑程度相似,故组别间物种均匀度类似;而在水平方向上,略有区别,H子实体下土壤真菌丰富度最高,JH次之,再次为FH,DZ最低;红菇属(H、JH、FH)
土壤真菌的丰富度高于乳菇属(DZ)。
2.3组别间OTU总体分析
供试土壤样品有效序列经97%一致性检验后,对OTU进行物种注释,共注释到3699个OTUs。其中H有1070个,JH有1057个,FH有941个,DZ有631个。4个组别共有OTUs 463个,H特有121个,JH特有128个,FH特有73个,DZ特有39个。红菇属(H、JH、FH)和乳菇属(DZ)共有OTUs 592个,前者特有OTUs 786个。红菇属(H、JH、FH)共有OTUs 686个(图3)。
2.4土壤真菌群落的基本組成
门水平上(图4),4个组别定位到丰度排名前10的类群包括:子囊菌门(Ascomycota, 61.35%)、担子菌门(Basidiomycota, 8.47%)、隐真菌门(Rozellomycota, 0.96%)、毛霉菌门(Mucoromycota, 0.16%)、壶门菌门(Chyridiomycota, 0.23%)、被孢霉门(Mortierellomycota, 0.12%)、球囊菌门(Glomeromycota, 0.07%)和芽枝霉门(Blastoc?ladiomycota, 0.02%)。4个组别均表现出子囊菌门丰度最高,次之为担子菌门;H较其余组别子囊菌门与担子菌门的丰度最高。
属水平上(图5),排名前十的属包括红菇属(Russula)、旋卷孢属(Helicosporium)、木霉属(Trichoderma)、丝盖伞属(Inocybe)、Hyph?odiscus、青霉属(Penicillium)、湿柄伞属(Hy?dropus)、Saitozyma、黄丝曲霉属(Talaromyces)、Chaetosphaeria。在H中,红菇属、丝盖伞属真菌的丰度较JH、FH、DZ明显高,JH中旋卷孢属、Hyphodiscus、湿柄伞属较其他组别丰度高,FH中木霉属、Chaetosphaeria较其他组别丰度高,DZ中青霉属、Saitozyma、黄丝曲霉属较其他组别丰度高。
依据所有样本属水平的物种注释和丰度信息,将丰度排名前35的属在物种和样本2个层面进行分析,绘制物种丰度聚类热图(图6)。由图6可以看出,排名前35的属绝大多数隶属于子囊菌门和担子菌门,依据丰度聚类可以分为4个分枝,且各分枝间属的类别与丰度各不相同。前35的属在4个组别中的相对丰度各不相同,H中有8个丰度明显较高的属,分别为:拟盘多毛孢属(Pestalotiopsis)、齿裂菌属(Coccomyces)、大团囊菌属(Elaphomyces)、喇叭菌属(Craterellus)、小球腔菌属(Leptosphaeria)、Paraphaeosphaeria、丝盖伞属(Inocybe)、拟青霉属(Paecilomyces);JH中有11个丰度较高的属,分别为黑孢霉属(Nigrospora)、树粉孢属(Oidiodendron)、Hyphodiscus、Hydropus、新拟盘多毛孢属(Neopes?talotiopsis)、Terramyces、菌寄生属(Hypomyces)、青霉属(Penicillium)、Talaromyces、Sagenomella、Helicosporium;FH中有2个丰度较高的属,分别为:Trichocladium、Chaetosphaeria;DZ中5个丰度较高的属,分别为:鹅膏属(Amanita)、Euti?arosporella、Arachnopeziza、丽赤壳属(Calon?ectria)、隔指孢属(Dactylella)。对比分析发现,H中大团囊菌属、喇叭菌属、小球腔菌属、Par?aphaeosphaeria、丝盖伞属这5个属的真菌(图6)在H组的丰度较高,在其余组别中丰度相对较低,说明这5个属与H组的关联度较高,与其余组别的关联度较低。DZ中有鹅膏属、Eutiarosporella、Arachnopeziza、丽赤壳属、隔指孢属5个属的真菌与之关联度最高,其中,丽赤壳属、隔指孢属2个属与JH、HF、H呈明显的低关联度。
2.5土壤微生物特定物种的分析
根据不同组别中,注释到的特定物种,筛选出各组丰度排名前10的物种,结果如图7所示。种水平上,排名前10的种包括纤细旋卷孢[Heli?cosporium gracile (Morgan) Linder]、Saitozyma podzolica (Babeva & Reshetova) Xin Zhan Liu, F.Y. Bai, M. Groenew. & Boekhout、Hypomyces australis (Mont.) H?hn.、Gliocephalotrichum humicola L. Lombard, Cheew. & Crous、Penicillium atrosang?uineum B.X. Dong、Trichocladium asperum Harz、Sagenomella striatispora (Onions & G.L. Barron) W. Gams、短密青霉(P. brevicompactumDierckx)、Talaromyces ruber (Stoll) N. Yilmaz, Houbraken, Frisvad & Samson、玫瑰红菇(R. rosea)。由图7可以得出,H中G. humicola、T. ruber、玫瑰红菇比其余组别丰度高;与H、JH、FH相比,DZ中的S.podzolica丰度最高。各组别间排名前10的物种丰度无显著性差异。
在红菇属间(H、JH、FH)对注释到的所有物种进行两两比较分析发现(图8),Aspergillus citocrescens Hubka, A. Nováková & M. Kola?ík(丰度并未出现在前10)在3个组中的相对丰度呈差异显著水平(P<0.05),其他物种并未表现出显著性差异。
2.6 土壤真菌群落功能分析
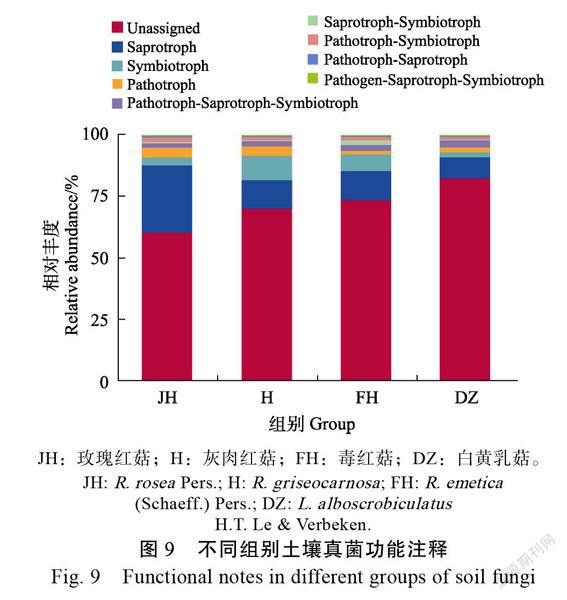
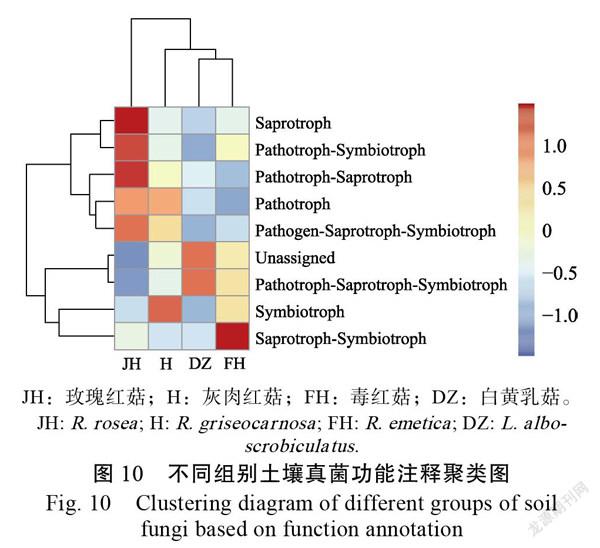
依据样品在数据库中的功能注释及丰度信息,将获得物种注释到具有腐生(saprotroph)、共生(symbiotroph)、致病(pathotroph)等8种功能(图9)。H具有共生作用的物种丰度最高,JH、FH、DZ具有腐生作用的物种丰度相对较高。相对于H、JH、FH,DZ中致病-腐生-共生作用的物种丰度较高。各组别间物种功能丰度并无显著性差异。通过对注释到的功能进行聚类分析(图10)发现,H与共生作用的物种关联度较高,JH与腐生和致病-腐生作用的物种关联度较高,FH与致病-共生作用的物种关联度较高,DZ与致病-腐生-共生作用的物种关联度较高。
3 讨论
细菌和真菌在决定环境与宿主功能方面起到至关重要的作用[9],在陆地生态系统中作用更为明显[10]。一般认为,细菌在土壤微生物中占据着主导地位,且在维持土壤微生境方面发挥着重要作用[21],然而真菌在与植物根际接触的区域(如子实体下土壤)更为重要,且具有更高的相对丰度与多样性[10-11]。由于过多的土壤真菌不能人工培养,本研究运用高通量测序技术,对监测样地内灰肉红菇及其相似类群子实体下土壤真菌进行分析,以期使结果更加接近于真实状态。
本研究发现,不同组别子实体下土壤真菌的均匀度相差不大,但灰肉红菇(H)组具有更高的物种丰富度。门水平上,子囊菌门丰度最高,次之为担子菌门,这与肖冬来等[12]的研究结果相似,但与任奎瑜等[13]的研究结果不同。虽然土壤真菌中大部分属于子囊菌门或担子菌门真菌[22],但是造成上述研究结果不同的原因可能是取样方法、取样地点或取样部位的不同[21]。属水平上,红菇属丰度相对较高,与任奎瑜等[13]的研究结果相似,且灰肉红菇(H)组的红菇属(Russula)、丝盖伞属(Inocybe)丰度明显高于其余组别;属水平上丰度聚类热图分析可将土壤真菌划分为4个不同的分枝,说明4个不同组别具有丰度明显不同的真菌,其关联度各不相同;与H关联度高的大团囊菌属(Elaphomyces)、喇叭菌属(Craterellus)、小球腔菌属(Leptosphaeria)、Paraphaeosphaeria、丝盖伞属(Inocybe)5个属与JH、FH、DZ的关联度相对较低,说明不同大型真菌有可能对子实体下土壤微生态进行重塑[23-24],有益于大型真菌生长的微生物会在一定范围内聚集,可能成为该大型真菌特征性属别。
为了挖掘灰肉红菇(H)、红色红菇(JH)、毒红菇(FH)3个红菇属子实体下土壤真菌多样性的异同,对获得样品进行种水平注释,发现丰度排名前10的物种中,灰肉红菇(H)拥有3个丰度较高特定的物种,但与其他组别并无显著性差异。进一步比较分析定义到的其他物种发现,Aspergilluscitocrescens的丰度在红菇属3组(H、JH、FH)两两比较中差异性达到了显著水平,故推断A. citocrescens可能是灰肉红菇子实体下土壤微生境中的关键物种,可能在根际微生态的形成过程中起到了重要的促进作用[25]。虽然曲霉属真菌一般是腐生真菌,但微生物群对宿主健康的控制可能是由根际微生物之间相互作用介导的,这些相互作用跨越拮抗-互利共生的范畴[10],故A. citocrescens在灰肉红菇侵染锥属植物根系的作用与功能有待于进一步验证。
土壤真菌功能方面,发现H与JH、FH、DZ表现出明显的不同,H具有共生作用的真菌丰度明显较高,而其余3组具有腐生作用的真菌丰富较高。结合物种丰度及特定物种分析,推断曲霉属A.citocrescens的作用有可能是先锋物种,对植物根表皮细胞进行破坏,促进灰肉红菇与锥属植物共生关系的形成,而后与H关联度高的真菌在子实体基部土壤、根际等部位聚集,形成稳定的根际微生态环境,从而促进灰肉红菇的生长。
参考文献
- LI M C, LIANG J F, LI Y C, FENG B, YANG Z L, JAMES T Y, XU J P. Genetic diversity of Dahongjun, the commercially important “Big red mushroom” from southern China[J]. PloS One, 2010, 5(5): e10684.
- WANG X H, YANG Z L, LI Y C, KNUDSEN H, LIU P G. Russula griseocarnosa sp. nov. (Russulaceae, Russulales), a commercially important edible mushroom in tropical China: mycorrhiza, phylogenetic position, and taxonomy[J]. Nova Hedwigia, 2009, 88(1/2): 269-282.
- 黄年来, 林志彬, 陈国良. 中国食药用菌学[M]. 上海: 上海科学技术文献出版社, 2010: 1414-1423.HUANG N L, LIN Z B, CHEN G L. Medicinal and edible fungi[M]. Shanghai: Shanghai Scientific and Technical Literature Press, 2010: 1414-1423. (in Chinese)
- 林平光, 缪绍崇. 永安林区正红菇生态环境调察[C]. 海峡两岸食(药)用菌学术研讨会论文集, 2005, 24: 92-93.LIN P G, MIAO S C. Ecology environment investigation of Russula vinosa in Yongan forest[C]. Symposium on edible mushroom of Cross-strait, 2005, 24: 92-93. (in Chinese)
- 许旭萍, 李惠珍, 黄德鑫. 红菇生态的研究[J]. 中国食用菌, 2001, 20(2): 25-27.XU X P, LI H Z, HUANG D X. Study on ecology of Russula[J]. Edible fungi of China, 2001, 20(2): 25-27. (in Chinese)
- 张振核. 正红菇的生长与生态环境的关系[J]. 福建林业科技, 1995, 22(1): 27-30.ZHANG Z H. Relationship between the growth and the ecological environment of Russula vinosa[J]. Journal of Fujian Forestry Science & Technology, 1995, 22(1): 27-30. (in Chinese)
- 邵 文. 建瓯下坑红菇自然保护区红菇适生环境的调查[J]. 亚热带农业研究, 2008, 4(1): 40-43.SHAO W. Investigation on suitable environment for Russula spp. in Xiakeng nature reserve in Jianou City[J]. Subtropical Agriculture Research, 2008, 4(1): 40-43. (in Chinese)
- SMITH S E, READ D J. Mycorrhizal symbiosis[J]. Quarterly Review of Biology, 2008, 3(3): 273-281.
- BAR-ON Y M, PHILLIPS R, MILO R. The biomass distribution on earth[J]. Proceedings of the National Academy of Sciences, 2018, 115 (25): 6506-6511.
- BAHRAM M, NETHERWAY T, CL?MENCE F, FERRETTI P, COELHO L P, GEISEN S, BORK P, HILDEBRAND F. Metagenomic assessment of the global distribution of bacteria and fungi[J]. Environmental Microbiology, 2021, 23(1): 316-326.
- FISHER M C, HENK D A, BRIGGS C J, BROWNSTEIN J S, MADOFF L C, MCCRAW SL, GURR S J. Emerging fungal threats to animal, plant and ecosystem health[J]. Nature, 2012, 484(7393): 186-194.
- 肖冬来, 陈丽华, 陈宇航, 杨 菁, 黄小菁. 利用变性梯度凝胶电泳分析正红菇菌根围土壤真菌群落多样性[J]. 热带作物学报, 2013, 34(12): 2508-2512.XIAO D L, CHEN L H, CHEN Y H, YANG J, HUANG X J. Analysis of fungal diversity of Russula griseocarnosa mycorrhizosphere soil with denaturing gradient gel electrophoresis[J]. Chinese Journal of Tropical Crops, 2013, 34(12): 2508-2512. (in Chinese)
- 任奎瑜, 赵久成, 郭 霜, 王帅帅, 张传进, 庞师禅, 杨尚东. 红椎林中正红菇生境的土壤肥力及真菌多样性特征[J]. 西南农业学报, 2020, 33(1): 109-116.REN K Y, ZHAO J C, GUO S, WANG S S, ZHANG C J, PANG S C, YANG S D. Characteristics of soil biological properties and fungal diversity of Russula vinosa in Castanopsis hystrix forest[J]. Southwest China Journal of Agricultural Sciences, 2020, 33(1): 109-116. (in Chinese)
- 杨 岳, 魏 杰. 高通量测序分析蒙古白丽蘑蘑菇圈子实体下土壤真菌多样性[J]. 分子植物育种, 2018, 16(10): 3412-3422.YANG Y, WEI J. High-throughput sequencing analysis of the fungal diversity in the soil under the fairy ring fruitbodies of Leucocalocybe mongolicum[J]. Molecular Plant Breeding, 2018, 16(10): 3412-3422. (in Chinese)
- DUAN M Z, BAU T. Grassland fairy rings of Leucocalocybe mongolica represent the center of a rich soil microbial community[J]. Brazilian Journal of Microbiology, 2021, 52: 1357-1369.
- 王 芳, 鲁 铁, 图力古尔. 蒙古白丽蘑蘑菇圈土壤真菌多样性[J]. 菌物研究, 2015, 13(2): 115-121.WANG F, LU T, BAU T. The diversity of soil fungi on Leucocalocybe mongolicum fairy ring[J]. Journal of Fungal Research, 2015, 13(2): 115-121. (in Chinese)
- 刘珊珊, 刘元元, 余彬彬, 成凤凤, 田文辉, 祝建波, 王爱英. 新疆巴音布鲁克草原白蘑蘑菇圈土壤真菌多样性分析[J]. 微生物学通报, 2019, 46(11): 2909-2918.LIU S S, LIU Y Y, YU B B, CHENG F F, TIAN W H, ZHU J B, WANG A Y. Soil fungi diversity analysis of Tricholoma mongolicum mushroom ring in Bayinbuluke grassland, Xinjiang[J]. Microbiology China, 2019, 46(11): 2909-2918. (in Chinese)
- KIRK P M, CANNON P F, MINTER D W, STALPERS J A. Dictionary of the fungi[M]. 10th ed. Wallingford: CAB International, 2008.
- LU L H, YIN S X, LIU X, ZHANG W, GU T, SHEN Q, QIU H. Fungal networks in yield-invigorating and -debilitating soils induced by prolonged potato monoculture[J]. Soil Biology & Biochemistry, 2013, 65: 186-194.
- SCHOSS P D, WESTCOTT S L, RYABIN T, HALL J R, HARTMANN M, HOLLISTER E B, LESNIEWSKI R A, OAKLEY B B, PARKS D H, ROBINSON C J. Introducing mothur: Open-source, platform-independent, community- supported software for describing and comparing microbial communities[J]. Applied & Environmental Microbiology, 2009, 75: 7537-7541.
- SASSE J, MARTINOIA E, NORTHEN T. Feed your friends: Do plant exudates shape the root microbiome?[J]. Trends in Plant Science, 2017, 23(1): 25-41.
- 徐麗慧, 曾 蓉, 高士刚, 戴富明. 土壤真菌多样性对土传病害影响的研究进展[J]. 上海农业学报, 2017, 33(3): 161-165.XU L H, ZENG R, GAO S G, DAI F M. Review on the effects of soil fungal communities on soil-borne diseases[J]. Acta Agriculture Shanghai, 2017, 33(3): 161-165. (in Chinese)
- HINSINGER P, MARSCHNER P. Rhizosphere-perspectives and challenges-a tribute to Lorenz Hiltner 12–17 September 2004-Munich, Germany[J]. Plant & Soil, 2006, 283(1/2): vii-viii.
- KORKAMA T, FRITZE H, PAKKANEN A, PENNANEN T. Interactions between extraradical ectomycorrhizal mycelia, microbes associated with the mycelia and growth rate of Norway spruce (Picea abies) clones[J]. New Phytologist, 2007, 173: 798-807.
- DUPONNOIS R, GARBAYE J. Mycorrhization helper bacteria associated with the Douglas fir-Laccaria laccata symbiosis: Effects in aseptic and in glasshouse conditions[J]. Annales Des Sciences Forestières, 1991, 48(3): 239-251.
-
收稿日期 2021-08-24;修回日期 2021-12-04
基金项目 广西自然科学基金青年基金项目(No. 2018JJB130139);广西自然科学基金面上项目(No. 2019JJA130125);广西
农业科学院科技发展基金项目(No. 2020YM05)。
作者简介 祁亮亮(1984—),男,博士,副研究员,研究方向:大型真菌分类及生态学,E-mail: gx_macrofungi@126.com。

