2种微米级聚苯乙烯颗粒对菘蓝幼苗生长及土壤群落结构的影响
杨雅杰,褚玲珑,宋新山,赵晓祥
东华大学环境科学与工程学院,上海 201620
微塑料(microplastics)是指粒径<5 mm的塑料颗粒和碎片,目前对微塑料的研究已逐步从海洋环境转向土壤环境[1],Boyle和Örmeci[2]的研究表明陆地中微塑料的聚集量有可能达到海洋中的4倍~23倍,微塑料难降解会在土壤中长期存在,此外还会释放增塑剂等污染物[3],微塑料对土壤微生物的运输、代谢等均有影响[4-5]。尤其是微塑料可以进入食物链[6],从而对作物和人体健康产生威胁。塑料地膜覆盖和污泥的土地利用是土壤中微塑料最主要的两大来源[7]。聚苯乙烯被广泛应用于各行各业,但其残余价值低,不易循环再生,会对环境以及其中的动植物和微生物造成极大的影响[8]。
纳米塑料已被证明可以穿透植物细胞壁[9],每种植物对微塑料的吸收取决于多种因素,如根体积、密度和表面积,木质部体积和表面积、汁液酸碱度、蒸腾作用、细胞质和液泡的酸碱度[10-11]。目前一些与微塑料尺寸、形状和表面官能团相似的工程碳质纳米颗粒的研究已经在植物中开展[12],研究表明微塑料可能是通过胞间连丝的内吞作用、离子转运通道、载体蛋白或水通道蛋白以及土壤碳[13]或根际分泌物的调节进入植物体内[9, 14]。菘蓝是十字花科草本植物,俗称“板蓝根”,有很好的清热解毒功效,被广泛使用在医疗领域。目前关于聚苯乙烯纳米塑料对菘蓝的影响探究较少。本研究拟通过盆栽实验研究聚苯乙烯微塑料(PS-NPs)对菘蓝幼苗的生长特性、生理指标的影响,及土培植物根际土壤微生物群落对PS-NPs胁迫的响应。
1 材料与方法(Materials and methods)
1.1 供试材料
供试聚苯乙烯微塑料(PS-NPs)购买自东莞市樟木头广弘高分子材料公司,对材料进行扫描电子显微镜(SEM)表征,其粒径分别为(775.90±61.66) nm (S组)与(50.07±1.29) μm (B组),S组PS-NPs表面较为光滑,B组PS-NPs颗粒表面粗糙程度较高(图1)。2种粒径的供试材料都分布均匀,且形貌规则、无杂质,纯度较高,故视为纯品。实验前将2种微粒进行超声处理(33 kHz,1 h),使其均匀分散在超纯水中。

图1 2种聚苯乙烯微塑料(PS-NPs)扫描电子显微镜(SEM)表征图注:(a) S组PS-NPs(放大×100 k);(b) B组PS-NPs(放大×5.00 k);(c). S组PS-NPs(放大×20.00 k);(d) B组PS-NPs(放大×15.00 k)。Fig. 1 Scanning electron microscope (SEM) characterization images of polystyrene microplastics (PS-NPs)Note: (a) S group PS-NPs (×100 k); (b) B group PS-NPs (×5.00 k); (c) S group PS-NPs (×20.00 k); (d) B group PS-NPs (×15.00 k).
供试菘蓝(Isatisindigotica)种子购自安国市万草同源苗木花卉有限公司,挑选大小均一,颗粒饱满的种子用体积分数为10%的次氯酸钠溶液浸泡10 min后冲洗3~5次,再置于超纯水中浸泡30 min,用滤纸吸干表面水份后均匀放置在土样中,种子埋深约为2 cm,用霍格兰营养液保持土壤含水量60%左右,模拟室温条件(26±2) ℃,发芽期间避光培养,发芽后的生长阶段采用光谱植物生长灯对植物进行光照(12 h∶12 h;辐射量(30±5) W·m-2)。
1.2 供试土壤
土壤采集于上海市松江区农田的表层土(采样深度约为20~25 cm),除去可见植物残渣后过2 mm筛,采用常规方法[15]测定土壤理化性质,结果如表1所示。

表1 供试土壤理化性质Table 1 Physical and chemical properties of experimental soil
1.3 实验设计
针对2种粒径的PS-NPs分别设置4个浓度的污染土壤(10、100、500和1 000 mg·kg-1)(标号为B10、B100、B500、B1000;S10、S100、S500、S1000),以不添加PS-NPs的土壤为对照(CK)。将处理后的菘蓝种子播种在配制好PS-NPs土样里,对照实验中将种子固定在不含PS-NPs的土壤中,每组重复3次。
1.3.1 种子发芽实验
发芽试验每盆设置300 g土,每盆播种种子50粒,当胚芽均超过2 mm时视为发芽,连续3 d没有新芽时视为发芽结束。实验结束后计算种子发芽率。
1.3.2 植株表型实验
菘蓝种子发芽后继续培养,共暴露70 d,培养结束后将植株从土壤中小心取出,用自来水冲洗后再用去离子水冲洗3次,滤纸擦干后摆放整齐进行拍照,用image J软件测量不同处理下菘蓝的株高,称量鲜质量,再将新鲜植株置于65 ℃烘箱24 h后取出,称量质量得到干质量数据。计算各处理下的幼苗含水率和抑制率。

(1)

(2)
1.3.3 指标测定
生长试验每盆设置500 g土,待菘蓝种子长出四片真叶后再暴露14 d收样。取菘蓝叶片用去离子水再冲洗3次后用滤纸拭干表面水份,剩余叶片置于-80 ℃冰箱保存待测。
用电导仪测定外渗液的电解质含量,以表征胁迫对植物细胞膜的伤害。可溶性蛋白测定用考马斯亮蓝G-250染色法[16]、超氧阴离子含量测定参考高俊凤[16]等的方法,丙二醛(MDA)含量测定用硫代巴比妥酸法[17]。叶片抗氧化酶活性测定[18]中,SOD活性测定用氮蓝四唑法,POD活性测定用愈创木酚分光光度法,CAT活性测定用高锰酸钾滴定法。
分别取PS-NPs处理下的土壤(S100、S1000和B100、B1000)及不添加塑料微粒的空白组(CK)土壤,委托上海派森诺生物科技有限公司在Illumina平台对群落DNA片段进行二代双端(Paired-end)测序,测序引物为F: ACTCCTACGGGAGGCAGCA;R: TCGGACTACHVGGGTWTCTAAT,测序区域为16S_V3V4,选用Silva_132数据库,原始数据以FASTQ格式保存,进行DADA2序列去噪和Vsearch聚类,获得OTU代表序列后对其长度分布进行统计,再进行物种分类学注释。
1.3.4 数据统计分析
所有试验数据均进行单因素方差分析,并用误差棒表示标准误差,用Microsoft Excel和SPSS13.0进行处理,用Origin 2018作图,图中所示数据均为3组平行实验的平均值。
2 结果(Results)
2.1 不同浓度聚苯乙烯对菘蓝种子发芽率和生长表型的影响
2.1.1 不同浓度聚苯乙烯对菘蓝种子发芽率的影响
种子萌发是指种子从吸胀作用开始的一系列的生理过程,了解种子的萌发情况对播种后早出苗、出全苗极为重要。在为期25 d的发芽过程里,2种PS-NPs添加下菘蓝种子的发芽率如图2所示。可见PS-NPs对菘蓝种子的发芽有显著促进作用,10 mg·kg-1B组PS-NPs对发芽的促进作用最明显,其发芽率比CK高约30.00%。1 000 mg·kg-1胁迫浓度下S组、B组之间对发芽的促进无显著差异,约比CK高出20.00%。
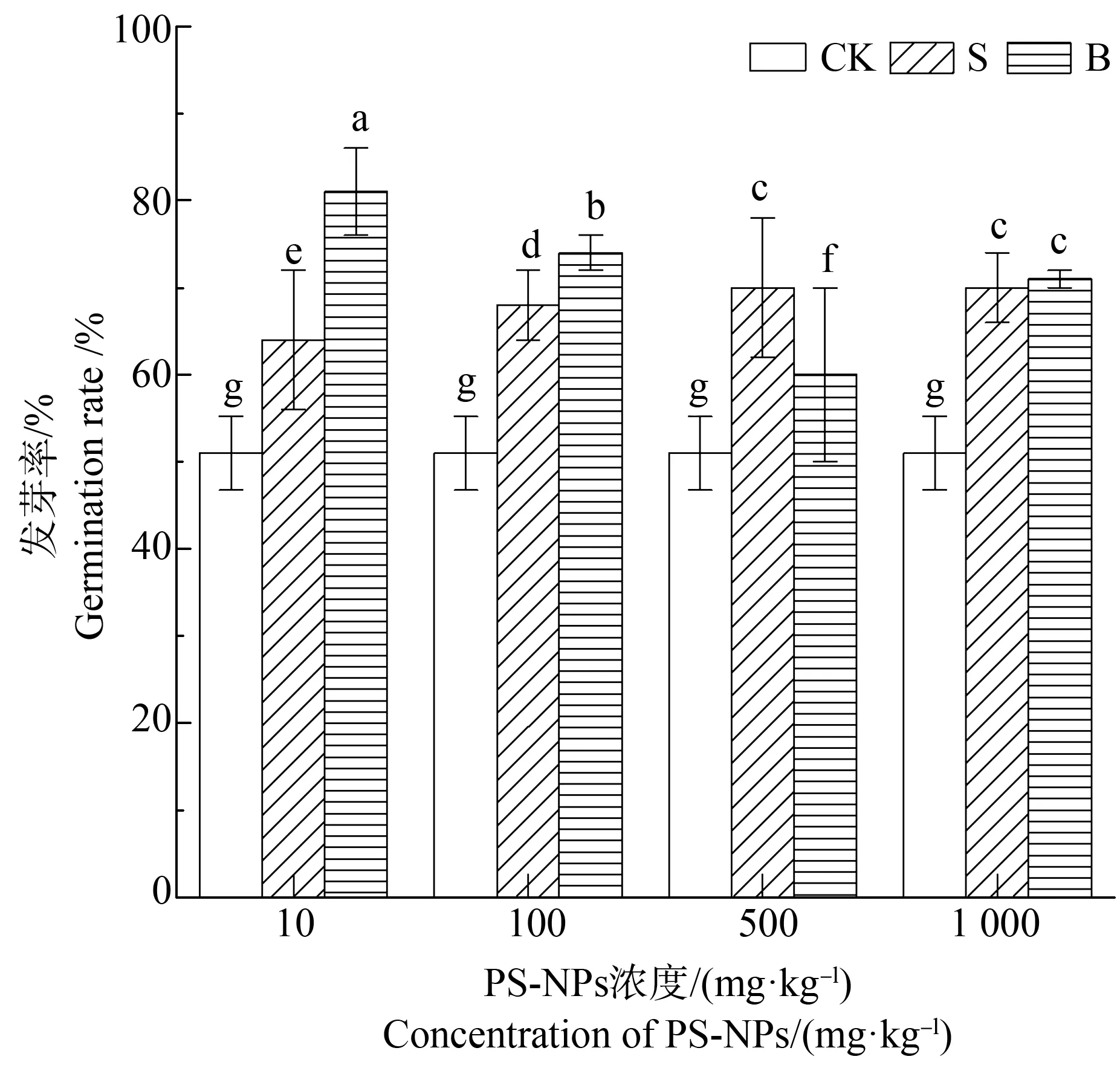
图2 PS-NPs对菘蓝种子发芽率的影响注:字母不同表示差异显著,P<0.05。Fig. 2 The germination rate of Isatis indigotica seeds treated with different particle sizes of PS-NPsNote: Different letters indicate significant differences, P<0.05.
实验中菘蓝种子日发芽情况如图3所示,将发芽过程分为初(3~9 d)、中(11~19 d)、后(19~25 d)3个时期。与CK相比,S处理中发芽初期1 000 mg·kg-1的促进作用明显,中期10 mg·kg-1的处理组发芽数最多;B处理组中发芽初期PS-NPs对发芽率影响不明显,中后期10、100、1 000 mg·kg-1处理下种子的发芽数接近,均高于CK组。
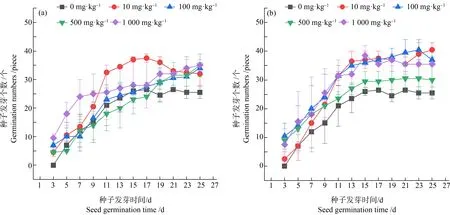
图3 不同PS-NPs处理下菘蓝种子日发芽情况注:(a)S组PS-NPs处理下菘蓝的日发芽数;(b)B组PS-NPs处理下菘蓝的日发芽数;字母不同表示差异显著,P<0.05。Fig. 3 Daily germination of Isatis indigotica seeds treated with different PS-NPs Note: (a) Daily germination numbers of Isatis indigotica with treat-S PS-NPs; (b) Daily germination numbers of Isatis indigotica with treat-B PS-NPs; different letters indicate significant differences, P<0.05.
2.1.2 不同浓度聚苯乙烯对菘蓝植株株高、质量和含水率的影响
株高和鲜质量、干质量是植物学形态调查的基本要素。如表2所示,不同浓度S处理均促进了幼苗株高、鲜质量和干质量,随着胁迫浓度的升高,促进效果减弱;如表3所示,100、500和1 000 mg·kg-1的B处理抑制了幼苗株高,但1 000 mg·kg-1处理对鲜质量的促进率低于500 mg·kg-1;2种PS-NPs对含水率都几乎无影响。
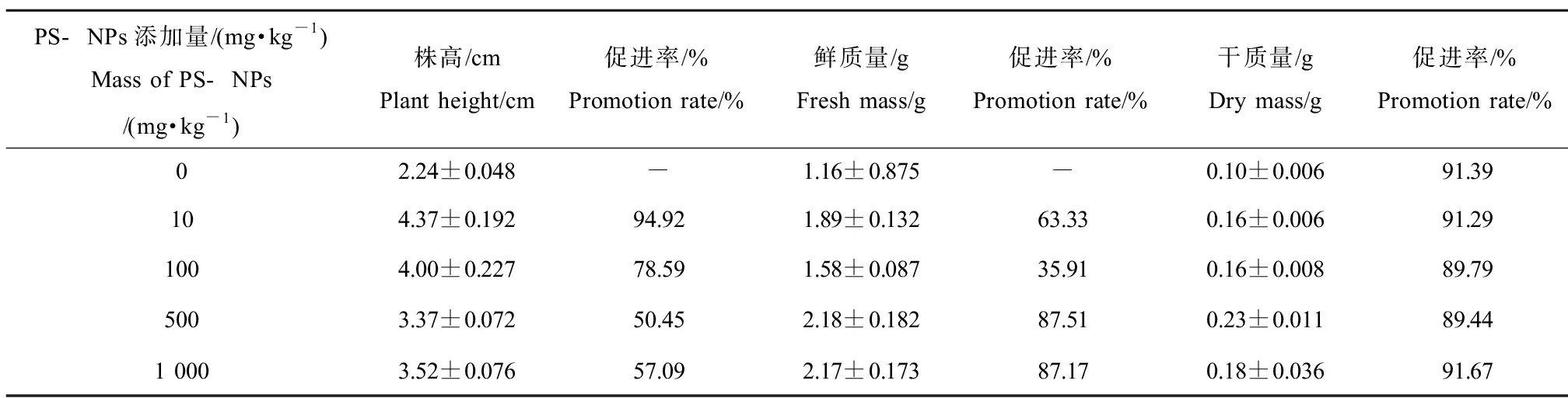
表2 S组PS-NPs处理对菘蓝幼苗生物量的影响Table 2 Effects of S group PS-NPs treatments on biomass of Isatis indigotica seedlings
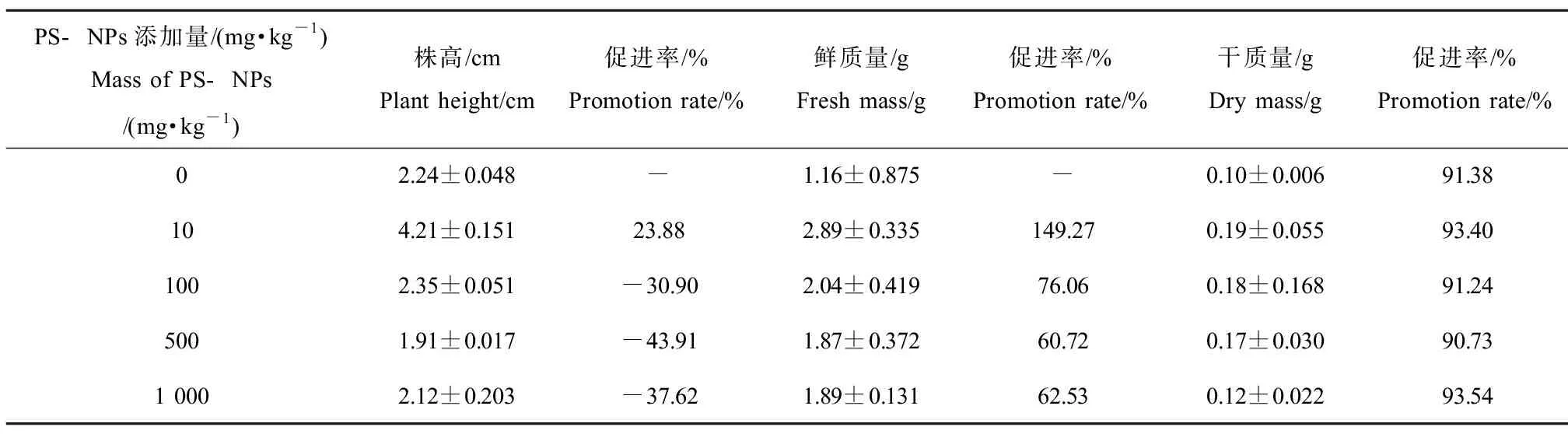
表3 B组PS-NPs处理对菘蓝幼苗生物量的影响Table 3 Effects of B group PS-NPs treatments on biomass of Isatis indigotica seedlings
2.2 不同浓度聚苯乙烯对菘蓝幼苗抗逆性的影响
2.2.1 不同浓度聚苯乙烯对菘蓝叶片细胞膜伤害率的影响
由图4可知,处理组植株叶片细胞膜伤害率均显著高于CK,且S处理对菘蓝叶片细胞膜的伤害率均大于B处理,10、100和500 mg·kg-1的S组PS-NPs比B组对细胞膜的伤害率分别高出11.48%、5.55%和5.24%,此外随着浓度的增加微塑料对细胞膜的伤害率逐步增加,当PS-NPs的浓度为1 000 mg·kg-1时,S组、B组对细胞膜的伤害率达到最大,分别为76.97%和76.30%,约为CK的2.53倍和2.51倍。
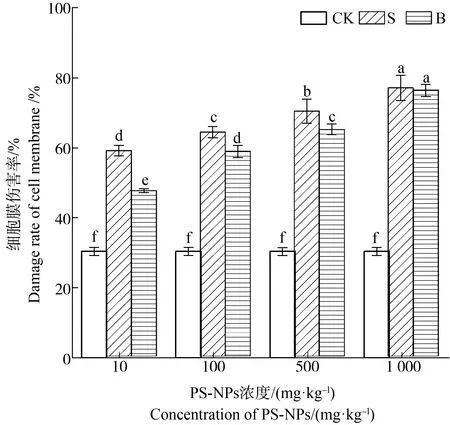
图4 PS-NPs对菘蓝叶片细胞膜伤害率的影响注:字母不同表示差异显著,P<0.05。Fig. 4 Effects of PS-NPs on cell membrane damage rate of Isatis indigotica leavesNote: Different letters indicate significant differences, P<0.05.
2.2.2 不同浓度聚苯乙烯对菘蓝叶片可溶性蛋白含量的影响
可溶性蛋白是重要的调节物质和营养物质,其积累可以提高细胞的保水能力,对细胞的生命物质及生物膜起到保护作用。如图5所示,10、100和500 mg·kg-1不同PS-NPs胁迫下的菘蓝叶片可溶性蛋白含量与CK无显著差异;PS-NPs浓度为1 000 mg·kg-1时S处理可溶性蛋白含量为2.54 mg·g-1,B处理为2.90 mg·g-1,分别比CK高出29.81%和48.25%。
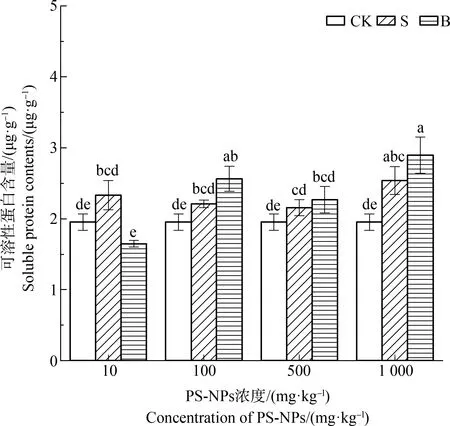
图5 PS-NPs对菘蓝叶片可溶性蛋白含量的影响注:字母不同表示差异显著,P<0.05。Fig. 5 Effects of PS-NPs on soluble protein content of Isatis indigotica leavesNote: Different letters indicate significant differences, P<0.05.
2.2.3 不同浓度聚苯乙烯对菘蓝叶片丙二醛含量的影响
如图6所示,与CK相比PS-NPs胁迫下菘蓝叶片的MDA含量显著升高,并与胁迫浓度呈正相关,在0~500 mg·kg-1浓度范围内S组显著高于B组,1 000 mg·kg-1时S组、B组MDA含量无显著差异,并且可以看出B组植株在500~1 000 mg·kg-1的胁迫浓度范围里MDA含量由0.22 mmol·g-1增加至0.39 mmol·g-1,此阶段升高了76.16%,1 000 mg·kg-1下MDA含量约是CK的7.05倍。
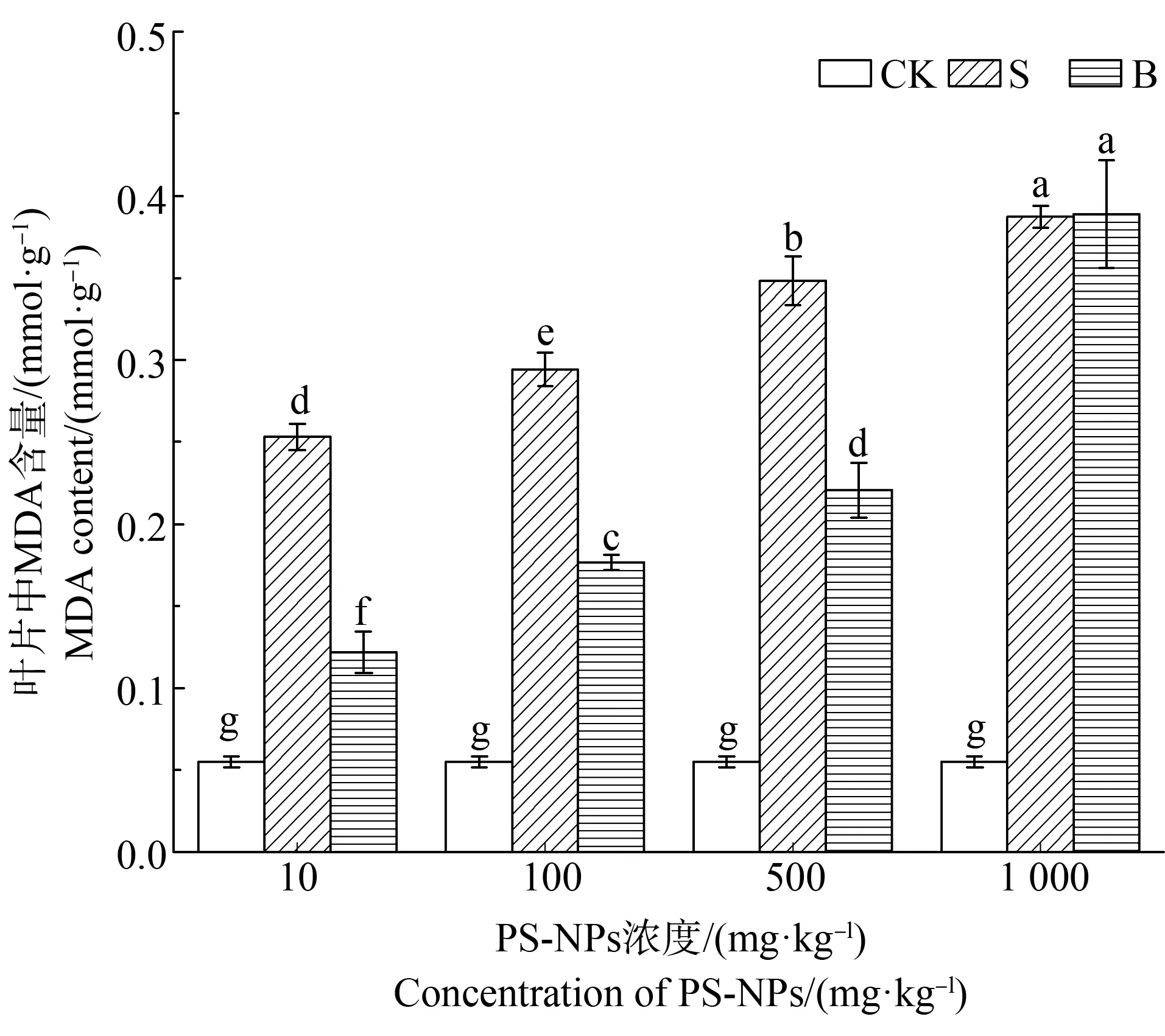
图6 PS-NPs对菘蓝叶片的丙二醛(MDA)含量的影响注:字母不同表示差异显著,P<0.05。Fig. 6 Effects of PS-NPs on malondialdehyde (MDA) content of Isatis indigotica leavesNote: Different letters indicate significant differences, P<0.05.
2.2.4 不同浓度聚苯乙烯对菘蓝叶片抗氧化酶活性的影响
如图7所示,处理组菘蓝叶片中SOD、CAT、POD活性均高于CK。10 mg·kg-1、100 mg·kg-1下S组、B组的SOD活性无显著性差异,CAT、POD活性S组显著高于B组;500 mg·kg-1、1 000 mg·kg-1下B组SOD、POD活性分别约为S组的1.36倍、1.47倍和3.59倍、4.55倍。S组POD活性在试验期间上下波动,1 000 mg·kg-1下达到最大,约为CK的3.57倍;B组CAT活性在500~1 000 mg·kg-1从136.13 U·g-1·min-1跃增至289.08 U·g-1·min-1,增长了1.12倍。
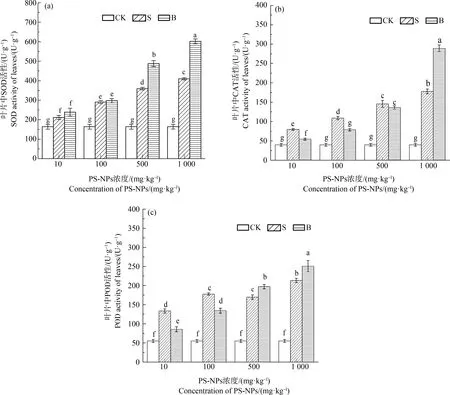
图7 PS-NPs对菘蓝叶片抗氧化酶活性的影响注:字母不同表示差异显著,P<0.05。Fig. 7 Effects of PS-NPs on antioxidant enzymes activity of Isatis indigotica leavesNote: Different letters indicate significant differences, P<0.05.
2.3 不同浓度聚苯乙烯对菘蓝根际土壤细菌群落结构的影响
2.3.1 不同浓度聚苯乙烯对菘蓝根际土壤细菌群落多样性指数的影响
如表4所示,对PS-NPs处理后的植物根系土壤微生物群落多样性进行分析,Shannon指数、Simpson指数反映样品中微生物多样性,Chao 1指数反映样品群落丰富度,Pielou指数反映样品物种均匀度。处理组的Shannon指数均高于CK,说明PS-NPs的添加可以增加样品微生物群落的多样性。胁迫浓度为1 000 mg·kg-1时,B组样品微生物群落Shannon指数、Pielou指数和Chao 1指数分别高出S组7.52%、3.42%和73.06%,而胁迫浓度为100 mg·kg-1时S组分别高出B组17.94%(Shannon指数)、0.11%(Pielou指数)和67.89%(Chao1指数)。
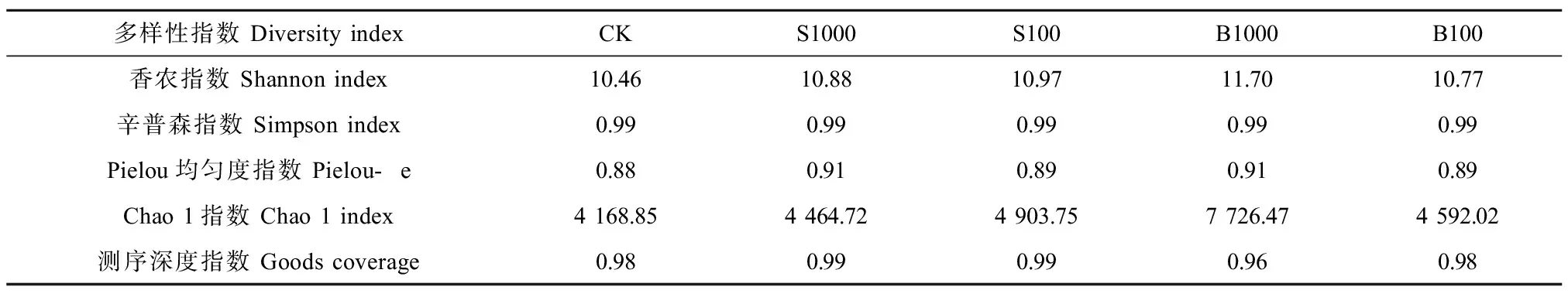
表4 样品生物多样性指数Table 4 Sample biodiversity index
如图8所示,CK组样品中有2 949个OTUs,S组样品中有5 950个OTUs,B组样品中有8 341个OTUs。3个样品共有OTUs数为1 476个,分别占各自OTUs总数的50.05%(CK)、24.81%(S组)和17.70%(B组),可见B组OTUs数目较多且有更多特有的OTUs。由图9可知,处理组样品中的物种丰富度高于CK,3个样品稀释曲线随序列数的增加均趋于平缓,表明测序数据量合理,测序结果真实可信。
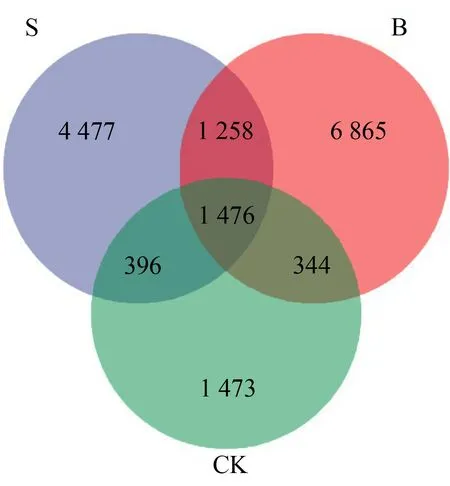
图8 样品中OTUs分布Venn图Fig. 8 Venn diagram on OTUs distribution in sample
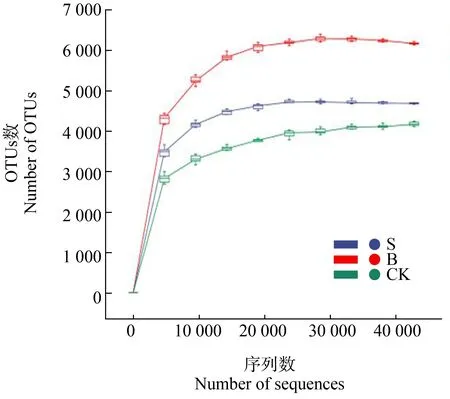
图9 样品中OTUs的稀释曲线Fig. 9 Rarefaction curve of OTUs in sample
2.3.2 不同浓度聚苯乙烯对菘蓝根际土壤细菌群落组成的影响
如图10所示,根据物种注释结果,不同微塑料添加下供试土样门水平上相对丰度大于1%的有8个,分别为放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、Patescibacteria和Latescibacteria。CK组中放线菌门、变形菌门、绿弯菌门、酸杆菌门相对丰度分别为42.78%、27.69%、13.64%、6.73%;与CK相比,S100、S1000、B1000处理中放线菌门丰度分别降低了15.30%、21.87%、21.21%;处理组变形菌门丰度均高于CK,分别提高了31.80%(S100)、25.73%(S1000)、12.64%(B100)、21.68%(B1000)。
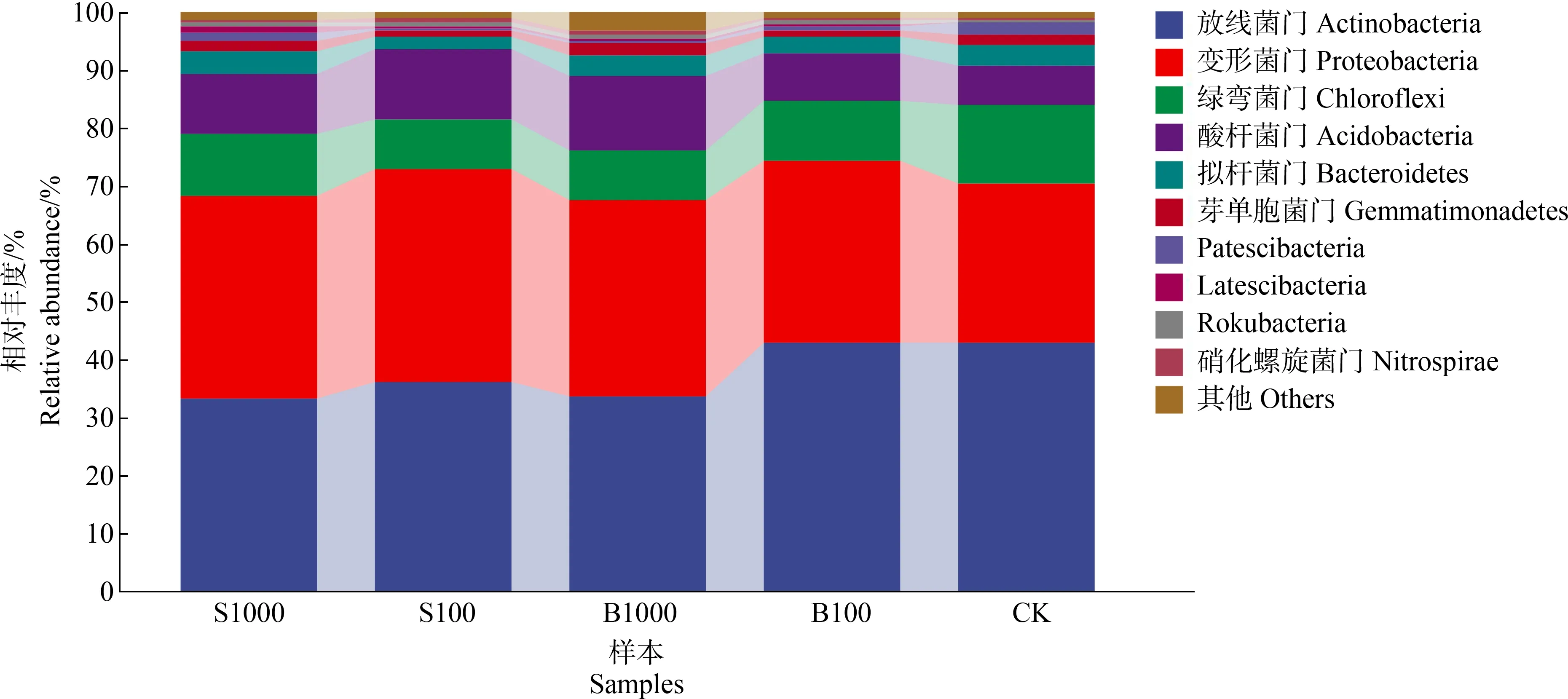
图10 根际土壤微生物门水平物种相对丰度Fig. 10 Relative abundance of horizontal species of rhizosphere soil bacterial flora
3 讨论(Discussion)
3.1 不同浓度聚苯乙烯对菘蓝种子发芽率和生长表型的影响
当PS-NPs添加量较高时激发了种皮对种子的保护机制,在胚胎与周围环境之间形成了屏障,故1 000 mg·kg-1下S组与B组对发芽率的促进作用无显著差异。
处理组植物的形态学指标比CK均有增加,也有研究表明PS-NPs并不会对小麦的根系生长产生抑制[19],徐荣乐和海热提[20]在塑料地膜对小麦种子萌发影响的研究中发现,相同浓度下厚度为0.03 mm的地膜对小麦芽长的影响大于0.08 mm地膜,这也和本实验研究结果一致。
3.2 不同浓度聚苯乙烯对菘蓝叶片细胞膜伤害率的影响
本研究中PS-NPs对菘蓝叶片细胞膜的伤害率均显著高于CK,有研究表明10 mg·L-1的PS-NPs会显著增加小麦叶片中的电解质外渗率[19]。有研究表明较小粒径的微塑料更容易对细胞膜产生伤害,100 nm和300 nm PS-NPs微球中的大分子键在植物茎中发生了断裂[21],小粒径PS-NPs运输至叶片时已经是小分子键,内聚力降低,对叶片细胞膜的伤害程度加深[22]。当胁迫浓度为1 000 mg·kg-1时,过多的PS-NPs已经对叶片表皮、叶肉和叶脉的正常生理过程均产生了影响,此时不同粒径下PS-NPs对叶片细胞膜伤害率无显著差异。
3.3 不同浓度聚苯乙烯对菘蓝叶片抗氧化能力的影响
可溶性蛋白是细胞渗透调节物质,本研究中由于过氧化物酶起到的保护作用过强,导致处理组可溶性蛋白含量虽几乎均略高于CK,但无显著性差异。
植物体内MDA含量的变化可以反映逆境条件下植物细胞膜脱脂化程度和超氧自由基对组织损伤的严重程度[23]。本研究中处理组MDA含量显著高于CK,有研究表明水华微囊藻与蛋白核小球藻细胞内MDA含量在500 mg·L-1纳米聚氯乙烯、纳米聚丙烯胁迫下显著升高[24]。此外较小粒径的PS-NPs会穿透根系进入植物[25],并在蒸腾作用下通过导管吸收,随营养物质一起进入可利用部位(根、叶)[26]。同时本实验中小粒径PS-NPs表面比大粒径更为光滑,因此可以更容易地进入植物中引起较严重的脂质过氧化。当PS-NPs浓度为1 000 mg·kg-1时,S组、B组的MDA含量无显著差异,表明此时微塑料粒径不再是影响MDA含量的主要因素。相比之下,菘蓝叶片MDA含量对PS-NPs的敏感性高于可溶性蛋白。
3.4 不同浓度聚苯乙烯对菘蓝叶片抗氧化酶的影响
外在胁迫使植物产生更多的活性氧自由基(ROS),SOD、CAT和POD都是植物体内清除活性氧自由基的保护酶,SOD作为清除ROS的第一道防线可催化超氧化物自由基将其歧化为H2O2和O2,随后CAT和POD将H2O2歧化为H2O和O2[27-28],这也可以解释本实验中SOD活性均相应地高于相同处理下的CAT和POD活性。
胁迫浓度为10 mg·kg-1和100 mg·kg-1时,S组与B组SOD活性无显著差异,当胁迫浓度为500 mg·kg-1和1 000 mg·kg-1时,大粒径的PS-NPs增强了SOD编码基因的表达[29],故B组SOD活性高于S组。Jiang等[30]的研究表明蚕豆在聚苯乙烯微塑料的胁迫下其SOD活性增加,并且通过遗传学证明100 nm的PS-NPs比5 μm的PS-NPs对蚕豆有更强的氧化损伤,这和本次实验结果一致。
处理组CAT活性均显著高于CK,有研究表明在塑料微珠对铜绿微囊藻胁迫的1~9 d内,藻细胞CAT活性显著增高[31]。10 mg·kg-1和100 mg·kg-1浓度下S组CAT、POD活性均大于B组,1 000 mg·kg-1浓度下S组CAT、POD活性小于B组,这与高浓度胁迫下SOD歧化产生的H2O2更多有关。此外1 000 mg·kg-1下S组与B组POD的活性差值小于CAT的活性差值,因为POD是ROS清除同工酶,会通过多种不同的调节机制应对环境压力,其生物体耐受阈值低于CAT[32]。
Li等[21]研究了100、300、500和700 nm的PS-NPs微粒对黄瓜幼苗的抗氧化酶系统影响,结果表明SOD和CAT的相关基因表达量与颗粒大小呈显著负相关,这与本实验结果相反,这由于本实验中聚苯乙烯微粒粒径较之更大,材料表面形貌、胁迫浓度均不相同等因素导致。
3.5 不同浓度聚苯乙烯对菘蓝根际土壤微生物群落结构的影响
Zhang等[26]在对新疆棉田微生物群落多样性和组成的研究中发现微塑料存在的土壤中放线菌门和变形菌门丰度最高,这与本实验得到的结果一致。添加PS-NPs的土壤与CK优势菌门相同,但丰富度有所变化。与CK相比,添加PS-NPs后土壤中变形菌门、酸杆菌门丰度升高。变形菌门通常生活在较松弛的土壤中,PS-NPs本身具有一定的柔韧性,有利于其与土壤结合,因此影响了土壤容重。此外碳作为PS-NPs的主要成分,其添加也会影响土壤中碳的形态与含量,使变形菌门丰度变高[33]。有研究表明添加聚乙烯微塑料会影响土壤酸碱性,即微塑料的长期存在会使土壤酸化[34],而酸杆菌门的丰度与pH呈负相关,故本研究中PS-NPs添加组土壤酸杆菌门丰度高于CK。
与CK相比PS-NPs添加使土壤的绿弯菌门丰度降低,研究表明,微塑料会影响土壤含水率和铵态氮含量,而绿弯菌门丰度受此二者影响,故微塑料的添加不利于绿弯菌门生长[35]。
与CK相比100 mg·kg-1PS-NPs降低了拟杆菌门的丰度,1 000 mg·kg-1PS-NPs则增加了其相对丰度,芽单胞菌门有相同的变化特征。因为较高浓度的微塑料提高了土壤中荧光素二乙酸水解酶(FDAse)和酚氧化酶的活性[36],植物的愈伤反应会使呼吸作用增强并释放酚类物质,酚类物质可被酚氧化酶氧化为具有提高微生物的自我保护能力的醌类物质[12, 37]。
有研究表明微塑料可以通过直接吸附影响土壤酶活性,从而改变土壤的物理性质和微环境[36]。在本研究中S组材料粒径更小更容易团聚,团聚体的结合力更大;B组材料排列整齐紧密且表面凹凸不平。此外二者在土壤中不同的降解性能会进一步影响微生物群落结构,但具体的降解性能、降解产物还有待进一步探究。结果显示100 mg·kg-1浓度下S组群落多样性大于B组,由图1可知S组材料的结构比表面积更大,为微生物提供了更多的栖息位点;但当胁迫浓度为1 000 mg·kg-1时B组群落多样性大于S组,因为高浓度刺激了某些微塑料的微生物降解过程,目前大量研究表明在陆地环境中放线菌门的某些种可以通过合成水解酶来生物降解微塑料。
综上,在2种粒径PS-NPs对菘蓝的胁迫研究中,胁迫浓度>10 mg·kg-1时B组会抑制幼苗株高,不同浓度下S组、B组对鲜质量均有促进作用;随着胁迫浓度的增加不同粒径的PS-NPs对叶片细胞膜的伤害程度趋于一致;不同处理下SOD活性均高于CAT、POD活性,3种酶的活性都与胁迫浓度呈正相关,1 000 mg·kg-1下粒径对其影响更为显著。添加PS-NPs的土壤与CK优势菌门相同但丰度不同,处理组变形菌门、酸杆菌门丰度升高,而绿弯菌门丰度降低,微生物群落丰度与材料表型有关。但聚苯乙烯微塑料在环境中由于降解形成的单体,以及塑料添加剂给植物与土壤带来的影响还有待进一步研究。

