数字PET二十年
邱 奥, 张 博,2, 肖 鹏,3,4, 谢庆国,3,4
(1.华中科技大学 生物医学工程系, 武汉 430074; 2. 合肥锐世数字科技有限公司, 合肥 230093; 3.武汉光电国家研究中心, 武汉 430074; 4. 中国科学技术大学 电子工程与信息科学系, 合肥 230052)
0 引言
正电子发射断层成像(Positron Emission Tomography,PET)出现于1973年,是一种具有高特异性和高生化灵敏度的分子影像技术,能直接观测活体内的生理生化过程[1-2],在癌症、神经系统疾病、心血管疾病的机理研究、早期诊断、精准治疗、预后评估和药物开发方面能够发挥重要作用[3-10]。
早期的PET采用模拟电子学的方式处理信号,通过电荷积分器和时间甄别器分别获取闪烁脉冲的能量和时间,并通过符合电路进行事件的筛选,最终得到各条响应线上的计数[11-13]。模拟电子学在架构上对PET的性能提升有诸多制约。在探测器层面上,模拟器件的精度有限且遗失了闪烁脉冲波形、噪声和下降时间等信息,致使波形函数、噪声模型和衰减时间等先验知识无法被利用和编码[14-19];在系统层面上,模拟器件构成的系统难以实现模块化,重构系统几何时需要全盘改变符合电路等硬件设备,缺乏灵活性[20-22]。为了解决模拟PET的种种局限,数字PET的概念被提出[23-24]。这种模式下,前端硬件只负责对闪烁脉冲的精确数字化,所有的数据都被传输到后端,通过软件完成从脉冲重构到医学信息发掘的全链条处理。硬件被极小化,算法的重要性被提升到了新的高度。
研制数字PET的首要难点在于对高速闪烁脉冲的精确数字化。光电器件输出的闪烁脉冲信号具有极快的上升/下降沿。根据香农采样定理,以模数转换器件(Analog-to-Digit Converter, ADC)来实现闪烁脉冲精确数字化,采样率需达到GHz级[25-26]。但是,高速ADC用于PET中的海量信号通道有价格高和功耗高的缺点,导致这样的PET系统在造价和功耗上均不具备可行性。面对困境,当前折衷的办法是采取模数混合的架构,即先让脉冲经过模拟器件的整形被拉宽放慢,再用速度较低的ADC进行采样[27-29]。模数混合的思路虽然缓和了数字化与功耗和价格之间的矛盾,但预处理环节的模拟器件改变了闪烁脉冲的模型,引入了新的误差,先验知识依然得不到有效利用。此外,拉宽放慢的脉冲也限制了探测器计数率的提升。
2004年,多电压阈值(Multiple Voltage Threshold, MVT)方法被提出,首先解决了PET系统中高速闪烁脉冲数字化的难题,实现了精确采样和全数字处理,使得数字PET的研制成为可能[30]。MVT通过设置若干可编程的阈值,以低廉的硬件成本实现对闪烁脉冲精确采样,进而利用先验知识重构出精确的脉冲,再提取其中丰富的信息。数字PET技术以MVT为源头已建立了完整的技术体系,且其创新正向着PET创新链的上下游环节延展,为关键材料、核心器件、智能算法和应用研究带来了新的机遇。本文回顾了数字PET诞生的背景,介绍了MVT方法、数字PET探测器、数字PET系统,并展望了基于数字PET平台创新可能产生的问题与机遇,以供相关研究者探讨。
1 MVT方法
MVT方法提出于2004年。有别于传统的等间隔时间采样方法[31-32],MVT的基本原理是,将预设阈值与信号产生的一系列交点作为采样点,实现模拟信号的数字化。MVT在信号的值域上设置一组阈值,信号达到阈值时记录过阈值时间(图 1),将阈值和过阈值时间组成的一系列MVT采样点作为原始信号的离散化。MVT方法刻画脉冲的精细度取决于阈值的数量和排列方式。处理信号的上升沿和下降沿时,MVT采样点的数目不依赖于信号的变化率,只与值域中阈值的密度有关,因此适合高速脉冲信号的采样。MVT方法目前已被运用在了PET、高能物理实验、X-射线安检成像和中子探测等领域[33-34]。
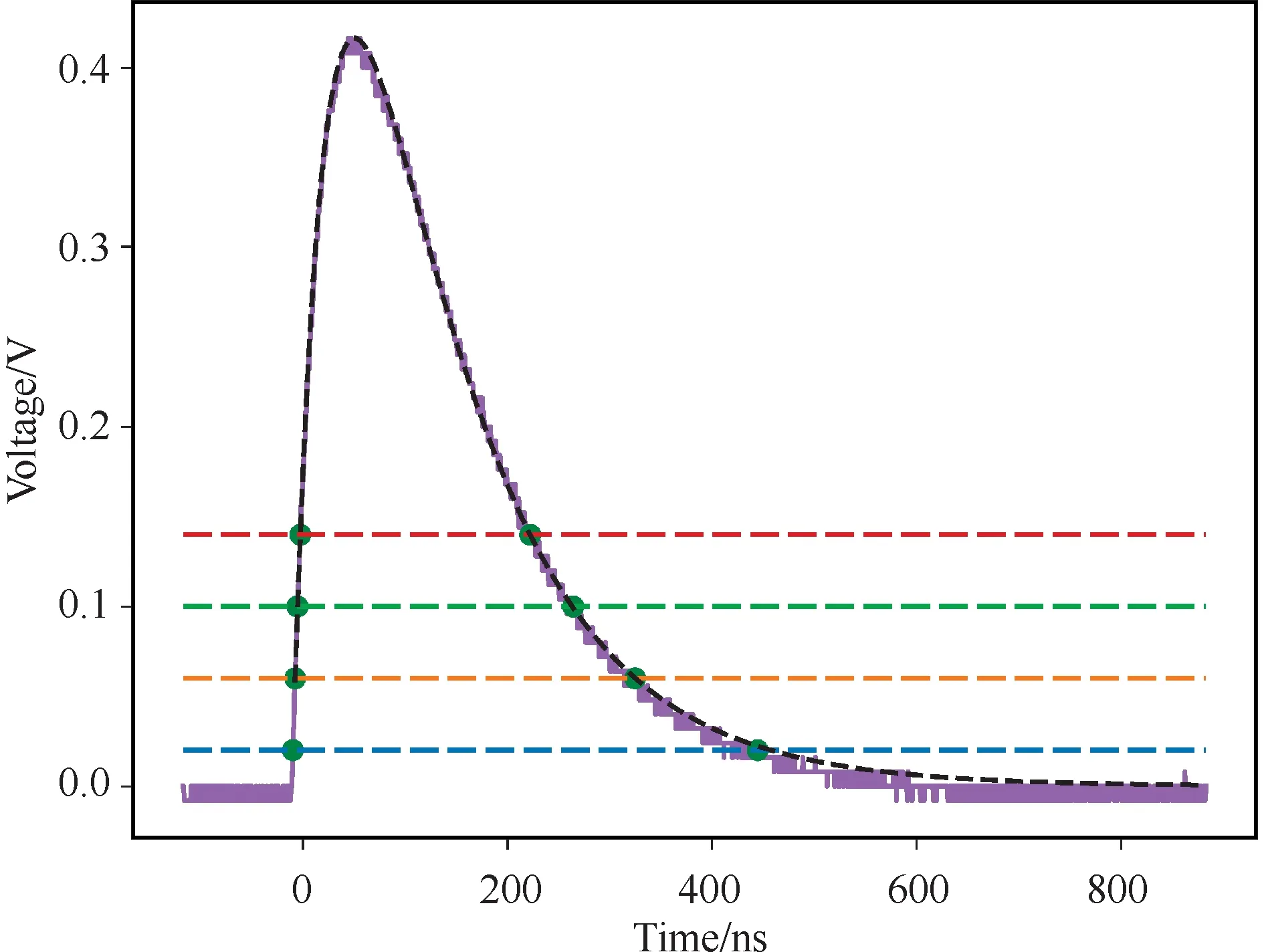
图1 闪烁脉冲MVT采样和拟合
MVT方法运用信号的先验知识,以达到欠采样条件下的脉冲重构,减少了所需的阈值数量。以基于在硅光电倍增器(Silicon Photomultiplier,SiPM)的PET为例,闪烁脉冲近似服从双指数模型:
V(t)=V0(e-(t-t0)/τ1-e-(t-t0)/τ2)
(1)
式中,V0为脉冲幅值参数;t0为脉冲的到达时间;τ1、τ2为脉冲衰减时间。以脉冲波形模型为目标函数,MVT方法通过对采样点进行拟合来重构波形,进而积分得到脉冲的能量,取零点得到脉冲的到达时间。当阈值数大于未定参数时拟合效果较好,拟合效果随着阈值数的增加而提升,但提升幅度趋于减小。对闪烁物理过程理解的加深有望带来更精确的脉冲模型,提供更丰富的先验知识,从而减少所需的阈值数目,提高脉冲重构的精度。
从MVT出发,Sine-MVT等新方法得到了发展。Sine-MVT将原本时不变的阈值电压替换为信号发生器产生的正弦信号,使得采样点数量增加,降低对脉冲函数模型依赖性的同时提升了能量分辨率[32]。类似的,Time-over-threshold(ToT)在形式上也是利用电压阈值来对脉冲进行采样。该方法将脉冲正向、负向渡越阈值时产生的两个采样点简化为采样点的时间差值,并认为时间间隔和脉冲能量成比例,从而直接计算出脉冲的能量值,但没有重构出脉冲的精确波形[35-36]。
2 数字PET探测器
数字PET探测器是数字PET系统实现的基础。2008年,第一代基于MVT方法的数字PET探测器研发成功,为世界首套模块化设计的PET探测器。2013年,基于可编程逻辑门阵列(Field Programmable Gate Array, FPGA)的MVT电子学实现方式被提出,MVT实现得到大大简化,并允许人们轻易地改变MVT的实现形式而无需硬件上的重大调整[37]。在必要时,基于FPGA的数字PET探测器也可以被转化为专用集成电路的形式。在FPGA中,工作在低压差分信号(Low-Voltage-Differential-Signaling, LVDS)接受器模式的微分I/O被用作电压比较器。一个闪烁脉冲被分为多路信号,每一路都被输入到一个LVDS比较器中。LVDS比较器的逻辑输出被接入到两路时间数字转换器(Time-to-Digital Converter, TDC)中,以确定信号正向渡越和反向渡越阈值的时间。渡越时间与阈值电压组合为MVT采样点,其数量为阈值数的2倍(图2)。基于FPGA的MVT电子学实现被提出后,数字PET探测器取得了新发展(图3)。2013年,基于硅光电倍增器(Silicon Photomultiplier, SiPM)的数字PET探测器研发成功[38];2014年,72通道级数字PET探测器研发成功[39];2016年,空间分辨率达到0.7 mm的超高空间分辨率数字PET探测器研发成功[40]。随着MVT专用集成电路的发展,数字PET探测器有望更加集成化和模块化。

图2 MVT电子学实现架构[35]

图3 数字PET探测器
在数字PET的定义下,前端硬件只负责对闪烁脉冲的精确数字化,所有的数据都被传输到后端,通过软件完成从脉冲重构到医学信息发掘的全链条处理。基于MVT的数字PET探测器遵循了“硬件极小化”的设计思想,即探测器硬件仅完成MVT信号的采样和传输,板上不进行任何存储和计算,而将所有的信号、数据相关的处理、计算交给上位服务器乃至云端处理。数字PET探测器可以像乐高一样轻易地搭建成自定义的空间结构而无需探测器硬件上的改动,只需在软件层面上定义对应的系统几何即可完成成像。随着配套软件的完善,数字PET探测器朝着不断简化系统搭建复杂性、降低用户系统搭建门槛的方向发展,可望实现即插即成像(Plug-and-imaging, PnI),即探测器相互连接的同时软件自动构建系统几何并完成相应图像重建程序的编程,从而大大简化构建系统的复杂性[41-43]。
针对脉冲的精确采样,国内外还出现了多条尝试研制数字PET探测器的技术路线。2013年,基于ToT方法的多通道LuAG-APD PET探测器获得报导。2014年,基于ToT专用集成电路的小动物PET原型机研制成功[44-45]。2009年,飞利浦数字光子计数(Philips Digital Photon Counting, PDPC)展示了其首款数字SiPM,其对单个单光子雪崩二极管的输出进行数字化[46-47]。2012年,基于PDPC SiPM的PET探测器原型得到评估[48-49]。2011年,waveform sampling电路被用于飞行时间PET探测器[50-52]。
3 数字PET系统
基于MVT方法的数字PET系统由软件算法驱动,所有的处理,包括脉冲的重构、能量时间信息的提取、事件的符合、图像重建、图像处理和医学信息挖掘,均由软件算法执行。

图4 数字PET系统[57]
在科学仪器和医疗器械方面,小动物PET和临床PET研制成功,并投入到生物医学研究和临床使用。2010年,小动物数字PET的研发获得成功,被用于动物体代谢的成像,显示出数字PET用于生物医学科学研究的潜力[53-55]。2015年,首台临床全数字PET设备DPET-100研制成功,并于2019年取得中国药品监督局三类医疗器械注册证,成功进入中国医疗市场[56]。2022年,临床数字PET后续型号DigitMI 930取得三类医疗器械注册证,时间分辨率优于249 ps,在0.12 mCi/kg注射剂量下最快能20 s完成单床位扫描[57]。

图5 数字PET成像结果
在创新系统方面,质子刀PET、植物PET、头盔PET和双动态PET得到发展。2020年,数字PET首次质子治疗中在线在束剂量监测获得报导,可望实现质子治疗的闭环反馈控制[58]。面向脑科学研究,数字PET技术产生了系统结构呈半球形的头盔数字PET,相比传统结构具有更高的灵敏度[59]。得益于数字PET平台赋予系统设计的灵活性,对清醒、自由活动动物进行动态成像的双动态数字PET和对植物成像的植物数字PET等新设计不断出现,为生物医学研究提供了多种多样的工具,并且持续推动着数字PET探测器和PET算法创新。
4 数字PET创新链机遇
在数字PET的范式下,采样方法的创新对信号特性有了新需求,从而创新可以向创新链前后端延展。关键材料朝着空间编码发展;核心器件朝着全数字化发展;智能算法可望提前到脉冲的采样和重构乃至系统几何的定义,并覆盖直到医学信息发掘的全链条,为深度学习等算法的应用提供了想象空间。
在关键材料方面,硅酸钇镥(Lutetium-yttrium Oxyorthosilicate, LYSO)闪烁晶体由于具有高光产额、快衰减、高密度以及化学性质稳定等特性,已成为PET设备中主流晶体材料[58]。数字PET探测器可获取闪烁脉冲中反映LYSO晶体几何和物理性质的信息,如光分布情况和衰减时间参数,并可望通过这些性质在空间上对闪烁晶体进行编码,以达到高空间分辨率和获得伽马光子沉积深度信息的目的。对LYSO晶体的编码可在生长中进行,例如在生长中控制LYSO晶体不同区域的发光波长和衰减时间,也可在加工中进行,如用激光内雕技术在晶体中蚀刻出折射率不同的区域[61]。
在光电器件方面,当前的数字PET多是在光电转换器后端进行数字化,在硬件上不够集约,同时数字-模拟-数字的转换模式限制了闪烁脉冲的信号完整性,制约了PET性能的进一步提升。2017年,基于标准CMOS工艺的SiPM芯片获得报导[62],使得在SiPM上集成逻辑单元更为便利。在此基础上,MVT的数字化思路有望前推至SiPM层面,通过特殊设计的逻辑单元设置一系列光子数阈值,当光子数突破预设阈值时记录时间,从而实现光子数目水平的直接数字化。
在智能算法方面,数字PET从脉冲采样到图像重建全流程中的丰富数据都是对外部算法开放的,是完全可编程、可自定义的,算法的重要性被提升到了新的高度。脉冲采样得到的采样点与脉冲的能量和时间存在多元隐函数关系,有望通过深度学习实现从采样点到能量和时间的直接映射[63]。数字PET具有即插即成像的模块化特性,可在同一系统中使用优势不同的探测器,通过运用异质图像重建算法,可望实现高于传统PET的空间分辨率[64-65];也可由医生等使用者自定义几何结构,或是与电子顺磁共振相结合[66],像乐高积木一样搭建应用专用的数字PET。部署在各个医院的数字PET可望产生大量患者的成像数据,脱敏后通过Rayplus、Real-world Evidence等平台形成开源的医学影像数据库,在深度学习的帮助下源源不断地产生新知识[67-68]。
在应用研究方面,数字PET为生物医学研究提供了新手段,已被用于多项研究。在心脏用设备方面,数字PET被用于可提高心脏功能和组织修复的心脏外膜设备研究[69]。在非酒精性脂肪肝研究方面,数字PET被用于靶向CASP8和FADD样细胞凋亡调节剂改善非酒精性脂肪性肝炎[70]和Tmbim1多泡体调节剂预防非酒精性脂肪性肝病研究[71]。在肿瘤学研究方面,数字PET被用于通过肿瘤细胞微粒的柔软度调节药物递送效率[72]和通过调节结直肠癌小鼠肠道微生物群增强化疗反应研究[73]。在示踪剂研究方面,数字PET具有快速成像特性,为短半衰期示踪剂的应用创造了条件,是新型示踪剂研究和应用的理想平台。
5 总结
MVT解决了数字PET高速闪烁脉冲精确数字化的难题,而数字PET为PET定义了一种新的范式:前端硬件只负责对闪烁脉冲精确采样,全部的数字信号都被传递到后端计算机,所有的处理,包括脉冲的重构、能量时间信息的提取、事件的符合、图像重建、图像处理和医学信息挖掘,均由软件算法执行。换言之,数字PET从脉冲采样到图像重建全流程中的丰富数据都是对外部算法开放的,是完全可编程、可自定义的。
在临床医学方面,数字PET在向着规模化应用发展。其技术创新与进步有望降低PET检查成本,普及PET诊断手段,推动癌症和阿兹海默症等疾病的早发现、早治疗。在科学研究方面,数字PET为生物医学研究提供了新手段,为药物开发模式提供了新思路,并反过来从需求端牵引光电技术和闪烁晶体的创新。

