舜皇山母猪与长×大二元杂母猪肠道微生物多样性的比较分析
陈 丹,尹业师,李百元,陈华海,胡云霏
(湖南科技学院化学与生物工程学院,中国湖南 永州 425199)
舜皇山母猪(Shunhuangshan sow),学名“东安猪”,主产于湖南省永州市东安县舜皇山,是永州本地的土猪品种,属于肉脂兼用型,同时也是沙子岭猪种之一[1],2012年被国家质量监督检验检疫总局批准列入国家地理标志保护产品,2015年入选由中国质检出版社、中国标准出版社联合出版的《中国地理标志产品大典·湖南卷》[2]。独特的地理、气候、水文、土壤环境以及生产工艺,造就了舜皇山母猪独特的品质,使其具备肉色鲜艳、肉质鲜美、口感好等特点[3]。长×大二元杂母猪(Landrace-Yorkshire binary sow)是指长白公猪与约克母猪杂交生产的母猪,是目前常见的规模化、集约化养殖品种,是瘦肉型的商品猪[4~5]。地方土猪虽然在生长速率、生产成本等方面与引进的杂交猪品系有较大差距,但地方土猪本身的品种特性,以及地方特色饲养环境,使其具备了与周围环境的高度适应性,因而展示了高繁殖性能、耐粗饲、抗逆性、优良肉质等方面的特性[6~7]。这些特性的形成可能与其特殊的肠道微生物群组成紧密相关[8]。
文献报道,哺乳动物的胃肠道中有大约103种细菌,猪胃肠道内每克腔内物或粪便沉淀含有1010~1011个微生物,它们通过与宿主的相互作用,在营养物质的消化和吸收、防止病原体定植、维持和调节机体正常黏膜的免疫与代谢平衡等宿主生理功能方面发挥重要作用[9~12]。在健康的肠道中,某些种类的微生物群落总是保持着大量且恒定的数量,这有助于营养物质的再利用和维生素的产生[13]。猪群肠道微生物的组成受多种因素的影响,如品种、饲养环境、饲料、传染病、抗生素的使用等[14~15]。报道显示,不同品种的猪肠道菌群组成不同,而国外品种(瘦肉型)和中国品种(相对肥胖型)的差异格外明显[16]。同时,饲养方式对猪肠道微生物也有较大的影响[8]。舜皇山母猪具有杂食性,以粗粮为食,多采用散养方式,本地的饲料资源,如稻谷、碎米、米糠、豆腐渣、红薯、麦麸以及丛生于田间地头的禾间菜、野花生、千层楼、四轮草、水竹叶等几十种优质牧草,均可食用[1]。正是这种植食性的无抗喂养方式,造就了舜皇山母猪独特的肉质和耐粗饲、抗病能力强等性能,而这些品质的形成与肠道微生物群密切相关,推测可能存在特殊的益生菌。因此,深入了解猪肠道微生物的组成和特征,挖掘其在抗病以及耐粗饲料等方面的作用,开发肠道内特殊的益生菌,对我国养殖动物的健康、畜产品质量的升级以及养猪业的持续稳定发展均具有重要作用。
本研究以同一养殖场的舜皇山母猪和商品化猪(长×大二元杂母猪)肠道微生物为研究对象,通过16S rDNA高通量测序技术以及生物信息学技术对两种品系猪肠道微生物的组成和多样性进行分析,解析两个品系猪肠道微生物菌群的结构,寻找两个品系猪肠道微生物的差异信息,从而揭示肠道微生物在抗病以及耐粗饲料等方面的作用。
1 材料与方法
1.1 样品采集
2018年12 月,在湖南永州东安县恒惠农牧有限公司生猪养殖场实地采集舜皇山母猪及普通商品化长×大二元杂系列母猪(以下简称二元杂母猪)成熟阶段的粪便样品。舜皇山母猪样本5组,编号M;二元杂母猪样本6组,编号ER,置于4℃冷藏,2 h内运至实验室。将采集的样品置于超净工作台内,分别称取0.2~0.3 g,装入2 mL离心管内。剩余样本用7 mL离心管分类分装,放入-80℃超低温冰箱冷冻保存。
1.2 样本总DNA提取
按照柱式细菌DNA提取试剂盒(北京天恩泽基因科技有限公司)标准化操作流程提取舜皇山母猪以及二元杂母猪粪便样品中的细菌总DNA,简要步骤如下:在装有粪便样本的2 mL离心管中加入0.5 mL 65℃预热的溶液A,剧烈震荡10 min,65℃水浴5 min;12 000 r/min离心3 min后转移上清,加入等体积的溶液B,上下颠倒混匀,冰浴5 min;12 000 r/min离心3 min,转移上清,加入0.2 mL氯仿,震荡混匀;12 000 r/min离心3 min,小心转移上清至新离心管中,加入0.8 mL的溶液C,上下颠倒30 s混匀,分两次加入吸附柱;12 000 r/min离心30 s,弃废液,加0.7 mL通用洗注液,随后12 000 r/min离心30 s,弃穿透液;再加0.3 mL通用洗注液,12 000 r/min离心30 s,弃穿透液;空管12 000 r/min离心1 min,随后将吸附柱转移至干净的2 mL离心管中,加入100 μL DNA洗脱液2.0,室温静置2 min;12 000 r/min离心30 s,得到细菌总DNA。将获得的总DNA进行琼脂糖凝胶电泳分析,并用微量紫外分光光度计检测其浓度和纯度,最后将其置于-20℃保存备用。
1.3 16S rDNA高通量测序
将提取的细菌总DNA分别取60 μL送往杭州利贞生物医药科技有限公司,利用 Illumina MiSeq平台进行16S rDNA V3~V4区高通量测序,测序引物为通用引物341F(5′-CCTACGGGNGGCWGCAG-3′)和 805R(5′-GACTACHVGGGTATCTAATCC-3′),其中 N 表示 A、C、G、T 的任何一种,W表示A或T,H表示A、C或T,V表示A、C或G。测序原始数据上传NCBI数据库,获得的GenBank序列号为PRJNA644137。
根据公司提供的样本OTUs(operational taxonomic units)及物种注释信息,利用Visual Genomics-AS-v1.4.1软件中的“Alpha Diversity Analysis”模块计算每个样本的ACE指数、Chao指数、Shannon指数及覆盖率,用以分析单个样本的物种丰富度及均匀度,并利用SPSSAU-v20.0(https://www.spssau.com)对不同品种样本的ACE指数、Chao指数、Shannon指数及覆盖率在线进行t检验分析,考察两个品种样本的物种多样性差异。利用“Beta Diversity Analysis”模块比较不同品种间的微生物多样性,考察两个品种间是否具有显著的微生物群落差异。同时,对相同猪种不同样本的OTU丰度求平均值,选择平均相对丰度大于0.01%的OTUs,并利用Bioinformatics&Evolutionary Genomics网站(http://bioinformatics.psb.ugent.be/webtools/Venn/)在线制作Venn图,以分析两个品系猪种共有OTU数目。然后,通过“Community Structure Analysism”模块分析各品系猪肠道微生物的门水平组成及属水平组成,利用SPSSAU-v20.0在线分析肠道微生物组成的丰度差异,并利用Microsoft Excel绘制门水平和属水平的微生物组成条形图。最后,通过“Lefse Analysis”模块分析不同品种猪肠道内差异显著的物种。
2 结果与分析
2.1 α多样性分析
ACE指数和Chao指数是估计物种总数的常用指数,两者数值越大,表明群落的丰富度越高。Shannon指数常用来估算样品中微生物的多样性,其数值越高,表明群落的多样性越高。覆盖率(coverage)反映的是测序深度。由表1可知,舜皇山母猪样本和二元杂母猪样本的测序深度较高,覆盖率在98.90%以上。此外,舜皇山母猪的ACE指数、Chao指数和Shannon指数均高于二元杂母猪,且舜皇山母猪的ACE指数显著高于二元杂母猪(P<0.050 0),说明舜皇山母猪肠道中的物种丰度及菌群结构的复杂性更高。
表1 16S rDNA高通量测序数据的α多样性分析Table 1 Alpha diversity analysis of high-throughput sequencing data of 16S rDNA genes(±s)
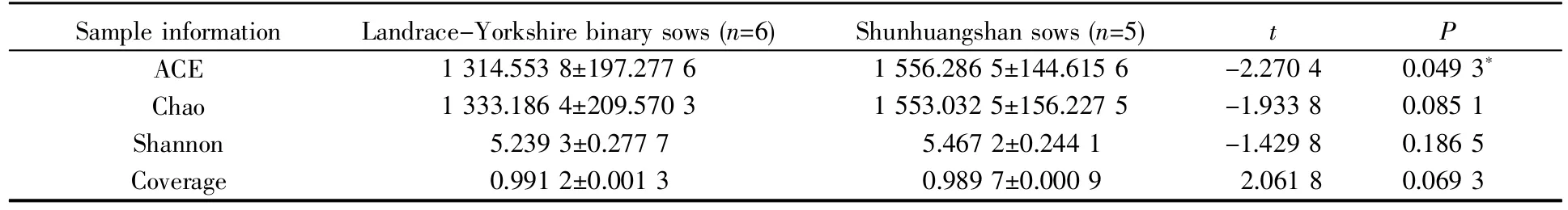
表1 16S rDNA高通量测序数据的α多样性分析Table 1 Alpha diversity analysis of high-throughput sequencing data of 16S rDNA genes(±s)
Sample information ACE Chao Shannon Coverage Landrace-Yorkshire binary sows(n=6)1 314.553 8±197.277 6 1 333.186 4±209.570 3 5.239 3±0.277 7 0.991 2±0.001 3 Shunhuangshan sows(n=5)1 556.286 5±144.615 6 1 553.032 5±156.227 5 5.467 2±0.244 1 0.989 7±0.000 9 t P-2.270 4-1.933 8-1.429 8 2.061 8 0.049 3*0.085 1 0.186 5 0.069 3
2.2 β多样性分析
PCoA图主要反映样本组间的差异,两点之间的距离越近,表示两者的群落构成差异越小。图1的结果显示,舜皇山母猪的5份样品聚成一类,整体上明显与二元杂母猪样品分为了两类(图1A),说明两个品系猪种之间的肠道微生物存在较大差异。进一步用Venn图分析两个猪种共有的OTUs,结果显示,331个OTUs为二元杂母猪特有,323个OTUs为舜皇山母猪特有(图1B)。二元杂母猪的样本之间距离较远且分布疏散,说明二元杂母猪样本之间的微生物组成存在较大差异。舜皇山母猪的样本之间距离相对较小,说明虽然舜皇山母猪样本之间的微生物组成存在差异,但差异性低于二元杂母猪样本。

图1 肠道微生物β多样性分析图(A)PCoA分析图;(B)基于OTUs的Venn图。Fig.1 β-Diversity analysis of intestinal microbial flora(A)Diagram of PCoA;(B)Diagram of Venn based on OTUs.
2.3 肠道微生物菌群的结构分析
根据各样本OTUs分类结果进行物种注释,结果显示:舜皇山母猪和二元杂母猪粪便样本中共检测到9个门、11个纲、18个目、32个科和47个属。
在细菌门分类水平上,舜皇山母猪和二元杂母猪的肠道微生物均以拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、螺旋体门(Spirochaetes)为主,但舜皇山母猪肠道中厚壁菌门(45.69%)与拟杆菌门(38.64%)的比例(F/B)高于二元杂母猪肠道中厚壁菌门(41.74%)与拟杆菌门(46.18%)的比例(图2)。厚壁菌门、拟杆菌门、螺旋体门在舜皇山母猪和二元杂母猪肠道中的平均总丰度分别为92.86%和94.05%。
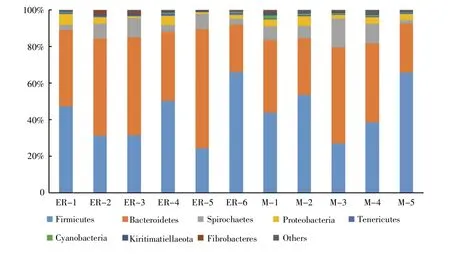
图2 门水平物种组成图Fig.2 The microbial compositions of each sample at the level of phylum
合并同属制图,发现两种品系猪肠道微生物群的优势种类在属水平上存在一定的相似性,均以Muribaculaceae、普雷沃氏菌科(Prevotellaceae)、产粪甾醇真细菌(Eubacterium coprostanoligenes)、瘤胃球菌科(Ruminococcaceae)、密螺旋体属(Treponema)、Christensenellaceae 等为主,但它们的相对丰度存在较明显的差异(图3)。普雷沃氏菌科在二元杂母猪样本中的含量(14.00%)明显高于舜皇山母猪样本(9.39%),而密螺旋体属在舜皇山母猪样本中的含量(7.71%)明显高于二元杂母猪样本(4.82%)。此外,毛螺菌科(Lachnospiraceae)和链球菌属(Streptococcus)在舜皇山母猪样本中的含量显著高于二元杂母猪样本(P<0.050 0)。

图3 属水平物种组成图在属水平上未能准确鉴定的,用其所隶属的科描述。Fig.3 The microbial compositions of each sample at the level of genusThose uncertain species at the genus level are described at the family level.
2.4 肠道微生物的组间差异分析
利用Lefse进一步分析两个品种之间特异性细菌类群的富集情况,结果发现:二元杂母猪肠道微生物中丰度差异显著高于舜皇山母猪的物种有15种(P<0.050 0),包括普氏菌属(Prevotella)、黄杆菌属(Flavonifractor)、乳酸菌属(Lactobacillus)、小球菌属(Subdoligranulum)、Holdemanella、Solobacterium、粪杆菌属(Faecalibacterium)、粪球菌属(Coprococcus)、活泼瘤胃球菌(Ruminococcus gnavus)、Ruminococcus gauvreauii、柯林斯氏菌属(Collinsella)等(图4)。

图4 通过Lefse分析获得的微生物区系的系统发育分布图无显著差异的物种统一着色为黄色,差异物种跟随组(红和绿)进行着色,其中红色为二元杂母猪肠道中的微生物,绿色为舜皇山母猪肠道中的微生物。Fig.4 Cladogram of microbiota phylogenetic distribution obtained from Lefse analysisThe species with no significant differences are uniformly colored in yellow,and those with significant differences are colored in red or green.Red and green show the microorganisms in the intestinal tracts of Landrace-Yorkshire binary sows and Shunhuangshan sows,respectively.
舜皇山母猪肠道微生物中丰度差异显著高于二元杂母猪的物种有28种,包括毛螺菌科(Lachnospiraceae)、香味菌属(Myroides)、弯曲杆菌属(Campylobacter)、葡萄球菌属(Staphylococcus)、链球菌属(Streptococcus)、厌氧孢杆菌属(Anaerosporobacter)、Dorea、Lachnoclostridium、氏菌属(Roseburia)、产乙醇醋弧菌(Acetivibrio ethanolgignens)、产氢厌氧杆菌属(Hydrogenoanaerobacterium)、颤螺菌属(Oscillospira)、互营单胞菌属(Syntrophomonas)、奎因氏菌属(Quinella)、红杆菌属(Rhodobacteraceae)等(图4)。此外,在舜皇山母猪丰度差异显著的物种中,毛螺菌科的细菌有10种(图5)。

图5 舜皇山母猪与二元杂母猪毛螺旋菌科细菌的差异比较(A)毛螺菌科NK4B4;(B)毛螺菌科UCG_010;(C)产乙醇醋弧菌;(D)氏菌属;(E)毛螺菌科XBB1006;(F)厌氧胞杆菌属;(G)Dorea;(H)毛螺菌科UCG_002;(I)Lachnoclostridium 10;(J)毛螺菌科XPB1014。图中实线为丰度信息的平均值,虚线为丰度信息的中值。Fig.5 Comparison of Lachnospiraceae bacteria between Shunhuangshan sows and Landrace-Yorkshire binary sows(A)Lachnospiraceae NK4B4 group;(B)Lachnospiraceae UCG_010;(C)Acetivibrio ethanolgignens;(D)Roseburia;(E)Lachnospiraceae XBB1006;(F)Anaerosporobacter;(G)Dorea;(H)Lachnospiraceae UCG_002;(I)Lachnoclostridium 10;(J)Lachnospiraceae XPB1014 group.The solid and the dotted lines in figures display the average value and median value of abundance information,respectively.
3 讨论与结论
本研究采用高通量DNA测序方法,对同一养殖场的舜皇山母猪和二元杂母猪的肠道微生物进行研究,结果发现:舜皇山母猪肠道微生物的物种丰度及菌群结构的复杂性均高于二元杂母猪(表1),且两个品种猪肠道的微生物差异较大(图1)。相比于二元杂母猪,舜皇山母猪的饮食更为复杂和多样,它能以当地的几十种牧草为食[1],而这种植食性的无抗喂养方式造就了舜皇山母猪肠道微生物群落的高度多样性,这与Lau等[17]的报道一致,即杂食性的动物具有更多样化的肠道微生物群。微生物多样性是肠道健康的良好指标[18],感染了流行性腹泻病毒的猪和新生仔猪[19]、患有炎症性肠病[20]和腹腔疾病[21]的人类,其肠道细菌的多样性均较低。因此,舜皇山母猪抗病能力强的特性,可能也与其肠道微生物的高多样性密切相关。
进一步对两个品种猪的肠道微生物群结构进行研究,在门水平分析中发现,同一养殖环境下的舜皇山母猪与二元杂母猪的肠道优势菌群具有一定的相似性,均以厚壁菌门(F)与拟杆菌门(B)为优势菌群,但两者的丰度(F/B比例)存在明显差异(图2)。目前已报道的资料显示,猪肠道微生物中F/B越高,其脂肪沉积速率也越高,体内脂肪贮存则越多[22]。舜皇山母猪与二元杂母猪F/B的差异,与两者分别为肉脂兼用型和瘦肉型的品质特征一致,这进一步说明猪群肠道微生物门水平丰度的差异与猪群的品种特征存在相关性。
属水平分析结果显示,舜皇山母猪和二元杂母猪肠道微生物的优势菌群在种类上存在一定的相似性,均以Muribaculaceae、普雷沃氏菌科、产粪甾醇真细菌、瘤胃球菌、密螺旋体属、Christensenellaceae等为主(图3),这与已有文献报道的猪肠道微生物的优势菌属存在一定差异。文献报道,杜长大杂交猪的肠道优势菌属主要是乳酸菌、链球菌、瘤胃菌科和梭菌[8];相同饲养条件下,梅花猪和长白猪的肠道优势菌属依次是普氏菌、乳酸菌、拟杆菌和链球菌[23]。上述文献报道的优势菌均含有乳酸菌和链球菌,而在舜皇山母猪和二元杂母猪肠道中,乳酸菌和链球菌的丰度并不高(<1.20%),这种差异可能与饲养环境以及养殖方式有关。
此外,两种品系猪肠道内差异显著的物种分析结果显示,二元杂母猪有15种细菌的含量显著高于舜皇山母猪,包括乳酸菌属、粪球菌等益生菌,乳酸菌在宿主的消化吸收方面具有重要作用,这可能与二元杂母猪具有更快的生长速率有关;舜皇山母猪有28种细菌的含量显著高于二元杂母猪,其中包括毛螺菌科和链球菌属细菌(图4~5)。文献报道,毛螺菌科细菌参与机体碳水化合物的代谢、细胞组分的合成和能量转换等过程,具有降解纤维素和半纤维素的能力,同时也是丁酸盐等短链脂肪酸的产生菌[24~25],因此,舜皇山母猪的优良肉质以及耐粗饲特性可能与肠道中富含毛螺菌科细菌有关。另一方面,毛螺菌是一类产丁酸菌,丁酸是肠道上皮细胞所偏好的能源物质,能够调节肠道的能量代谢,具有抗炎、促进黏液合成的功能;并且,丁酸可作为组蛋白乙酰化酶抑制剂调节宿主基因表达等[26~29]。由此推测,毛螺菌在舜皇山母猪的抗病能力方面可能也发挥了重要作用;文中发现的舜皇山母猪特有的毛螺菌,可能具有很高的益生菌开发潜力。此外,在消化道疾病相关的致病菌丰度的差异方面,虽然舜皇山母猪肠道内含有的多种致病菌的丰度显著高于二元杂母猪,特别是致病性链球菌属的细菌,但舜皇山母猪反而显示了相比于二元杂母猪更强的抗病能力,其胃肠道相关疾病发病率和死亡率均低于二元杂母猪,这可能与土猪整体肠道微生物群更高的多样性、稳定性和其他未知特殊抗病性菌群有关,这也赋予了土猪抗病性强的品种特性。
综上所述,即使在同一养殖环境下,不同品种猪肠道的微生物在门水平的丰度上存在显著差异,而这种差异与猪群的品种特征存在相关性。此外,具有特定功能的肠道菌群,其种属上的显著差异与猪品种的肉质、抗病性以及耐粗饲有较大相关性。舜皇山母猪肠道微生物群整体具有更高的多样性、稳定性,这赋予了它抗病性强、耐粗饲的品种特性,同时其又具备一些特有的潜在益生菌群资源,值得更深入的挖掘和研究。