猫血清白蛋白在毕赤酵母中的分泌表达
赵明明,李星颖,江文康,樊全宝,赖健仪,何 诗,何 静,白银山,刘璨颖,陈胜锋,陈志胜,张 晖,王丙云
(佛山科学技术学院生命科学与工程学院,佛山 528231)
猫血清白蛋白(feline serum albumin,FSA)是血清中含量最高、功能较多的一种蛋白质,在临床上主要用于治疗猫失血或烧伤引起的休克、低白蛋白血症、肝硬化及肾病引起的水肿等疾病。目前临床上所用的血清白蛋白制剂大多是从血液中提取[1-2]。但猫血清的供应不足、复杂的血清来源及病毒经血液传播的风险都严重限制了FSA的产业化生产,寻找一种新的FSA生产方法尤为重要。在过去的几十年里,关于白蛋白的表达研究已涉及到大肠杆菌、酵母、动物和植物等表达系统[3]。人血清白蛋白的表达最早可追溯到1981年,Lawn等[4]首次将人血清白蛋白在大肠杆菌内成功表达。1996年,Hilger等[5]通过提取猫肝脏总RNA,经RT-PCR测定了编码FSA基因的完整核苷酸序列。之后,Reininger等[6]将重组猫白蛋白在大肠杆菌中表达为带有His标签的蛋白。除此之外,在真核表达系统方面,陈林涛等[7]于2018年成功构建重组人血清白蛋白植物表达载体。王晶宇等[8]成功在昆虫细胞中表达出犬白蛋白-干扰素α2融合蛋白。目前,血清白蛋白的表达研究以人血清白蛋白为主,而类似于犬、猫等小动物的研究较少,且市场上流通的多为人和牛的血清白蛋白,在宠物临床上,有时会使用人血清白蛋白来治疗重症狗和猫,但这种治疗非常昂贵,且会发生过敏反应[9],存在较大争议。为进一步探索FSA的生产方法,本研究将优化后的FSA碱基序列通过电击转化的方法转入毕赤酵母GS115菌株中,并通过Western blotting验证其表达情况,旨在构建FSA表达系统,为FSA的进一步工业化生产奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒 毕赤酵母GS115购自Thermo公司;大肠杆菌DH5α感受态细胞购自上海唯地生物技术有限公司;重组质粒FSA-pPIC9K由南京金斯瑞生物科技有限公司合成;空白质粒pPIC9K购自湖南丰晖生物科技有限公司。
1.1.2 主要试剂及仪器 质粒提取试剂盒购自上海惠凌生物技术有限公司;Q5高保真聚合酶购自New England Biolabs公司;限制性内切酶EcoRⅠ、NotⅠ、SalⅠ及核酸共沉剂均购自宝生物工程(大连)有限公司;Anti-Cat Albumin Antibody和Donkey Anti-Goat IgG H&L均购自Abcam公司;G418购自大连美仑生物技术有限公司。PCR仪购自Thermofisher公司;Gene Pulser Xcell电穿孔仪和快速半干转印仪均购自Bio-Rad公司。
1.2 方法
1.2.1 重组质粒的构建及鉴定 在GenBank查找并获取了FSA基因序列(登录号:NM_001009961),全长1 827 bp,根据FSA氨基酸序列及毕赤酵母密码子的偏爱性优化密码子,交付南京金斯瑞生物科技有限公司进行化学合成并通过酶切位点EcoRⅠ和NotⅠ插入载体pPIC9K上,构建重组质粒,命名为FSA-pPIC9K。取2 μL FSA-pPIC9K重组质粒与大肠杆菌DH5α感受态细胞轻轻混匀,静置后于45 ℃水浴中热激45 s,冰盒中静置,接种于不含抗生素的LB液体培养基中,于37 ℃摇床复苏1 h,之后涂布于含有氨苄青霉素的LB平板上,37 ℃培养过夜。挑取单菌落于LB液体培养基中,37 ℃培养16 h,用质粒小提试剂盒提取质粒,进行PCR与双酶切验证。
根据优化后FSA的碱基序列设计1对引物,引物序列为:FSA-F:5′-CGGAATTCATGAAATG-GGTTACTTTCATTAGCTT-3′;FSA-R:5′-TAA-AGCGGCCGCTCACGCCAAAGCTGCTT-3′,下划线部分分别为EcoRⅠ和NotⅠ酶切位点。引物由生工生物工程(上海)股份有限公司合成。为保证扩增的保真性,本试验采用Q5高保真聚合酶进行目的基因的扩增,PCR反应体系25 μL:Q5 Buffer(5×) 5 μL,dNTPs(10 mmol/L) 0.5 μL,上、下游引物(10 μmol/L)各1.25 μL,DNA模板5 μL,Q5高保真聚合酶(2 000 U/mL) 1 μL,加dH2O补至25 μL。PCR扩增程序:98 ℃预变性30 s;98 ℃变性5 s,68 ℃退火10 s,72 ℃延伸35 s,共30个循环;72 ℃延伸10 min;4 ℃保存。将PCR产物进行1.0%琼脂糖凝胶电泳检测。同时用限制性内切酶EcoRⅠ和NotⅠ对提取的质粒FSA-pPIC9K进行双酶切,用空质粒pPIC9K作为对照,37 ℃酶切4 h,将2种酶切产物进行1.0%琼脂糖凝胶电泳检测并由南京金斯瑞生物科技有限公司进行测序。
1.2.2 重组质粒转化毕赤酵母GS115 将验证正确的重组质粒FSA-pPIC9K经限制性内切酶SalⅠ进行酶切,线性化质粒,并用乙醇沉淀法进行回收。取10 μL的线性化质粒与80 μL毕赤酵母感受态GS115混合均匀,转入提前冰浴的电转杯中,冰浴5 min,在1.5 kV、25 μF、200 Ω的电转条件下进行转化。电击结束后,迅速加入1 mL冰冷的山梨醇(1 mol/L),并转移到一个干净的无菌EP管内,28 ℃静置孵育2 h。将孵育完毕的菌体均匀涂布于MD平板上,于28 ℃培养约2~3 d后,观察平板上转化子的生长状况。将经MD平板筛选出的阳性菌落用无菌水洗下,分别涂布到不同浓度(1、2、3和5 mg/mL)梯度的G418-YPD平板上筛选高表达株,28 ℃培养3~5 d,挑取经过G418筛选出的单菌落于150 μL无菌水中稀释并作为菌落PCR模板,采用通用引物5′-AOX1:5′-GACTGGTTCC-AATTGACAAGC-3′和3′-AOX1:5′-GCAAATG-GCATTCTGACATCC-3′,同时用未经转化的毕赤酵母作为对照,进行菌落PCR。
1.2.3 重组质粒的诱导表达 将经验证有目的基因的菌落与1个转化pPIC9K空载体的菌落分别转接于YPD液体培养基中,在28 ℃、230 r/min培养24 h;将YPD培养物以1∶1 000转接于BMGY液体培养基,28 ℃、230 r/min培养18 h;更换BMMY液体培养基,继续在28 ℃、230 r/min条件下培养;每隔24 h加入0.5%体积分数的纯甲醇以实现诱导,诱导96 h后停止,取表达上清,通过Western blotting进行蛋白检测。
1.2.4 基本诱导条件的优化 具体方法同1.2.3,选取能成功表达FSA的菌株进行条件优化,将诱导温度分别调整为24、26、28和30 ℃,诱导培养基pH分别为4.0、5.0、6.0、7.0和8.0(每隔12 h调节一次pH),诱导甲醇添加量第1组每隔24 h加入0.5%的纯甲醇,其余4组分别每12 h添加0.5%、1.0%、1.5%和2.0%的纯甲醇以实现诱导,每组条件做3个平行试验。
1.2.5 Western blotting检测重组FSA蛋白的表达 收集表达上清液进行SDS-PAGE,通过半干转转膜仪将蛋白条带转移至PVDF膜上,并用5%脱脂奶粉封闭2 h,用Anti-Cat Albumin Antibody抗体4 ℃孵育过夜,之后用TBST溶液洗涤4次,每次10 min;用Donkey Anti-Goat IgG H&L抗体室温孵育1 h,用TBST溶液洗涤4次,每次10 min,显影查看结果。
2 结 果
2.1 重组质粒FSA-pPIC9K的鉴定
以提取的质粒FSA-pPIC9K作为模板,经特异性引物FSA-F和FSA-R进行PCR扩增,在约1 827 bp处有一明显的条带(图1),且与FSA基因大小相符。用限制性内切酶EcoRⅠ和NotⅠ对提取的质粒FSA-pPIC9K进行酶切验证,同时用空质粒pPIC9K作为对照,由图2可知,重组质粒FSA-pPIC9K在约1 827 bp处有一明显的条带,且与FSA基因大小相符,而空质粒pPIC9K在相应位置并无对应条带。测序结果表明,所克隆的FSA序列的碱基数为1 827 bp,编码608个氨基酸,与优化后的碱基序列进行比对未发现不同碱基,相似性高达100%。
2.2 G418筛选阳性菌株
由图3可知,随着G418浓度的增加,菌落数量不断地减少,当G418浓度为5 mg/mL时,菌落数量清晰可见(图3)。
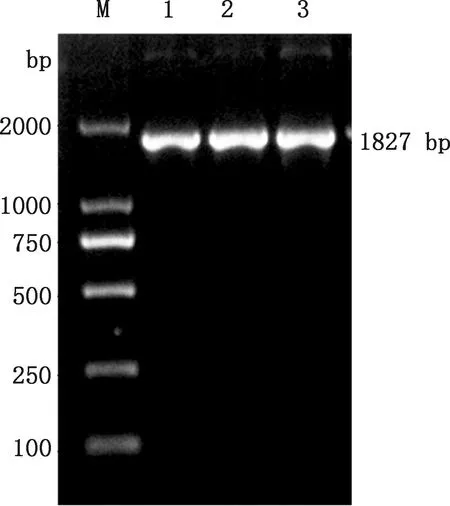
M,DL2000 DNA Marker;1~3,重组质粒FSA-pPIC9KM,DL2000 DNA Marker;1-3,Recombinant plasmid FSA-pPIC9K图1 重组质粒FSA-pPIC9K的PCR验证Fig.1 PCR verification of recombinant plasmid FSA-pPIC9K

M,DL10000 DNA Marker;1,空质粒pPIC9K;2,重组质粒FSA-pPIC9KM,DL10000 DNA Marker;1,Empty plasmid pPIC9K;2,Recombinant plasmid FSA-pPIC9K图2 重组质粒FSA-pPIC9K的酶切验证Fig.2 Enzyme digestion verification of recombinant plasmid FSA-pPIC9K

A~D,G418浓度分别为1、2、3和5 mg/mLA-D,G418 concentrations were 1,2,3 and 5 mg/mL,respectively图3 G418筛选高表达菌株Fig.3 Screening of highly expressed strains by G418
2.3 菌落PCR鉴定阳性菌株
菌落PCR产物经琼脂糖凝胶电泳检测,由图4可知,转化子菌落获得2条大小分别约为2.3和2.2 kb的目的基因条带和毕赤酵母AOX1基因扩增条带,对照组仅在2.2 kb左右有一明显的条带,表明重组质粒FSA-pPIC9K已整合到毕赤酵母的基因组中。

M,DL5000 DNA Marker;1~4,转化子菌落;5,毕赤酵母GS115菌落M,DL5000 DNA Marker;1-4,Transforming sub-colonies;5,Pichia pastoris GS115 colony图4 菌落PCR鉴定阳性菌株Fig.4 Identification of positive strains by colony PCR
2.4 重组FSA蛋白表达的检测
将表达上清进行Western blotting检测,同时以转化空质粒pPIC9K菌株的表达上清作为阴性对照,由图5可知,前4个样品在约70 ku处有明显的特异性条带,第5个样品由于表达量太低而条带不明显,阴性对照未出现特异性条带,表明FSA已经在毕赤酵母GS115中成功表达。

M,蛋白质分子质量标准;1~5,转化FSA-pPIC9K的表达上清;6,转化pPIC9K的表达上清M,Protein Marker;1-5,Expression supernatant transformed FSA-pPIC9K;6,Expression supernatant transformed pPIC9K图5 重组FSA蛋白的Western blotting检测Fig.5 Western blotting detection of recombinant FSA protein
2.5 不同条件下FSA表达的检测
将不同条件下的表达上清进行Western blotting检测,由图6可知,随着诱导表达的温度、pH增高及甲醇添加量的增多,FSA的表达量均呈现先增加后减少的趋势,即当温度为28 ℃、pH为6.0、每12 h添加0.5%纯甲醇的条件下,FSA的表达量较高。

M,蛋白质分子质量标准;A1、B1和C1,FSA阳性对照;A2~A5,依次为24、26、28和30 ℃;B2~B6,pH依次为4.0、5.0、6.0、7.0和8.0;C2~C6,依次为每隔24 h加入0.5%的纯甲醇、每12 h添加0.5%、1.0%、1.5%和2.0%的纯甲醇M,Protein Marker;A1,B1 and C1,FSA positive control,A2-A5,24,26,28 and 30 ℃,respectively;B2-B6,The pH was 4.0,5.0,6.0,7.0 and 8.0,respectively;C2-C6,0.5% pure methanol every 24 h,0.5%,1.0%,1.5% and 2.0% pure methanol every 12 h,respectively图6 不同温度(A)、pH(B)和甲醇添加量(C)条件下FSA表达的Western blotting检测Fig.6 Western blotting detection of FSA expression at different temperatures (A),pH (B) and methanol addition (C)
3 讨 论
FSA是由608个氨基酸组成的单链蛋白质,具有约17个二硫键和3个螺旋结构域(Ⅰ、Ⅱ和Ⅲ),每个域被分为2个子域A和B,其中亚结构域ⅡA和ⅢA被鉴定为药物结合位点,命名为Sudlow位点Ⅰ和Ⅱ[10]。如此复杂的蛋白结构在原核表达系统中易导致蛋白的错误折叠及产生无活性的包涵体[6,11]。因此,本研究采用毕赤酵母GS115作为FSA的表达宿主,毕赤酵母的蛋白质表达机制与哺乳动物细胞中的表达机制非常接近,同时又具有生长迅速,操作简便等优势,克服了哺乳动物细胞生长缓慢及培养成本高等问题[12]。毕赤酵母具有密码子偏爱性[13],A+T含量较高的区域可能含有转录提前终止信号,如共有序列ATTATTTTATAAA,易导致目的基因转录中断[14]。Yang等[15]经过毕赤酵母偏好的密码子优化过后,蛋白表达水平增加了约10倍。因此,依据毕赤酵母密码子偏好性,本研究将目的基因的密码子替换为毕赤酵母高频使用的密码子,并优化序列的GC含量,去除富AT区,将GC含量由最初的45.98%提高为48.11%,理论上可提高目的基因在毕赤酵母中的转录水平,以此提高蛋白的表达量。
有研究指出,由于外源蛋白的基因和G418抗性基因的串联整合,那些对高浓度G418有抗性的菌株会含有更高的拷贝数[16],而毕赤酵母可通过增加拷贝数来提高蛋白表达水平,这是由转录和翻译水平提高所致[17]。魏东升等[18]通过G418筛选高表达株将蛋白表达量提高了8.2倍,进一步验证了以上说法的正确性。本试验通过电击转化的方法成功将FSA表达载体转化到毕赤酵母GS115菌株中,并将其涂布到不同浓度梯度的G418平板中,最终获得了可以抗高浓度G418(5 mg/mL)的转化子,但这些转化子中目的基因的拷贝数需进一步试验研究,如本研究中的第5个样品经Western blotting验证时发现其特异性条带很不明显,可能是该转化子中目的基因的拷贝数少而导致表达量低。影响毕赤酵母表达蛋白的因素多种多样,毕赤酵母最佳的生长温度为28~30 ℃,但总体来说,低温环境更有利于蛋白折叠,且可降低蛋白酶的活性进一步提高蛋白产量[19],不同蛋白酶的最适pH不同,通过选择适当的诱导pH能有效降低蛋白酶活性[20],减少目的蛋白降解,同时pH对细胞活性也有较大的影响。在诱导表达过程中,甲醇既是诱导剂又可作为唯一的碳源被细胞利用,但高浓度的甲醇已造成累积,从而对细胞产生毒害作用[21],因此,本研究针对诱导表达的温度、pH及甲醇添加量进行研究,发现在28 ℃、pH为6.0且每12 h添加0.5%的甲醇条件下FSA表达量较高。
毕赤酵母表达的蛋白主要以糖基化形式存在,主要包括N-糖基化和O-糖基化,其中N-糖基化较多见,当蛋白质含有序列Asn-Xaa-Thr/Ser(Xaa表示任意氨基酸)时,毕赤酵母可对Asn残基上的酰胺氮进行N-糖基化修饰[22]。本研究将表达的上清液进行Western blotting验证,在70 ku左右发现特异性条带,比理论上分子质量66 ku的FSA偏大,这可能是在表达过程中FSA过度糖基化造成的,而过度的糖基化会影响蛋白的合成与分泌,因此需进一步研究去避免过度糖基化的发生。
4 结 论
本试验在毕赤酵母GS115中成功表达出FSA,在诱导表达温度为28 ℃,pH为6.0且每12 h添加0.5%的甲醇条件下FSA表达量较高。
——一道江苏高考题的奥秘解读和拓展

