不同酵母菌与植物乳杆菌复合发酵对新会柑酵素品质的影响
周映君,谢纯良,陈柏忠,龚文兵,朱作华,许 超,杨 琦,彭源德,
(1.中国农业科学院麻类研究所,湖南长沙 410205;2.广东新宝堂生物科技有限公司,广东江门 529000)
新会柑,又称陈皮柑,主产于江门市新会地区,为广东省十大道地药材之一中国地理标志产品。兼具药食两用的特色,具有理气健脾、和胃止呕、燥湿化痰等功效。近年来,广陈皮产业发展迅速,现有种植面积已超6667 hm2,果品年产量达230000 t[1-2]。不同于其他柑橘品种,新会柑的开发利用多局限于其果皮,而其柑肉由于味酸籽多,且去皮后不耐存放而被随意丢弃,不仅造成了极大的资源浪费,也对环境造成了污染[3]。调查研究证实,新会柑果肉亦含丰富的活性成分,如黄酮、多糖、酚类、氨基酸等[4],仍具有较高的利用价值。
酵素是一种功能性微生物产品,通常以水果为原料,经过一种或多种有益菌发酵而成,不仅保留了水果原有的矿物质和氨基酸等营养成分,还含有多种微生物次生代谢产物,具有抗氧化、抗菌消炎、增强机体免疫力、修复机体损伤等功效,受到广泛关注[5-6]。近年来我国学者开始重视酵素食品的研究与开发,并在从多个方面进行了广泛研究。研究结果表明,葡萄、苹果、蓝莓、枸杞、草莓酵素在发酵过程中抗氧化性能总体呈上升趋势,且抗氧化活性与酚类物质含量增加相关性较大[7-10]。红茶菌酵素对小鼠免疫功能有正向调节功能,可以显著提高IL-1和IL-2活性,增强巨噬细胞吞噬功能和NK细胞的杀伤活性[11]。天然酵素运动饮料对小鼠增强运动耐力和消除疲劳具有一定的积极作用[12]。天麻酵素可通过调节小鼠脑组织内神经递质及氧化应激水平来达到镇静催眠作用[13]。而发酵枸杞汁在缓解细胞氧化应激、调节炎症反应和脂质代谢方面也具有有益效果[14]。因此,将新会柑果肉开发利用,制备新会柑酵素,对丰富新会柑加工形式,实现其高值化利用具有重要意义。
目前,酵素的生产方式仍旧以传统发酵为主,但因发酵周期长,且易受环境微生物、发酵体系和气候条件因素所限制,影响了酵素产品的开发与利用。因此对于酵素的研究重点主要集中于接种发酵。酵素食品中微生物种类繁多,其优势微生物主要集中在酵母菌、乳酸菌、醋酸菌等,这些微生物之间协同作用,对产品风味和活性物质产生起到重要作用[15]。其中乳酸菌发酵可以产生易于人体吸收的氨基酸和乳酸等物质,有利于人体消化和促进肠道健康;酵母菌可以产生醇类物质,并与有机酸结合,促进并丰富酵素的风味体系。杨立启[16]探究了不同乳酸菌种发酵体系中柑橘全果汁的抗氧化活性和生物活性物质的变化规律,并证实植物乳杆菌是最佳的乳酸菌发酵菌种。在发酵过程中,适量酵母菌的存在可产生醇类物质,该类物质与有机酸结合可促进多种特征风味物质的形成。因此在酵素制备过程中常会使用乳酸菌和酵母菌复合发酵处理[17]。但在不同酵母菌在发酵对酵素品质的影响尚缺乏文献报道。实验室前期从藏灵菇中分离得到三株不同的生香酵母,本研究则比较了这三株酵母菌种与植物乳杆菌复合发酵对新会柑酵素有机酸、活性物质含量和抗氧化性能的影响,为新会柑的综合性开发提供理论基础和技术依据。
1 材料与方法
1.1 材料与仪器
新会柑 广东江门新宝堂生物科技有限公司提供;植物乳杆菌(Lactobacillus plantarum(Picp-2))、酿酒酵母(Saccharomyces cerevisiae(Sc))、单胞酿酒酵母(Kazachstania unispora(Ku))、马克斯克鲁维酵母(Kluyveromyces marxianus(Km)) 由本实验室提供;MRS肉汤培养基、酵母提取物、大豆蛋白胨、福林酚、没食子酸 北京索莱宝科技有限公司;ABTS 上海阿拉丁生化科技股份有限公司;DPPH梯希爱(上海)化成工业发展有限公司;过二硫酸钾、苯酚、葡萄糖 国药集团;总SOD测定试剂盒(WST-1) 南京建成生物工程研究所;植物γ-氨基丁酸(GABA)ELISA试剂盒 江苏晶美生物科技有限公司。
立式压力蒸汽灭菌器 重庆雅玛拓科技有限公司;洁净工作台 苏净集团限公司;高速冷冻离心机Eppendorf公司;全波长酶标分析仪 赛默飞世尔科技(中国)有限公司;恒温水浴锅 北京中兴仪器公司。
1.2 实验方法
1.2.1 菌种培养 酵母菌:将菌种接种于YPD固体培养基上,于30 ℃恒温培养36~48 h,挑取单菌落接种于YPD液体培养基中充分活化,连续传代3次,并以2%的比例接种至200 mL YPD液体培养基中,30 ℃扩大培养20 h,使菌种活菌数在 1.0×107CFU/mL以上。
乳酸菌:将菌种接种于MRS固体培养基上,于37 ℃恒温培养48 h,挑取单菌落接种于MRS肉汤培养基中充分活化,连续传代3次,并以2%的比例接种至200 mL MRS肉汤培养基中,37 ℃扩大培养18 h,使菌种充分活化至活菌数在1.0×109CFU/mL以上。
1.2.2 新会柑酵素的制备 新会柑→去皮→打浆→加糖→装瓶→杀菌→接种消毒封口→发酵→过滤→酵素
操作要点:将去皮后的新会柑果浆进行破碎打浆处理,加入5%(w/v)赤糖,以200 mL/瓶的规格分装在灭菌后的发酵瓶中,80 ℃巴氏杀菌处理20 min,接种果浆体积5%乳酸菌后,消毒封口,并置于35 ℃培养箱中恒温静置发酵48 h。随后,分别以果浆体积的1%接种三种不同酵母菌种,于30 ℃培养箱中恒温静置发酵96 h,发酵过程中,每隔24 h取样一次。将所去新会柑酵素样品离心(9000 r/min,10 min,10 ℃),除去肉眼可见残渣,即得新会柑酵素原液,并进行相关指标检测。
1.2.3 检测方法
1.2.3.1 酵母活菌数检测 分别于酵母菌接种的第0、1、2、3、4 d进行取样,3000 r/min离心 5 min去除大量残渣,梯度稀释,取100 μL上清液涂布于含有100 mg/mL氨苄的YPD固体平板上。30 ℃避光培养48 h后,平板计数法统计其活菌数。
1.2.3.2 总糖含量的检测 参照GB/T 5009.7-2016中方法,采用菲林试剂直接滴定法分析不同酵母发酵过程中总糖含量的变化规律。
1.2.3.3 总酸含量和pH的测定 总酸含量的测定:参照GB/T 12456-2008中方法,采用酸碱滴定法检测不同酵母发酵过程中新会柑酵素的总酸含量。 根据滴定样品稀释液消耗的NaOH溶液量,计算样品中的总酸含量(乳酸当量)。
利用酸度计直接测定新会柑酵素发酵液的pH。
1.2.3.4 生物活性物质检测 粗多糖含量的检测:参照SN/T 4260-2015测定酵素中的粗多糖的总含量。
总黄酮含量检测:参照GB/T 12143-2008附录G中方法测定酵素中总黄酮的含量。
总多酚含量检测:参照GB/T 31740.2-2015附录A中方法测定酵素中总多酚的含量
GABA含量检测:采用植物γ-氨基丁酸(GABA)ELISA试剂盒进行测定。
1.2.3.5 特征性有机酸含量的测定 参GB 5009.157-2016《食品中有机酸的测定》的方法,采用HPLC法检测不同酵母发酵所产酵素中有机酸含量。
待测样品的预处理:取新会柑酵素样品,用无菌水稀释至一定的倍数,将稀释液通过孔径0.22 μm的滤膜,透过液备用。
1.2.3.6 抗氧化能力测定 DPPH自由基清除能力的测定:配制并吸取浓度为 0、2、4、6、8、10 μg/mL的VC标准液1 mL,加入1 mL DPPH的乙醇溶液(0.2 mmol/L),混合后静放 30 min(常温避光),在517 nm波长下测定相应的吸光度。以标准液浓度为横坐标,吸光度值为纵坐标绘制标准曲线。将不同处理酵素样品稀释后,分别吸取1 mL,加入1 mL DPPH的乙醇溶液(0.2 mmol/L),混合后静放30 min(常温避光),517 nm测吸光值。每个样品测3次平行。DPPH自由基清除能力以每毫升VC含量等价物来表述,通过VC标曲回归方程计算。
超氧阴离子自由基清除能力测定:在10 mL试管中加入 5.7 mL Tris-HCl缓冲液(50 mmol/L,pH8.2),加入0.2 mL样品进行混合之后放置在25 ℃保温箱中,10 min 后取出,再加 0.1 mL(10 mmol/L)邻苯三酚溶液(已预热),快速混匀后用多功能酶标仪测定320 nm波长1 min内吸光值的增加值(Aj),线性范围内算出每1 min吸光度的增加值,另取如上试剂,用等体积水替代样品,测定在320 nm波长下,1 min内吸光度的增加值(Ai)。

羟基自由基(·OH)清除能力测定:羟基自由基(·OH)清除测试方法参照文献[18]反应方法,在试管中依次加入硫酸亚铁溶液(6 mmol/L)、过氧化氢溶液(6 mmol/L)、样品各2 mL后静放置10 min,之后再加入2 mL水杨酸溶液(6 mmol/L),静放 30 min后在510 nm处测定吸光度A0,用蒸馏水代替样品溶液同样处理,测定吸光值Ax。
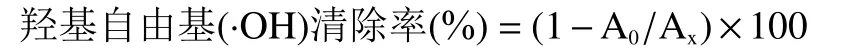
ABTS+自由基清除力的测定:0.2 mL 7.4 mmoL/L ABTS 与 0.2 mL 2.6 mmoL/L K2S2O8混合,在室温条件黑暗处反应12 h,反应完成后用95%乙醇(pH7.4磷酸盐缓冲液,95%乙醇或甲醇)稀释40~50倍,使得混合液在734 nm光度下吸收值处于0.68~0.72(工作液)。
配制并吸取浓度为 0、4、8、12、16、20 μg/mL的VC标准液0.2 mL于2 mL离心管中,加入0.8 mL稀释后的工作液,混合均匀后静置反应6~8 min,迅速测定734 nm波长处的吸光值。对以标准液浓度为横坐标,吸光度值为纵坐标绘制标准曲线。将不同处理酵素样品稀释后,分别吸取0.2 mL,加入0.8 mL稀释后的工作液,混合均匀后静置反应6~8 min,迅速测定734 nm波长处的吸光值。每个样品测3次平行。ABTS清除能力以每毫升VC含量等价物来表述,通过VC标曲回归方程计算。
总还原力的测定:参考文献[19]的方法略作修改[19],准确移取不同的样品溶液1.0 mL,随即快速加入2.5 mL的PBS缓冲溶液(0.2 mol/L,pH 6.6)和2.5 mL 1%的铁氰化钾溶液。将混合溶液置于恒温水浴中50 ℃孵育20 min,取出后加入2.5 mL 10% TCA,反应溶液产生浑浊,将反应溶液室温下以3500 r/min离心12 min,吸取上清液2.5 mL,加入蒸馏水2.5 mL后,再加入0.5 mL的三氯化铁溶液(0.1%),摇匀后静置10 min。使用多功能酶标仪在700 nm下测得反应物的吸光值,空白以蒸馏水代替样品液,吸光值和还原能力成正比。
SOD的测定:SOD活性利用WST-1法使用南京建成检测试剂盒进行酵素总SOD活力测定。
1.3 数据处理
采用SPSS19.0对本文数据进行处理和分析,每组重复3次,实验数据表示为平均值±标准偏差。
2 结果与分析
2.1 新会柑酵素发酵过程中酵母菌落数变化
通过不同发酵时间酵母菌落数可以直观了解不同种类酵母在新会柑发酵液中的生长情况。在发酵过程中酵母菌利用发酵液中的营养物质进行生长代谢,由图1可知酿酒酵母、单胞酿酒酵母、马克斯克鲁维酵母在乳酸菌发酵2 d后的新会柑发酵液中均可以正常生长,菌落数随着发酵时间的延长逐渐增加。发酵前期酵母菌生长快速但菌浓度差异不显著,随着发酵液中物质不断消耗,有机酸含量增加,酵母菌生长速度放缓,并出现显著差异。如图1所示,发酵后期单胞酿酒酵母活菌数仅为5.54×106CFU/mL,明显低于酿酒酵母(8.57×106CFU/mL)和马克斯克鲁维酵母(7.93×106CFU/mL)。由此可见,单胞酿酒酵母的耐酸性较弱,在新会柑酵素中的增殖能力相对较低。
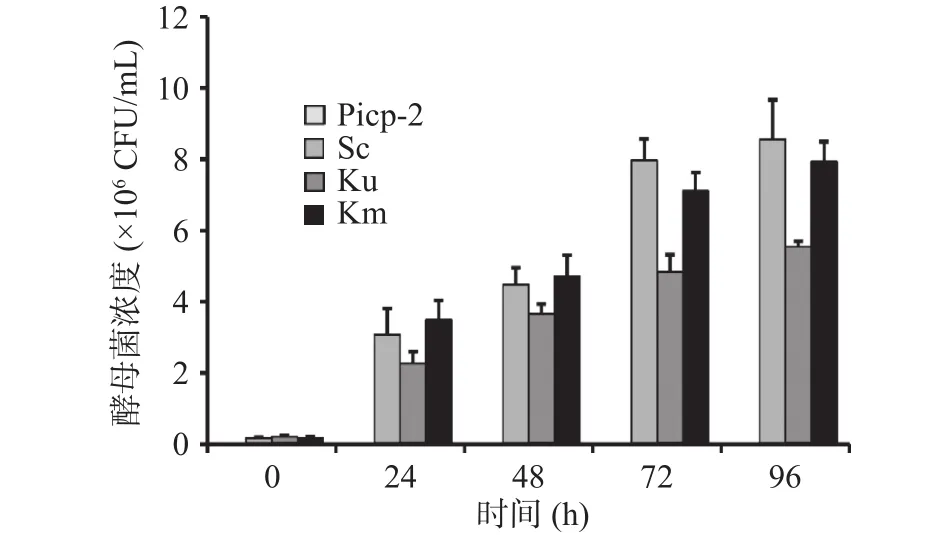
图1 新会柑酵素复合发酵过程中酵母生长动态Fig.1 Dynamics of yeast growth during the combined fermentation of Xinhui citrus ferment
2.2 不同酵母菌种发酵对新会柑酵素总糖、pH和总酸含量的影响
糖类物质作为微生物发酵过程中的主要碳源,通过总糖含量变化分析微生物生长和代谢状况。由图2可知,在酵母菌发酵的前72 h,总糖浓度呈显著(P<0.05)下降的趋势,说明此阶段微生物的生长比较旺盛,糖类物质主要用于其增殖和合成代谢。此后,随着发酵液酸度的增加、菌种老化和发酵环境变差等原因,菌落总数趋于平缓,对糖的需求量降低,因此在发酵后期酿酒酵母、单胞酿酒酵母、马克斯克鲁维酵母发酵液中的总糖含量分别降至0.83±0.02、0.81±0.01、0.81±0.01 g/100 g,并趋于稳定。该结果表明在酵母接种发酵3 d后,基本可达到完全发酵。同时,四种处理条件下新会柑发酵液中总糖下降趋势基本一致,可见乳酸菌为新会柑酵素制备过程中的主要优势发酵菌。
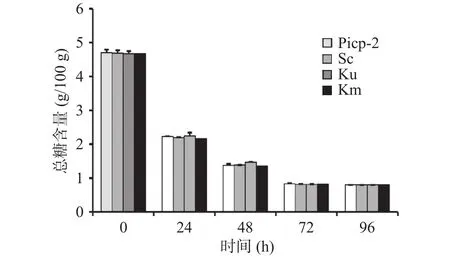
图2 新会柑酵素复合发酵过程中总糖含量变化Fig.2 Changes of total sugar content in Xinhui citrus combined fermentation
pH可以反映发酵过程的异常情况,总酸同样表明发酵过程中微生物的代谢变化情况。乳酸菌发酵的主要代谢产物为乳酸,本文以乳酸为对照,得到新会柑酵素酵母发酵各时间点的总酸含量变化趋势。由图3可知,新会柑发酵初期,乳酸菌快速定殖并进行生长代谢,产生大量次生代谢产物(如乳酸和乙酸等有机酸),使得pH从初始的3.96迅速下降至3.32。而在接入酵母菌后,其pH不再呈现下降趋势,并维持相对稳定,且不同酵母菌种接种发酵的新会柑发酵液pH无明显差异。但其总酸含量却随着发酵时间的延长不断增加,其中酿酒酵母接种后总酸含量从初始的15.99±0.23 g/kg增加至19.65±0.69 g/kg,马克斯克鲁维酵母接种后总酸含量从初始的15.96±0.27 g/kg增加至19.92±0.29 g/kg,单胞酿酒酵母接种后总酸含量则从初始的15.98±0.07 g/kg增加至19.26±0.24 g/kg,低于前两种酵母处理发酵液(图4)。该结果与酵母菌活菌数增长趋势相一致,表明在新会柑的发酵过程中总酸含量的差异性与酵母菌的生长代谢能力有一定的相关性。

图3 新会柑酵素复合发酵过程中pH变化Fig.3 Changes of pH in Xinhui citrus combined fermentation
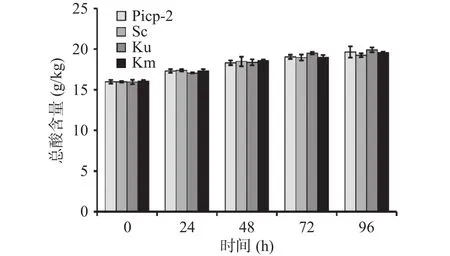
图4 新会柑酵素复合发酵过程中总酸含量变化Fig.4 Changes of total acid in Xinhui citrus combined fermentation
2.3 不同酵母菌种发酵对特征有机酸含量的影响
有机酸是新会柑中重要的营养成分,对风味和口感的形成具有重要意义。本文主要以酒石酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸为研究对象,通过HPLC对不同酵母菌种发酵体系中新会柑酵素的有机酸含量进行了比较分析。由图5可知,与发酵前相比,发酵后新会柑酵素乳酸和乙酸是变化最明显的两种有机酸。其中植物乳杆菌与酿酒酵母、单胞酿酒酵母、马克斯克鲁维酵母复合发酵处理的新会柑酵素乳酸含量分别为新会柑原浆的4.32倍、4.23倍和4.36倍。乙酸含量在新会柑原浆中含量极低,但发酵后则分别增加至 1.57±0.21、1.65±0.35、1.67±0.16 g/kg。但不同发酵处理条件下乳酸和乙酸含量差异不显著。柠檬酸是柑橘果实有机酸的主要成分,占总有机含量的70%~90%。本研究中发现单胞酿酒酵母、马克斯克鲁维酵母发酵的新会柑酵素中,柠檬酸含量分别降低10.61%和14.25%,而酿酒酵母复合发酵与植物乳杆菌单独发酵新会柑酵素中柠檬酸含量与发酵前差异不显著。该结果证实单胞酿酒酵母和马克斯克鲁维酵母具有一定的降解柠檬酸能力。此外,研究结果也证实,酒石酸、苹果酸在新会柑发酵后略有增加,而琥珀酸发酵后略有降低,但其在统计学上无显著差异。
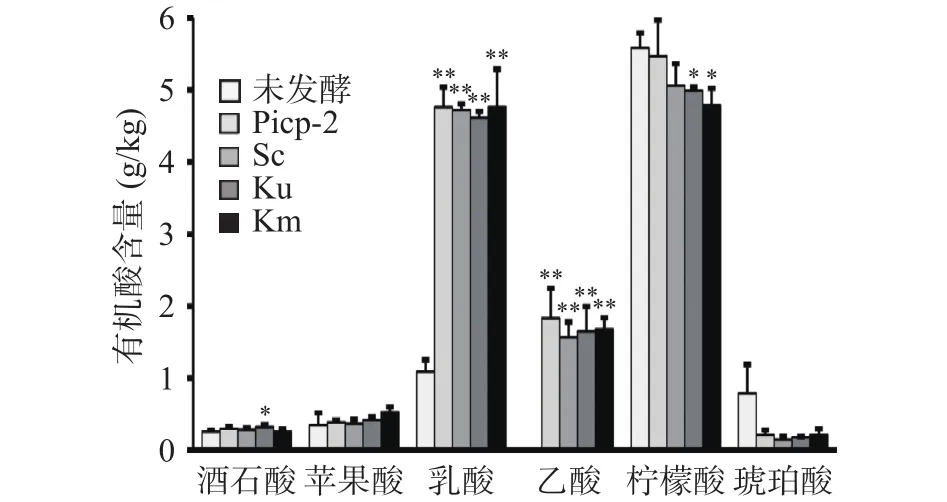
图5 不同发酵体系中新会柑酵素特征有机酸含量比较分析Fig.5 Comparative analysis of organic acid content in different fermentation systems of Xinhui citrus ferment
2.4 不同酵母菌种发酵对新会柑酵素活性物质含量的影响
柑橘全果汁中存在着大量的酚酸、类黄酮、粗多糖、γ-氨基丁酸等活性物质[20],因此本研究对不同酵母发酵新会柑酵素中活性物质含量进行了检测,结果如图6(A)所示。与发酵前相比,发酵后的新会柑酵素中粗多糖含量极显著下降(P<0.01),可能是由于乳酸菌在代谢过程中将粗多糖分解利用或者转化所致,但菌种间的代谢会相互影响。本研究中发现酿酒酵母、单胞酿酒酵母复合发酵体系的粗多糖代谢能力相当,发酵完成后粗多糖含量分别为3.12和3.54 g/kg。而马克斯克鲁维酵母却可以抑制植物乳杆菌对多糖的代谢,该体系发酵后粗多糖可达4.37 g/kg,显著高于酿酒酵母菌、单胞酿酒酵母发酵的粗多糖含量(P<0.05),可能由于马克斯克鲁维酵母具有一定的产多糖能力所致。
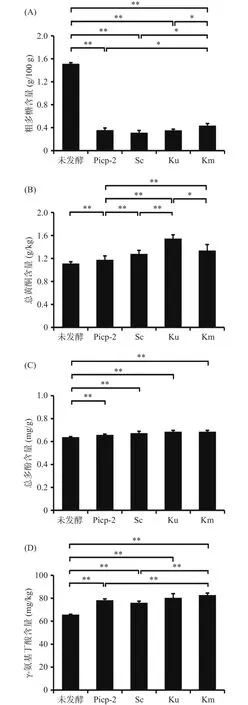
图6 不同发酵体系中新会柑酵素活性物质含量比较Fig.6 Comparison of bioactive substance content in different fermentation systems of Xinhui citrus ferment
由图6(B)可知,发酵后新会柑酵素中总黄酮含量显著增加(P<0.05),其中乳酸菌单独发酵总黄酮含量可提高5.8%,而酿酒酵母、单胞酿酒酵母、马克斯克鲁维酵母复合体系发酵后总黄酮含量分别可提高15.14%、38.73%、20.36%。其主要是由于发酵微生物分泌的糖苷酶将不溶性膳食纤维结合的黄酮释放形成水溶性黄酮所致。由此可见,添加酵母可以显著提高水溶性黄酮的含量(P<0.05),且单胞酿酒酵母复合发酵体系分泌的糖苷酶更有利于新会柑黄酮的释放。
发酵过程中果蔬某些成分经微生物转化和化合物解聚会导致总酚含量的增加[21]。从图6(C)可以发现,四种新会柑发酵液总酚含量均显著高于未发酵新会柑果汁(P<0.05),且不同酵母菌种发酵处理间无显著差异。
γ-氨基丁酸是柑橘中一类重要的非蛋白质氨基酸,具有调整血压、镇静神经、减少中性脂肪、治疗癫痫、增强动物采食能力等生物活性[22]。对不同酵母发酵新会柑酵素中γ-氨基丁酸含量进行比较分析后发现,经发酵处理后发酵液中γ-氨基丁酸含量显著增加(P<0.05)。其中植物乳杆菌与马克斯克鲁维酵母复合发酵新会柑酵素中γ-氨基丁酸含量最高,可达82.85 mg/kg,显著高于植物乳杆菌单独发酵及其与酿酒酵母复合发酵体系所制备的新会柑酵素(P<0.05)。由此可见,该发酵体系更有利于酵素溶液中γ-氨基丁酸的富集。
2.5 不同酵母菌种发酵新会柑酵素抗氧化指标评价
本研究以SOD活力、DPPH自由基、ABTS+自由基、羟基自由基、超氧阴离子自由基清除能力和总还原力来表征不同酵母菌种复合发酵体系对新会柑酵素体外抗氧化能力的影响[7]。SOD是所有生物在有氧条件下对抗氧化应激损伤的第一道防线[23],可以清除体内产生的过量超氧阴离子自由基,延缓衰老,提高机体免疫力。由图7可知,无论是单菌还是混菌发酵后新会柑发酵液中SOD活力均有所提高,分别可达 149.08、155.03、165.33、161.62 U/mL,显著高于发酵前(124.69 U/mL)(P<0.05)。此外,不同处理间进行比较后可发现单胞酿酒酵母复合发酵体系和马克思克鲁维酵母复合发酵体系制备新会柑酵素SOD活力显著高于植物乳杆菌单菌发酵体系(P<0.05)。而酿酒酵母复合发酵体系中SOD活力也有一定提高,但在统计学上无显著差异,该现象可能与不同复合菌发酵体系中SOD酶种类与活性不同有一定的相关性。
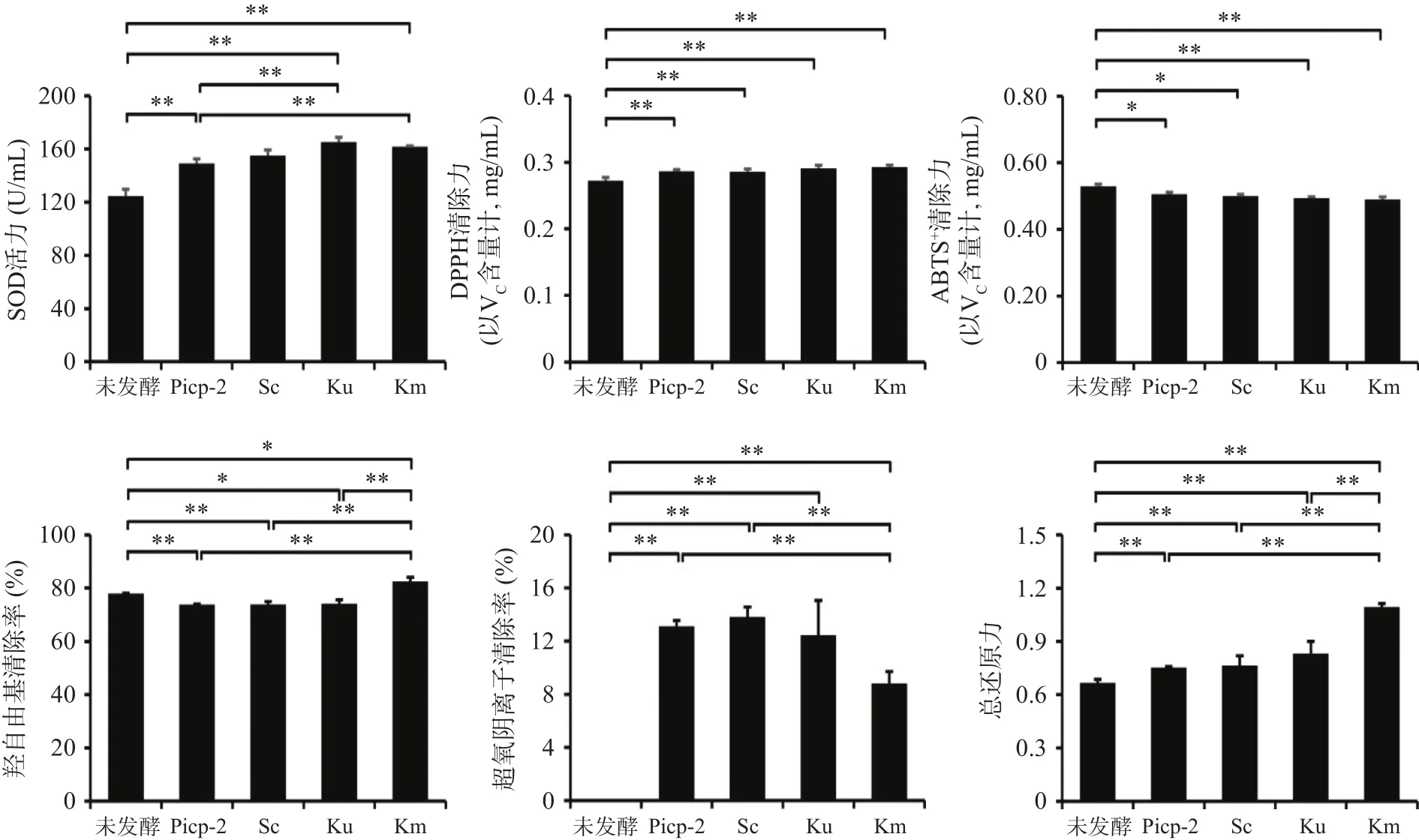
图7 不同发酵体系中新会柑酵素抗氧化性能比较Fig.7 Comparison of antioxidant activity of enzyme in different fermentation systems of Xinhui citrus ferment
发酵后新会柑酵素对DPPH自由基的清除能力均有所提高,以VC含量计算,与未发酵新会柑相比,植物乳杆菌单菌发酵与添加酿酒酵母、单胞酿酒酵母、马克斯克鲁维酵母复合发酵后分别可提高5.12%、4.84%、6.61%、7.42%,有极显著性差异(P<0.01)。此外,不同酵母发酵方式处理后,新会柑发酵液DPPH的增长趋势与发酵液中的总酚含量变化趋势相似,可见清除DPPH自由基的能力与酚酸类化合物之间有一定的相关性。该结果与草莓酵素的相关研究结果具有一致性[10]。
除DPPH自由基外,ABTS+自由基同样可用于评估体外抗氧化活性,在生物制品抗氧化活性的判定中具有较好的应用[9]。对不同发酵体系新会柑酵素的ABTS+自由基清除能力进行了测定,并以VC含量计,结果表明深度发酵后,新会柑酵素仍可维持较高的ABTS+自由基清除能力,但与未发酵前相比仍呈现明显的下降趋势。其中马克斯克鲁维酵母发酵体系下降最为显著(P<0.05),可达7.61%;单胞酿酒酵母发酵体系次之,为6.71%;而酿酒酵母发酵体系下降最小,仅为5.69%。杨立启[16]研究了不同乳酸菌发酵对柑橘全果汁抗氧化活性的影响后发现,乳酸菌发酵会导致柑橘果汁ABTS+自由基清除能力显著下降,与本研究结果基本一致。多糖具有良好的抗氧化功能,但发酵后新会柑粗多糖含量显著降低(P<0.05),这可能是新会柑酵素是 ABTS+自由基清除力下降的原因之一。
羟基自由基是人体内常见的自由基之一,可以破坏红细胞,对DNA、细胞膜等结构造成危害[24]。随着发酵的深入,不同发酵体系下新会柑酵素的羟自由基清除能力也发生了较为显著的变化(P<0.05)。其中马克斯克鲁维酵母发酵体系中新会柑酵素羟基自由基清除率显著升高至82.48%(P<0.05),而酿酒酵母发酵体系和单胞酿酒酵母发酵体系中新会柑酵素羟基自由基清除率则分别下降至73.91%和74.15%(P<0.05)。由此可见,新会柑酵素羟自由基清除能力的变化因发酵菌种体系而异。
超氧阴离子自由基是一种活性氧自由基,能引发体内脂质过氧化,过量产生可加速机体衰老速度。由图7可知,未发酵的新会柑果汁超氧阴离子自由基清除率极低,但经不同发酵体系处理后其清除力均有极显著提高(P<0.01),其中酿酒酵母复合发酵体系清除力最高,可至13.82%,而植物乳杆菌单菌发酵体系则为13.09%,均极显著高于马克斯克鲁维酵母发酵体系的 8.81%(P<0.01)。
还原力亦为评估体外抗氧化活性的另一重要方法。在一定范围内,还原力越大,抗氧化活性越好。相较而言,还原力是一个更综合性抗氧化评价指标,与多种抗氧化机制有关,包括过多金属离子型的催化剂、结合自由基的清除、过氧化物的分解反应等,可以综合反映样品的体外抗氧化水平[25]。对不同发酵体系的总还原力进行了测定,结果表明发酵后新会柑酵素的总还原力显著增强(P<0.05),依据总还原力大小依次为:植物乳杆菌单菌发酵体系<酿酒酵母复合发酵体系<单孢酿酒酵母复合发酵体系<马克斯克鲁维酵母复合发酵体系,其吸光度分别为0.738、0.765、0.831、1.094。由此可见马克斯克鲁维酵母体系发酵新会柑酵素体外抗氧化综合指标最高。
3 结论
本文主要探究了不同酵母菌与植物乳杆菌复合发酵对新会柑酵素品质的影响。研究发现在不同新会柑发酵体系中,pH、总糖、总酸含量和有机酸组成差异不显著;但其生物活性物质含量和抗氧化水平却有较大差异。结果表明发酵7 d后,新会柑酵素中总黄酮、总酚和γ-氨基丁酸的含量均有显著提高(P<0.05)。其中在马克斯克鲁维酵母与植物乳杆菌复合发酵体系中粗多糖和γ-氨基丁酸在含量均显著高于其它三种发酵体系(P<0.05),而其总黄酮含量也高达1.336 g/kg,仅次于单胞酿酒酵母与植物乳杆菌复合发酵体系。在抗氧化功效方面,发酵后新会柑酵素的SOD活力、DPPH自由基清除力、超氧阴离子自由基清除力和总还原力均有显著提高(P<0.05)。通过不同发酵体系中发酵液抗氧化水平比较分析,证实马克斯克鲁维酵母与植物乳杆菌复合发酵体系中羟自由基清除力和总还原力均显著强于其它发酵体系(P<0.05)。由此可见,马克斯克鲁维酵母发酵体系制备的新会柑酵素在活性物质含量和抗氧化功效方面均强于酿酒酵母和单胞酿酒酵母体系。不同乳酸菌和酵母在发酵过程中可以形成不同的微生态环境,菌种间的相互作用控制着产品的风味特点、生物活性成分和保健特性。因此,对新会柑酵素中乳酸菌与酵母菌的协同生长代谢机理仍有待进一步分析。本研究可为高品质新会柑酵素产品的研发提供一定的数据参考,为新会柑柑肉的高值化开发利用提供理论基础,并有利于当地陈皮产业的发展。

