响应面法优化三叶青总黄酮提取工艺及不同产地三叶青的质量评价
徐志杰,黄子洳,马方芳,张善华,程汝滨,黄 真,钟晓明,
(1.浙江中医药大学,浙江杭州 310053;2.遂昌县农业农村局,浙江丽水 323300)
三叶青(Tetrastigma hemsleyanumDiels et Gilg)学名三叶崖爬藤,为葡萄科崖爬藤属植物,又名蛇附子、石抱子、金线吊葫芦,是我国特有濒危珍稀药用植物,主产于我国浙江、江西、福建和广西等地[1]。三叶青以块根入药为主,味微苦、性平,具有清热解毒、消肿止痛、化痰散结等功效[2]。三叶青除药用外,也常作为药膳食材,目前市面已有三叶青茶类产品,开水冲泡即可饮用,是西药无法替代的“植物抗生素”[3]。
三叶青的品种因地区不同而存在一定的区别,福建、湖南、云南、广东、广西等地的三叶青为青藤三叶青,浙江、江西一带的三叶青则为紫藤三叶青[4-5]。青藤三叶青分布地域较广,适应能力强,产量较高;而紫藤三叶青产量不高,且生长年限长,但其药用功效更佳[6]。由于受地理因素及气候环境等影响,不同产地的三叶青化学成分的含量和组成表现出明显的差异性。不同产地的三叶青质量参差不齐,缺乏科学有效的质量评价方法,不利于三叶青产业的规模扩大和后续健康产品的开发。
黄酮类成分作为三叶青的主要药效成分和质控指标[7-8],在抗癌[9]、抗氧化[10]、提升免疫力[11]、抗病毒[12]、神经保护[13]和抗炎[14]等方面均显示出广泛的生理活性。然而三叶青总黄酮提取工艺落后,提取得率较低[15],不利于三叶青黄酮的大规模开发应用。同时,虽然目前已有不少关于三叶青指纹图谱的研究,如李士敏等[16]、张晓芹等[17]、金晓怀[18]均对三叶青HPLC指纹图谱有一定的研究,但所采集的三叶青样品产地较为局限,难以反映和区分全国各产地三叶青的整体质量。故本研究收集了全国9个不同产地的18批三叶青样品,采用Box-Behnken法优化三叶青中总黄酮的提取工艺,测定不同产地三叶青的总黄酮得率,并建立不同产地三叶青HPLC指纹图谱,结合相似度分析、聚类分析和主成分分析来评价不同产地三叶青的质量,以期为规范三叶青销售市场以及三叶青资源的开发利用提供参考。
1 材料与方法
1.1 材料与仪器
三叶青干燥块根 样品来源信息详见表1,各产地均采集2批样品,共9个产地18批三叶青样品,其中广西南宁、云南楚雄产三叶青为原产地采集,其他产地三叶青样品分别购于全国各地的药材市场,三叶青样品经浙江中医药大学药学院中药资源研究所陈孔荣副教授鉴定为葡萄科崖爬藤属植物三叶青Tetrastigma hemsleyanumDiels et Gilg的干燥块根;芦丁、槲皮素、山柰酚 批号分别为T27F10Z81699、C01J10Y91727、G11A11L110978,纯度均>98%,上海源叶生物科技有限公司;乙腈 色谱纯,美国Tedia公司;乙醇、磷酸、甲醇、氢氧化钠、亚硝酸钠分析纯,国药集团化学试剂有限公司;硝酸铝 分析纯,上海麦克林生化科技有限公司;超纯水 Milli-Q超纯水系统制备。

表1 各产地三叶青信息Table 1 Information of Tetrastigma hemsleyanum Diels et Gilg
DZF数显鼓风干燥箱 上海博讯实业有限公司;AL104电子天平 上海梅特勒-托利多仪器有限公司;RE-52AA旋转蒸发仪 上海荣亚生化仪器厂;恒温水浴锅 上海宜昌仪器厂;紫外分光光度计日本岛津公司;Waters高效液相色谱仪 美国Waters公司。
1.2 实验方法
1.2.1 三叶青总黄酮的提取工艺优化
1.2.1.1 三叶青总黄酮的提取 选取道地产地浙江台州的三叶青为供试品,将其粉碎后过50目筛,真空干燥至恒重,得到样品粉末。精密称取粉末1.0 g,在一定提取时间、提取温度、液料比、乙醇浓度下于恒温水浴锅中进行冷凝回流提取,将滤液抽滤,转移至50 mL量瓶中定容,备用。
1.2.1.2 芦丁标准曲线的绘制 参考文献[15,19]并加以修改,精密称取芦丁对照品10.0 mg,用60%乙醇定容至 10 mL,摇匀,即得1 mg·mL-1对照品溶液。精密吸取 0.2、0.4、0.6、0.8、1.0 mL的芦丁1.0 mg·mL-1对照品储备液于25 mL容量瓶中,加入1 mL 5%亚硝酸钠溶液,摇匀,静置6 min。再加入1 mL 10%硝酸铝溶液,摇匀,静置6 min。最后加入10 mL 4%氢氧化钠溶液,加水定容至25 mL,摇匀,静置15 min。以加纯水的试剂作为空白,测定样品在510 nm处的吸光度A,以芦丁质量浓度X为横坐标,吸光度A为纵坐标进行回归,得到回归方程:A=0.4705X-0.0035(R2=0.9999)。
1.2.1.3 三叶青总黄酮的测定 准确吸取三叶青样品溶液2.0 mL于25 mL容量瓶中,按照“1.2.1.2”中所述方法进行操作并计算三叶青总黄酮得率[20],计算公式如下:

式中,Y 为三叶青总黄酮得率(mg·g-1);C 为总黄酮的质量浓度(mg·mL-1);V为测量总黄酮提取液体积(mL);N为稀释倍数;M为称量的三叶青样品质量(mg)。
1.2.1.4 单因素实验 以三叶青总黄酮得率为指标,固定提取时间90 min、提取温度 70 ℃、料液比1:30 g·mL-1、乙醇浓度70%时,分别考察不同提取时间(30、60、90、120、150 min)、提取温度(50、60、70、80、90 ℃)、料液比(1:10、1:20、1:30、1:40、1:50 g·mL-1)、乙醇浓度(50%、60%、70%、80%、90%)对三叶青总黄酮得率的影响,各实验均平行重复3次。
1.2.1.5 Box-Behnken 响应面法优化提取工艺 根据单因素实验结果,以提取时间(A)、提取温度(B)、料液比(C)、乙醇浓度(D)作为影响因素,总黄酮得率为评价指标(Y),应用 Box-Behnken 中心组合进行4因素3水平的实验设计,因素水平如表2所示。

表2 响应面实验因素水平设计Table 2 Factors and levels used in response surface analysis
1.2.2 三叶青指纹图谱的建立
1.2.2.1 混合对照品溶液制备 取芦丁、槲皮素、山柰酚对照品,加甲醇制成每1 mL含芦丁10.1 μg、槲皮素9.7 μg、山柰酚8.8 μg的混合对照品溶液,备用。
1.2.2.2 供试品溶液制备 精密称取各产地三叶青粉末1.0 g,以最佳提取工艺进行提取,抽滤1次,滤液转移至50 mL量瓶中,定容至刻度。后置于蒸发皿中,蒸干,残渣加甲醇超声至溶解,转移至5 mL容量瓶中,定容至刻度,用0.22 μm微孔滤膜滤过,得到供试品溶液,备用。
1.2.2.3 色谱条件 色谱柱为Waters Sunfire C18柱(4.6 mm×250 mm,5 μm),流动相为 0.2% 磷酸水-乙腈,梯度洗脱(0~30 min,15%~20% 乙腈;30~35 min,20%~33% 乙腈;35~50 min,33% 乙腈;50~60 min,33%~60%乙腈);流速为 1.0 mL/min;检测波长为360 nm;柱温为 40 ℃;进样量为 10 μL。
1.2.3 指纹图谱方法学考察
1.2.3.1 精密度实验 取S1样品,按“1.2.2.2”项下方法制备供试品溶液,在“1.2.2.3”项条件下连续进样6次[21],以槲皮素峰为参考峰,计算得出各共有峰相对保留时间和相对峰面积的RSD值。
1.2.3.2 稳定性实验 取S1样品,按“1.2.2.2”项下方法制备供试品溶液,在“1.2.2.3”项条件下,分别在0、2、4、8、12、24 h 进样测定[21],计算得出各共有峰相对保留时间和相对峰面积的RSD值。
1.2.3.3 重复性实验 取6份S1样品,按“1.2.2.2”项下方法分别制备供试品溶液,在“1.2.2.3”项条件下进样测定[21],计算得出各共有峰相对保留时间和相对峰面积的RSD值。
1.2.4 指纹图谱分析
1.2.4.1 相似度评价 将18批各产地三叶青液相色谱图数据导入“中药色谱指纹图谱相似度评价系统(2012版)”进行分析,以S1样品色谱图为参照图谱,采用中位数法生成对照图谱,时间窗宽度设置为0.1 min,进行多点校正和自动峰匹配,生成指纹叠加图谱,确定共有峰。以对照图谱为参照,进行相似度评价。
1.2.4.2 聚类分析 采用SPSS20.0软件以18批三叶青样品的共有峰面积为变量,采用组间连接聚类方法,以平方Euclidean距离为度量标准进行系统聚类分析。
1.2.4.3 主成分分析 采用SPSS20.0软件对18批三叶青样品的指纹图谱数据进行主成分分析,采用降维、因子分析,计算相关系数矩阵,主成分特征值、累积贡献率及主成分综合得分等。
2 结果与分析
2.1 三叶青总黄酮的提取工艺优化研究
2.1.1 单因素实验 提取时间、温度、料液比、乙醇浓度各单因素对三叶青总黄酮得率影响如图1所示。由图1A可知,三叶青总黄酮得率随着时间的增加先升后下降,并在提取时间60 min时得率达到最大值。提取时间较短时,黄酮类成分尚未完全溶出,而提取时间过长时,可能会使三叶青黄酮中热不稳定成分在长时间提取中遭到破坏降解,使得总黄酮得率下降[22]。由图1B可知,总黄酮得率随着温度的升高先上升再下降,在80 ℃时得率达到最大值。当温度升高,分子运动加剧,黄酮类物质溶出增加,故总黄酮得率上升。而当温度过高时,可能导致黄酮类化合物氧化变性,使得总黄酮得率下降[23]。由图1C可知,当料液比从 1:10 g·mL-1增加到 1:30 g·mL-1的过程中,总黄酮得率增加,并在料液比1:30 g·mL-1时得率达到最大值;但当继续提高料液比时,得率下降,可能是高料液比时溶出的黄酮类物质被稀释,伴随着非黄酮类杂质增多,使得黄酮得率下降[24]。由图1D可知,当乙醇浓度为60%时,总黄酮得率达到最大值。当乙醇浓度继续增大时,总黄酮得率下降,推测当乙醇浓度高于60%时,溶剂的极性相对降低,导致其他非黄酮类物质溶出,使得总黄酮得率下降[25]。综合上述因素,确定响应面分析的各因素考察水平分别为时间30、60、90 min,温度70、80、90 ℃,料液比1:20、1:30、1:40 g·mL-1,乙醇浓度 50%、60%、70%。经单因素实验优选的三叶青总黄酮的最佳提取条件为时间 60 min,料液比 1:30 g·mL-1,乙醇浓度 60%,温度80 ℃,该条件下总黄酮得率为37.27 mg·g-1。
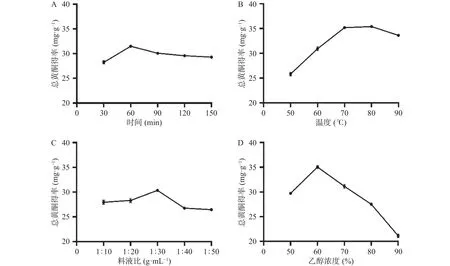
图1 单因素实验结果Fig.1 Single factor test results
2.1.2 Box-Behnken响应面优化试验 在单因素实验基础上,以提取时间(A)、提取温度(B)、料液比(C)、乙醇浓度(D)为自变量,以总黄酮得率为响应值,采用 Design-Expert 8.0.6 软件设计4因素 3水平共29个实验,如表3所示。得到总黄酮得率关于以提取时间(A)、提取温度(B)、料液比(C)、乙醇浓度(D)的回归方程:

表3 响应面试验设计及结果Table 3 Design and results of response surface tests
Y=37.73+0.30A+1.86B+0.079C-0.44D+1.18AB-0.80AC+0.43AD-0.059BC+104BD+0.24CD-1.96A2-3.83B2-3.41C2-4.70D2。
由表4 ANOVA方差分析可知,实验所选模型的决定系数R2=0.9836,调整决定系数R2adj=0.9672,模型F=60.00,P<0.0001,表明该模型具有极显著性意义;失拟项P>0.05,没有显著差异,表明该模型与实验数据拟合程度良好。B、D、AB、AC、BD、A2、B2、C2、D2的P值均小于0.05,表明其对总黄酮得率具有显著性影响。变异系数CV值为1.84%,说明模型的重现性很好,该模型可用于三叶青总黄酮的提取工艺优化。各因素的影响程度通过F值反映,F值越大代表该因素的影响程度越大,故各因素对总黄酮得率的影响次序为:提取温度>乙醇浓度>提取时间>料液比。

表4 ANOVA方差分析Table 4 ANOVA for Response Surface Quadratic model
由回归方程绘制不同因子的响应面图,以评价两两交互作用对总黄酮得率的影响并确定各因素的最佳水平范围,如图2所示。在响应面图中,曲面越陡峭,则该因素对响应值的影响越显著。在保持两个自变量之外的因素固定的前提下,两个交互的自变量对响应值的影响也可以从响应面图的曲面反映[24]。由图2可知,提取时间和提取温度(图2A),提取时间和料液比(图2B)以及提取温度和乙醇浓度(图2E)两者交互作用对响应值的影响显著,其表现为响应面曲线走势陡峭。

图2 各因素对总黄酮得率的3D响应面图Fig.2 3D response surface diagram of each factor on total flavonoids yield
通过软件 Design-Expert 10.0 软件分析得三叶青总黄酮的最佳提取条件:当提取时间为64.69 min,温度为82.65 ℃,料液比为1:29.9 g·mL-1,乙醇浓度为59.90%时,预测可达三叶青总黄酮得率38.01 mg·g-1。考虑到实际操作,最终确定最佳提取工艺为提取时间 65 min,温度 83 ℃,料液比 1:30 g·mL-1,乙醇浓度60%。此条件下对建立的模型进行验证实验,重复3 次,三叶青总黄酮得率为(37.89±0.07) mg·g-1,预测值为 38.01 mg·g-1,误差为 0.32%,小于 3%,表明该响应面法得到的预测值准确可靠。该提取工艺总黄酮得率较高,相比朱良辉等[15]在正交工艺优化下的总黄酮得率26.04 mg·g-1,有较大的提升,可为进一步研究、开发三叶青药用资源开发利用提供参考。
2.2 不同产区三叶青总黄酮得率的比较分析
以最佳提取工艺对不同产区三叶青样品进行总黄酮提取,平行3次,测得各产地三叶青总黄酮得率,如图3所示。其中以云南楚雄、福建福州、贵州黔西南产三叶青的总黄酮得率量较高,分别为51.19、51.75和49.84 mg·g-1;湖南永州、广东清远产三叶青的总黄酮得率较低,均低于25 mg·g-1。各产地三叶青中总黄酮得率差异较大,其原因可能是由于品种差异、地域气候、生长年限等因素影响而产生的结果。

图3 各产地三叶青总黄酮得率Fig.3 Yield of total flavonoids of Tetrastigma hemsleyanum Diels et Gilg
2.3 不同产地三叶青总黄酮HPLC指纹图谱建立
将18批各产地三叶青液相色谱图数据导入“中药色谱指纹图谱相似度评价系统(2012版)”进行分析,共标定11个共有峰,如图4所示。其中3号峰、7号峰在湖南永州和广东清远两地产三叶青样品中有缺失;同时通过与对照品比对,指认其中3个成分,确认5号峰为芦丁,10号峰为槲皮素,11号峰为山柰酚。其中5号峰在江西上饶产三叶青中占比最高,于湖南永州和广东清远两地产三叶青中占比较低;10(槲皮素)、11(山柰酚)号峰在云南楚雄产三叶青中占比较高,在江西上饶产三叶青中占比较少。表明该结果显示的指纹图谱中11个共有峰,可作为三叶青HPLC指纹图谱特征鉴定指标。各样品色谱图中均存在5(芦丁)号峰,其与邻峰的分离度较好,峰形较佳,且峰面积较大,故选择该峰作为参考峰(S),计算得出18批三叶青共有峰相对保留时间的RSD为 0%~0.21%,但相对峰面积的 RSD为 23.89%~194.54%,如表5所示。各产地三叶青样品共有峰相对保留时间的RSD值差异较小,但相对峰面积的RSD值差异较大,表明不同产地三叶青样品其化学成分近似,但同一化学成分含量差异较大[26]。由指纹图谱可知浙江台州产三叶青各化学成分最为丰富,且各成分含量也较高;贵州黔西南产三叶青次之;其中以湖南永州与广东清远产三叶青的化学成分种类与含量最低。同时由三叶青样品相似度评价表6可知,不同产地三叶青相似度不高,18批三叶青样品与对照指纹图谱相似度为0.770~0.961。

表6 三叶青样品相似度评价表Table 6 Similarity evaluation table of Tetrastigma hemsleyanum Diels et Gilg

图4 三叶青样品HPLC指纹图谱Fig.4 HPLC fingerprint of Tetrastigma hemsleyanum Diels et Gilg

表5 三叶青样品共有峰相对保留时间及相对峰面积Table 5 Relative retention time and relative peak area of the common peaks of Tetrastigma hemsleyanum Diels et Gilg
2.4 指纹图谱方法学考察
2.4.1 精密度实验 取S1供试品,连续进样6次,以槲皮素峰为参考峰,计算得出各共有峰相对保留时间和相对峰面积的RSD值分别小于0.4%、1.3%,表明该仪器的精密度良好。
2.4.2 稳定性实验 取S1供试品,分别在0、2、4、8、12、24 h进样测定,计算得出各共有峰相对保留时间和相对峰面积的RSD值分别小于1.2%、1.8%,表明供试品在24 h内的稳定性良好。
2.4.3 重复性实验 取6份S1供试品,分别进样,计算得出各共有峰相对保留时间和相对峰面积的RSD值分别小于0.9%、2.1%,表明该方法的重复性良好。
2.5 化学模式识别
2.5.1 不同产地三叶青总黄酮指纹图谱聚类分析以各产地三叶青11个共有峰的面积为变量,导入SPSS20.0软件,采用组间连接聚类方法,以平方Euclidean距离为度量标准进行系统聚类分析[27-28],结果如图5所示。当欧氏距离>10时,不同产地三叶青可分为 4 类,浙江台州(S1,S2)、贵州黔西南(S13,S14)样品聚为第 1 类,浙江丽水(S3,S4)、云南楚雄(S9,S10)、福建福州(S11,S12)、广西南宁(S17,S18)样品聚为第 2 类,湖南永州(S7,S8)、广东清远(S15,S16)样品聚为第 3 类,江西上饶(S5,S6)单独聚为第4类。

图5 三叶青样品聚类分析图Fig.5 Cluster analysis of Tetrastigma hemsleyanum Diels et Gilg
2.5.2 不同产地三叶青总黄酮指纹图谱主成分分析和综合评价 以各产地三叶青11个共有峰的面积为变量,导入SPSS20.0软件,得到主成分因子载荷矩阵,结果如表7所示。主成分特征值和方差贡献率是选择主成分的依据,载荷矩阵反映了各变量对主成分的重要程度[29-31]。以特征值>1为标准,得到3个主成分,其中主成分F1、F2、F3的贡献率分别为49.37%、21.30%、14.26%,累计贡献率为84.92%,表明可以反映样品大部分的信息,可作为各产地三叶青成分的评价指标。主成分因子荷载矩阵表中,峰1、2、3、5(芦丁)、6、7、8、9在主成分 1上有较高载荷,说明主成分1主要反映这8个成分指标信息;同理,主成分2主要反映峰10(槲皮素)、11(山柰酚)这2个成分指标的信息;主成分3主要反映峰4、11(山柰酚)这2个成分指标的信息。以3个主要成分建立坐标系,绘制18批三叶青样品的得分图,如图6所示,表明不同产地三叶青的质量存在一定的差异,可将18批三叶青样品分为4类,其分析结果与聚类分析结果一致。

表7 三叶青样品主成分因子荷载矩阵Table 7 Principal component factor load matrix of Tetrastigma hemsleyanum Diels et Gilg

图6 三叶青样品主成分分析得分图Fig.6 Principal component analysis scores of Tetrastigma hemsleyanum Diels et Gilg
采用3个主成分得分情况,以各主成分对应的方差贡献率为权重,按照公式F=0.4937F1+0.213F2+0.1426F3,计算综合得分及排名,如表8所示。结果表明浙江台州样品中 6、7、9、10(槲皮素)、11(山柰酚)等含量较高,且在各产地样品综合得分为31.545,位居第1位,表明浙江台州产三叶青质量最好。而湖南永州及广东清远样品不仅各成分含量低,且综合得分垫底,表明湖南永州和广东清远产三叶青质量较差。这3个产地三叶青样品主成分得分之间的差异显著,表明这些成分与三叶青质量存在着一定相关性可以反映各产地三叶青的整体性、差异性,为三叶青药材的质量控制提供更有力的参考依据。

表8 三叶青样品主成分得分、综合得分表Table 8 Principal component scores and comprehensive scores of Tetrastigma hemsleyanum Diels et Gilg
3 结论
本研究优化了三叶青总黄酮的提取工艺,以比较各产地三叶青总黄酮得率的差异,并运用指纹图谱结合化学模式识别对不同产地三叶青进行相似度、聚类、主成分分析及综合评价,可更科学、全面地评价三叶青的质量。实验结果表明,三叶青总黄酮的最佳提取工艺为:提取时间65 min,温度83 ℃,料液比1:30 g·mL-1,乙醇浓度60%,此条件下总黄酮得率为37.89 mg·g-1。应用上述最佳提取工艺对不同产地三叶青总黄酮进行提取,结果显示不同产地三叶青总黄酮得率差异较大,其中以福建福州、云南楚雄与贵州黔西南的总黄酮得率较高,而湖南永州以及广东清远的三叶青总黄酮得率较低。同时本研究优化液相色谱条件,建立各产地三叶青HPLC指纹图谱,共标定11个共有峰,并指认出5号峰为芦丁,10号峰为槲皮素,11号峰为山柰酚。相似度分析结果表明,18批三叶青样品的相似度范围为0.770~0.961,说明不同产地之间三叶青样品具有一定的差异性。聚类分析与主成分分析结果一致显示,18批三叶青样品可聚为4类。综合评价结果得出,9个产地三叶青中,以浙江台州质量最佳,其次是云南楚雄、福建福州,广东清远质量最差。由以上结果可知,总黄酮得率较高的福建福州、云南楚雄的综合评价排名靠前,而总黄酮得率较低的湖南永州、广东清远的综合排名垫底,表明综合评价的结果与各产地三叶青总黄酮的得率有一定的相关性。在后续研究中,将进一步增加总黄酮、多糖等其他成分测定,并通过功效、口感风味等对三叶青进行更全面的评价,以期为三叶青的优良品种选育、总体品质提升与资源开发利用提供一定的参考。

