半疏水基质阴离子交换晶胶对α-酮异己酸的层析吸附特性
曲 兴, 楼小玲, 张颂红, 贠军贤
半疏水基质阴离子交换晶胶对-酮异己酸的层析吸附特性
曲 兴, 楼小玲, 张颂红, 贠军贤
(浙江工业大学 化学工程学院, 绿色化学合成技术国家重点实验室培育基地, 浙江 杭州 310032)
针对微生物法制备-酮异己酸中目标物分离纯化困难的问题,以甲基丙烯酸羟乙酯和甲基丙烯酸丁酯为基质单体,采用冷冻结晶致孔和聚合法,制备半疏水基质晶胶,并接枝-三甲基乙烯基苯甲氯化铵,得到半疏水基质阴离子交换晶胶,用于-酮异己酸的层析分离。结果表明:在流速为1 cm×min-1和上样质量浓度为2.0 mg×mL-1的条件下,半疏水基质阴离子交换晶胶对牛血清白蛋白和-酮异己酸的吸附容量分别达4.42和17.56 mg×mL-1,其对-酮异己酸的吸附容量随NaCl浓度的增大而降低,且用浓度高于0.3 mol×L-1的NaCl溶液可实现洗脱。研究结果可为微生物法制备-酮异己酸的分离材料选用提供参考。
-酮异己酸;晶胶;层析;分离
1 引 言
-酮异己酸(-ketoisocaproate,KIC),即4-甲基-2-氧代戊酸,是一种高值有机酸,存在于人体血液和肌肉中,维持体内氧化还原环境。在转氨酶的作用下,KIC可与L-亮氨酸相互转化,共同调节和维持人体代谢平衡,同时具有促进骨骼肌合成、调节体内氮平衡和血糖平衡等作用,在医学应用领域有重要价值[1-5]。此外,KIC常作为中间体参与有机合成和生物合成过程,在化工、食品和饲料等其他领域也有广阔应用前景[6-8]。
KIC合成方法主要有化学法、微生物法和酶法。化学法有酰基氰化物水解法[9]、草酸类乙酯水解法[10]和海因法[11],其不仅反应条件苛刻,而且需要添加氰化物和贵金属催化剂,反应过程复杂且副产物较多。酶法[12-13]存在酶的稳定性不高、成本昂贵和转化率较低等问题。微生物法主要为谷氨酸棒杆菌工程菌株发酵合成[14-15]和全细胞转化合成[16]等方法,具有反应条件温和、成本低、环境友好、操作简单等优点,但所得KIC常常存在于含有微生物细胞的复杂发酵液或转化液中,分离纯化困难。因此,探索KIC的高效分离新方法,具有重要意义。
近年来,晶胶作为一种具有超大孔隙的新型层析材料,在生化分离领域受到广泛关注。晶胶主要通过单体经冷冻结晶致孔和聚合反应制备得到,其内部为尺寸在数微米到数百微米的相互连通的发达孔隙,具有生物相容性好、传质阻力小和分离迅速等优点,在生化分离领域具有良好应用前景。但是,晶胶用于层析分离时,其本身吸附能力较弱,通常需要结合目标物分子的特性,如亲疏水性、电荷特征、功能基团等,通过接枝修饰或引入配基以提高其选择性吸附能力[17-19]。本课题组将聚甲基丙烯酸羟乙酯晶胶接枝-三甲基乙烯基苯甲氯化铵((vinylbenzyl)trimethylammonium chloride,VBTAC),得到具有阴离子交换功能的晶胶介质,实现了一步法从澄清转化液中分离苯乳酸,苯乳酸质量分数达96.7%~98.6%[20]。
然而,目前国内外报道的晶胶介质主要是亲水基质的分离介质。最近,本课题组将疏水单体和亲水单体经结晶致孔和共聚,得到一种新型晶胶介质,即半疏水基质晶胶。这种晶胶具有部分疏水、部分亲水的基质骨架,有利于具有部分疏水的生物分子物质的吸附和分离,在生物分离领域具有重要的应用前景。苯乳酸和-酮异己酸等生物有机酸的分子结构中有疏水链和亲水基团,其在半疏水基质晶胶中的吸附和分离与亲水基质晶胶中有所不同。半疏水基质晶胶有望在-酮异己酸分离方面表现出独到的优势。
本研究以亲水性甲基丙烯酸羟乙酯(2-hydroxyethy methacrylate,HEMA)和疏水性甲基丙烯酸丁酯(butyl methacrylate,BMA)作为混合单体,通过冷冻结晶致孔和聚合,制备半疏水基质晶胶;然后通过接枝VBTAC进行化学修饰,得到具有阴离子交换功能的半疏水基质阴离子交换晶胶,简称阴离子交换晶胶。测定了其渗透率、轴向扩散和蛋白吸附能力等基础性能,并探究其对KIC的吸附和分离性能,为下一步从复杂料液中分离KIC奠定基础。
2 材料和方法
2.1 材料
2.1.1 试剂
-酮异己酸(KIC,99%),上海阿拉丁;甲基丙烯酸羟乙酯(HEMA,97%)、聚乙二醇二丙烯酸酯(polyethylene glycol diacrylate,PEGDA,相对分子质量的n=250)、四甲基乙二胺(tetramethylethylenediamine,TEMED,99%),Sigma-Aldrich;甲基丙烯酸丁酯(BMA,99%)、十二烷基硫酸钠(sodium lauryl sulfate,SDS,98%)、过硫酸铵(ammonium persulfate,APS,98%)、,,-三甲基乙烯基苯甲氯化铵(VBTAC,99%)及其他试剂均为国产分析纯。百分数均为质量分数。
2.1.2 仪器
高效液相色谱(high performance liquid chromatography,HPLC),Shimadzu LC-16/16P,日本岛津;紫外-可见光分光光度计,Ultrospec 3300 pro,GE Healthcare;超纯水系统,Milli-Q Synthesis,美国Millipore公司;低温恒温槽(THD-3030)、数控超级恒温槽(SC-15),宁波天恒仪器厂。
2.2 实验方法
2.2.1 阴离子交换晶胶的制备
将单体HEMA、BMA和PEGDA溶于质量分数为10% 的SDS溶液中,配制单体质量分数为10% 的混合液,其中HEMA、BMA和PEGDA分别占溶液总质量的3.5%、3.5% 和3%。以APS为引发剂,TEMED为加速剂,其质量分别占单体(HEMA、BMA和PEGDA)总质量的1.5% 和3%。采用冷冻结晶致孔和聚合反应法制备p(HEMA-BMA)晶胶介质,整个晶胶介质的制备过程包括配液、预冷、混合、灌注、解冻和除杂6个步骤[21]。
采用孔内原位接枝法,以二过碘酸合铜钾(K5[Cu(HIO6)2])为催化剂[22],在p(HEMA-BMA)晶胶柱上接枝单体VBTAC,得到具有阴离子交换功能的晶胶介质p(HEMA-BMA)-VBTAC[20]。
2.2.2 阴离子交换晶胶基础性能测试
阴离子交换晶胶柱长42 mm,直径10 mm,柱体积3.28 mL。对晶胶柱的基础性能进行测试,主要包括微观结构特征SEM测试[23]、停留时间分布(RTD)测试[19]、轴向扩散[24]、渗透率[25]以及孔隙率[23]。前人常用牛血清白蛋白(bovine serum albumin,BSA)作为模型蛋白,对不同阴离子交换晶胶的吸附性能进行评价。为了便于对比,本研究以BSA为模型蛋白,对所得阴离子交换晶胶的基础吸附性能进行测定和评价[26]。
2.2.3 阴离子交换晶胶对KIC的吸附特性
采用文献[20]中方法,探究氯化钠浓度对KIC在p(HEMA-BMA)-VBTAC阴离子交换晶胶中吸附性能的影响:配制浓度为0、0.001、0.01、0.1和0.3 mol×L-1的氯化钠水溶液,将KIC分别溶解于相应氯化钠溶液中,配制成质量浓度为1、5、10、15和20 mg×mL-1的KIC溶液,体积为20 mL。以不同浓度的氯化钠溶液作为缓冲溶液,平衡晶胶层析柱;将含有KIC的氯化钠溶液循环上样,流速为1.0 cm×min-1,整个过程采用紫外检测器同步检测,波长为220 nm。待KIC溶液在晶胶中吸附平衡,用缓冲液冲洗,除去未吸附的KIC,用1 mol×L-1的氯化钠溶液进行洗脱,将循环上样的KIC溶液和洗脱液进行HPLC检测,计算阴离子交换晶胶中KIC的吸附量。
根据物料衡算,通过吸附前后KIC浓度计算单位体积晶胶介质对KIC的吸附容量,如式(1)[21]:


采用Langmuir吸附平衡方程对吸附等温线进行拟合,如式(2)[21]:

式中:m为饱和吸附容量(mg×mL-1),d为解离常数(mg×mL-1)。
2.2.4 阴离子交换晶胶对KIC的层析分离特性
以不同浓度的氯化钠溶液为溶剂,分别配制质量浓度为2.0 mg×mL-1的KIC溶液,探究KIC在p(HEMA-BMA)-VBTAC晶胶柱中的层析情况。用超纯水作为缓冲液,平衡晶胶层析柱,将配好的KIC溶液上样,直到紫外信号值上升至最大且稳定,用缓冲液进行冲洗,用1 mol×L-1的氯化钠溶液进行洗脱,流速为1.0 cm×min-1。收集上样与冲洗过程床柱流出液,进行HPLC检测,计算不同氯化钠浓度下KIC在阴离子交换晶胶中的层析过程动态和吸附容量。
3 结果与讨论
3.1 阴离子交换晶胶微观结构
图1为p(HEMA-BMA)-VBTAC阴离子交换晶胶介质在扫描电镜不同放大倍数下的微观结构。由图1可见,晶胶介质微观结构清晰,内部存在分布均匀的超大孔隙,且孔隙相互连通,其尺寸为10~100mm。该晶胶介质的超大孔隙结构不仅能够满足流体在其内部低阻力流动,也可满足生物大分子和细胞通过,有利于从含细胞微生物发酵液进行KIC的层析分离。实验测得晶胶介质有效孔隙率和绝干孔隙率分别为73.53%和82.43%。

图1 阴离子交换晶胶扫描电镜图
3.2 阴离子交换晶胶基础性能
实验所得阴离子交换晶胶p(HEMA-BMA)-VBTAC的基础性能如图2所示。图中,为停留时间分布函数(s-1),q为流量(mL×min-1),L为流速(cm×min-1),load为层析收集体积(mL),Dw为压降(Pa)。
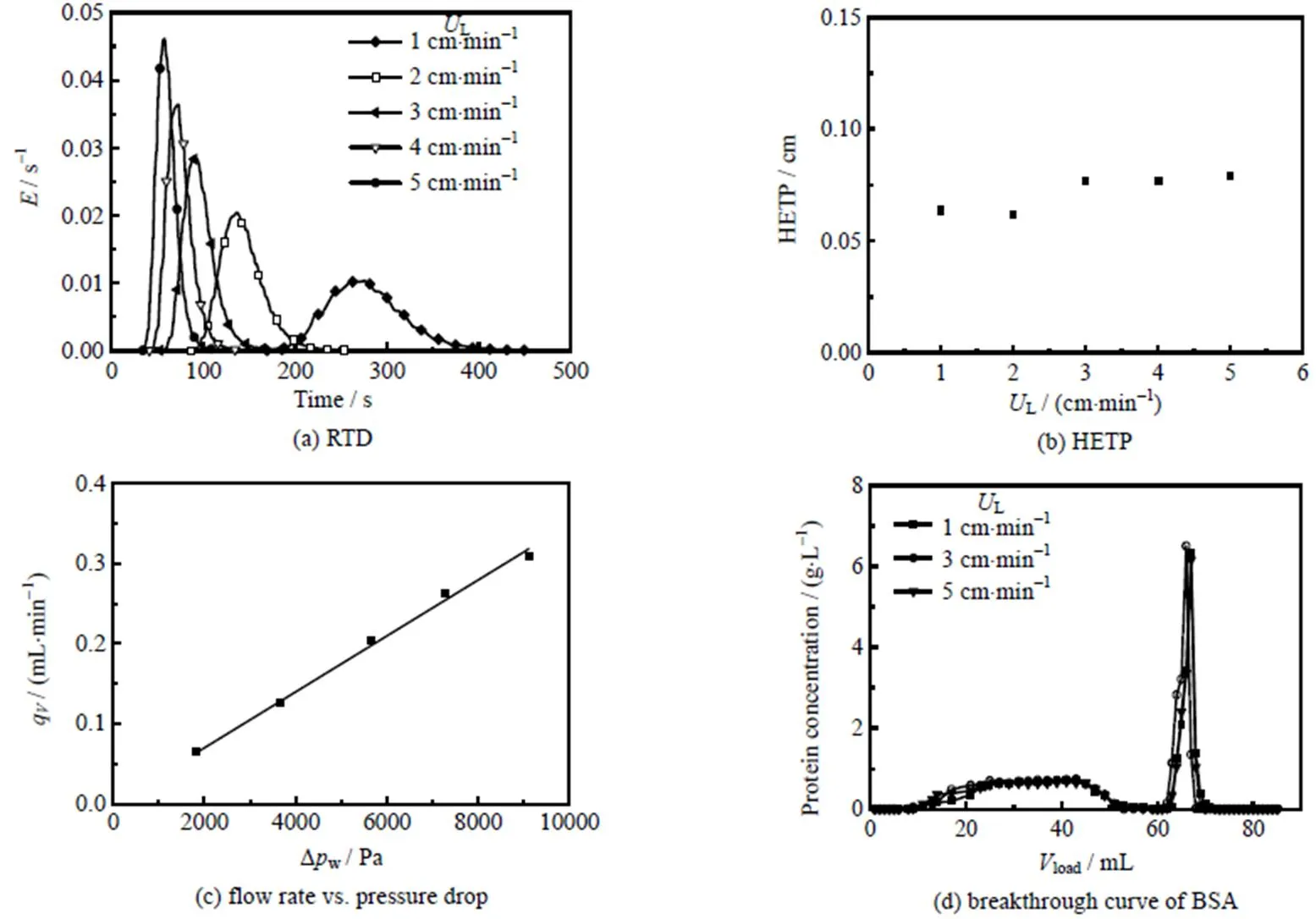
图2 阴离子交换晶胶基础性能
图2(a)为不同流速下的RTD曲线,在测试过程中,晶胶层析柱在流速1~5 cm×min-1内操作均无明显压缩,说明该晶胶介质可以适应较大流速范围的层析分离,与亲水基质的pAAM-AMPSA[27]和pHEMA-VBTAC[20]晶胶相似。晶胶床柱RTD峰形对称性良好,无明显拖尾现象,流体在晶胶介质内分布均匀,流体返混和壁流现象明显较弱,对流传质过程较强。
图2(b)是不同流速下的等板高度HETP,随着流速的增大,阴离子交换晶胶的等板高度HETP没有明显变化,说明床层稳定性良好,HETP维持在0.061~0.079 cm,明显小于Guan等[20]所得晶胶介质pHEMA-VBTAC的HETP 0.16~0.18 cm,说明p(HEMA-BMA)-VBTAC引入BMA单体后晶胶介质柱内床层结构更好,孔隙度更为均匀,理论塔板数大,层析分离能力高。

图3 不同氯化钠质量浓度下KIC的Langmuir等温吸附曲线

表1 不同氯化钠浓度下KIC的饱和吸附容量Qm和解离常数Kd
图2(c)是以体积分数为50% 的乙醇溶液测定的床层压降Dw与流量q关系曲线,由图可见,压降与流量之间线性关系良好,计算得到的晶胶柱渗透率w为6.29´10-13m2,与亲水基质pHEMA-VBTAC晶胶[20]相比,有所减小。
图2(d)为不同流速条件下BSA的层析动态曲线,由图可见,在流速分别为1.0、3.0、5.0 cm×min-1条件下,BSA层析曲线接近。通过检测和计算可得BSA的吸附容量分别为4.58、4.62和4.42 mg×mL-1,表明该晶胶介质对BSA吸附能力较强,在高流速下依然可以保持高吸附容量,有助于进一步在高流速下对KIC进行层析分离。与亲水基质pHEMA-VBTAC晶胶[20]相比,吸附容量显著提高,表明疏水单体BMA的加入,使得晶胶介质兼具疏水和离子交换作用,提高了高值有机物在晶胶介质中的吸附容量。
3.3 α-酮异己酸在阴离子交换晶胶中的吸附与分离性能
3.3.1-酮异己酸在阴离子交换晶胶中的吸附性能
在-酮异己酸的实际生物合成过程中,发酵液或转化液中通常含有不同种类的离子、残糖、代谢产物等杂质,对晶胶吸附有重要影响。而在其分离过程中,如何方便地将-酮异己酸从阴离子交换晶胶中洗脱,是需要首先解决的问题。盐是影响晶胶层析和洗脱的重要因素,研究盐浓度对吸附能力的影响具有重要意义。为了探索盐度对-酮异己酸在阴离子交换晶胶中的吸附性能和分离规律,本研究在浓度为0~0.3 mol×L-1的氯化钠溶液中,按2.2.3节所述实验方法测定阴离子交换晶胶对KIC的吸附量,并将得到KIC的Langmuir等温吸附数据进行拟合,结果如图3所示。可以看出,盐浓度对阴离子交换晶胶吸附KIC有显著影响。通过吸附等温式得到不同盐浓度下KIC的饱和吸附容量m和解离常数d等吸附平衡参数,如表1所示。
当氯化钠浓度为0 mol×L-1时,晶胶层析柱对KIC吸附容量最大,高达39.0 mg×mL-1,解离常数为3.56 mg×mL-1,表明阴离子交换晶胶对KIC具有较高吸附容量。随着盐浓度的增大,吸附容量呈现下降趋势,尤其是盐浓度由0.001升至0.01 mol×L-1时,KIC的吸附容量由36.69下降至12.65 mg×mL-1;盐浓度由0.1提升至0.3 mol×L-1时,KIC的吸附容量由8.89下降至6.01 mg×mL-1,解离常数整体呈现上升的趋势。表明在层析过程中用浓度高于0.3 mol×L-1的氯化钠溶液,即可实现洗脱。
3.3.2-酮异己酸在阴离子交换晶胶中的层析分离性能
实验进一步探究了氯化钠浓度对KIC在阴离子交换晶胶层析柱中吸附性能的影响,层析过程中KIC在晶胶中的浓度变化及吸附容量如图4所示。在层析过程中,当KIC溶液流经晶胶介质时,KIC会与晶胶中的阴离子交换官能团以离子交换作用和静电引力作用相结合;但随着上样体积的增加,晶胶介质对KIC的吸附能力减弱,越来越多的KIC穿过晶胶介质被收集,直至吸附饱和。图4(a)中上样阶段呈现出KIC浓度逐渐上升且最终趋向平缓的趋势。而氯化钠具有的屏蔽效应和可以占据晶胶介质中吸附位点的特性,会对KIC溶液在晶胶层析柱中流动与吸附性能产生显著影响,随着氯化钠浓度增大,KIC浓度上升坡度越大,达到最大浓度越快,说明高浓度盐会加快KIC穿透晶胶介质,降低晶胶介质对KIC的吸附能力。用超纯水作为缓冲液,将未被吸附的KIC冲洗下来后,用1 mol×L-1NaCl作为洗脱液,将吸附在晶胶层析柱中的KIC进行洗脱,从图4(a)可见,洗脱峰的峰形对称,且氯化钠浓度越低,洗脱峰越高。

图4 不同盐浓度下α-酮异己酸的层析过程及吸附容量
通过计算得到不同氯化钠浓度下KIC层析过程的吸附容量,如图4(b)所示。可见,KIC的吸附容量随着氯化钠浓度的增大呈现下降的趋势,与吸附实验结果类似。层析过程溶液中上样液中KIC质量浓度仅为2 mg×mL-1,尚没有达到饱和吸附的浓度。当无氯化钠时,KIC吸附容量最大,达17.56 mg×mL-1;当氯化钠浓度为0.3 mol×L-1时,KIC吸附容量最小,仅为1.06 mg×mL-1,说明提高盐浓度可以方便地洗脱。表明阴离子交换晶胶层析柱对KIC的吸附容量大,洗脱方便,可用于下一步从复杂料液中层析分离KIC。但是,由于真实KIC发酵液中往往存在细胞、培养基和亮氨酸等其他代谢产物,在一定程度上会影响KIC的竞争吸附,因此,需要对层析条件做更深入的实验研究。
4 结 论
以甲基丙烯酸羟乙酯和甲基丙烯酸丁酯作为复合单体材料,经过冷冻结晶聚合和原位接枝,制备得到具有阴离子交换功能的p(HEMA-BMA)-VBTAC阴离子交换晶胶层析介质。该层析介质具有良好的轴向扩散性能和孔隙结构,有效孔隙率为73.53%,绝干孔隙率为82.43%,在流速为1.0、3.0、5.0 cm×min-1下,BSA蛋白吸附容量分别为4.58、4.62和4.42 mg×mL-1,吸附能力稳定。-酮异己酸在该晶胶层析介质中循环上样吸附过程中,呈现出较强的盐敏感性,当无氯化钠时,阴离子交换晶胶对KIC的最大吸附容量为39.00 mg×mL-1;当盐浓度超过0.3 mol×L-1时,KIC吸附容量迅速降低。因此,可以通过提高盐浓度实现洗脱,方便-酮异己酸的高效分离。
[1] 程申, 张颂红, 贠军贤.-酮异己酸的生物合成研究进展[J]. 化工进展, 2018, 37(12): 4821-4829.
CHENG S, ZHANG S H, YUN J X. Recent advances in microbial synthesis of-ketoisocaproate [J]. Chemical Industry and Engineering Progress, 2018, 37(12): 4821-4829.
[2] BARAZZONI R, MEEK S E, EKBERY K,. Arterial KIC as marker of liver and muscle intracellular leucine pools in healthy and type 1 diabetic humans [J]. American Journal of Physiology, 1999, 277(2): E238.
[3] ZANCHI N E, GERLINGER R F, GUIMARAES F L,. HMB supplementation: clinical and athletic performance-related effects and mechanisms of action [J]. Amino Acids, 2011, 40(4): 1015-1025.
[4] CHANG J H, KIM D K, PARK J T,. Influence of ketoanalogs supplementation on the progression in chronic kidney disease patients who had training on low-protein diet [J]. Nephrology, 2009, 14(8): 750-757.
[5] LERLERCQ-MEYER V, MARCHAND J, LECLERCQ R,. Interactions of-ketoisocaproate, glucose and arginine in the secretion of glucagon and insulin from the perfused rat pancreas [J]. Diabetologia, 1979, 17(2): 121-126.
[6] ANTIZAR L B, TURRION J L. Second generation biofuels and local bioenergy systems [J]. Biofuels Bioproducts and Biorefining, 2008, 2(5): 455-469.
[7] FORTMAN J L, CHHABRA S, MUKHOPADHYAY A,. Biofuel alternatives to ethanol: Pumping the microbial well [J]. Trends in Biotechnology, 2008, 26(7): 375-381.
[8] CANN A F, LIAO J C. Pentanol isomer synthesis in engineered microorganisms [J]. Applied Microbiology and Biotechnology, 2010, 85(4): 893-899.
[9] NIMITZ J S, MOSHER H S. A new synthesis of .alpha.-keto esters and acids [J]. The Journal of Organic Chemistry, 1981, 46(1): 211-213.
[10] WATERS K L. The-keto acids [J]. Chemical Reviews, 1947, 41(3): 585-598.
[11] 丁威. 海因法合成几种-酮酸及-酮酸盐[D]. 南京: 东南大学, 2007.
DING W. Synthesis of several-ketoacids and-ketoacids salts with hydantoin method [D]. Nanjing: Dongnan University, 2007.
[12] SONG Y, LI J, SHIN H D,. One-step biosynthesis of-ketoisocaproate from L-leucine by anwhole-cell biocatalyst expressing an L-amino acid deaminase from[J]. Scientific Reports, 2015, 5: 12614.
[13] SONG Y, LI J, SHIN H D,. Tuning the transcription and translation of L-amino acid deaminase inimproves-ketoisocaproate production from L-leucine [J]. PLoS One, 2017, 12(6): e0179229.
[14] BÜCKEL-VALLANT V, KRAUSE F S, MESSERSCHMIDT S,. Metabolic engineering offor-ketoisocaproate production [J]. Applied Microbiology and Biotechnology, 2014, 98(1): 297-311.
[15] VOGT M, HAAS S, POLEN T,. Production of-ketoisocaproate withstrains devoid of plasmids and heterologous genes [J]. Microbial Biotechnology, 2015, 8(2): 351-360.
[16] ZHU Y H, LI J H, LIU L,. Production of-ketoisocaproate via free-whole-cell biotransformation byDSM 43250with L-leucine as the substrate [J]. Enzyme and Microbial Technology, 2011, 49(4): 321-325.
[17] YUN J X, SHEN S C, CHEN F,. One-step isolation of adenosine triphosphate from crude fermentation broth ofby anion-exchange chromatography using supermacroporous cryogel [J]. Journal of Chromatography B, 2007, 860(1): 57-62.
[18] YAO K J, SHEN S C, YUN J X,. Preparation of polyacrylamide-based supermacroporous monolithic cryogel beds under freezing-temperature variation conditions [J]. Chemical Engineering Science, 2006, 61(20): 6701-6708.
[19] YUN J X, JESPERSEN G R, KIRSEBOM H,. An improved capillary model for describing the microstructure characteristics, fluid hydrodynamics and breakthrough performance of proteins in cryogel beds [J]. Journal of Chromatography A, 2011, 1218: 5487-5497.
[20] GUAN J T, GUAN Y X, YUN J X,. Chromatographic separation of phenyllactic acid from crude broth using cryogels with dual functional groups [J]. Journal of Chromatography A, 2018, 1554: 92-100.
[21] 关今韬. 布氏乳杆菌转化合成苯乳酸及其晶胶分离特性研究[D]. 杭州: 浙江大学, 2018.
GUAN J T. Biosynthesis of phenyllactic acid byand the related separation performance with cryogel [D]. Hangzhou: Zhejiang University, 2018.
[22] HANORA A, PLIEVA F M, HEDSTROM M,. Capture of bacterial endotoxins using a supermacroporous monolithic matrix with immobilized polyethyleneimine, lysozyme or polymyxin B [J]. Journal of Biotechnology, 2005, 118(4): 421-433.
[23] UYGUN M, AKDUMAN B, AKGÖL S,. A new metal-chelated cryogel for reversible immobilization of urease [J]. Applied Biochemistry and Biotechnology, 2013, 170(8): 1815-1826.
[24] CHEN F, YAO K J, SHEN S C,. Influence of grafting conditions on the properties of polyacrylamide-based cation-exchange cryogels grafted with 2-acrylamido-2-methyl-1-propanesulfonic acid [J]. Chemical Engineering Science, 2008, 63(1): 71-77.
[25] LOZINSKY V I. Cryogels on the basis of natural and synthetic polymers: Preparation, properties and application [J]. Russian Chemical Reviews, 2002, 71: 489-511.
[26] YAO K J, YUN J X, SHEN S C,In-situ graft-polymerization preparation of cation-exchange supermacroporous cryogel with sulfo groups in glass columns [J]. Journal of Chromatography A, 2007, 1157(1/2): 246-251.
[27] YAO K J, SHEN S C, YUN J X,. Protein adsorption in supermacroporous cryogels with embedded nanoparticles [J]. Biochemical Engineering Journal, 2007, 36(2): 139-146.
Chromatographic and adsorption characteristics of-ketoisocaproate in semi-hydrophobic anion exchange croygel
QU Xing, LOU Xiao-ling, ZHANG Song-hong, YUN Jun-xian
(State Key Laboratory Breeding Base of Green Chemistry Synthesis Technology,College of Chemical Engineering, Zhejiang University of Technology, Hangzhou 310032, China)
Semi-hydrophobic anion exchange cryogel was prepared by cryo-polymerization using 2-hydroxyethy methacrylate and butyl methacrylate as the key monomers via graft polymerization with monomer (vinylbenzyl)trimethylammonium chlorid, which was used for the separation of-ketoisocaproate prepared by biological methods. The results show that the binding capacity of the semi-hydrophobic cryogel for bovine serum albumin and-ketoisocaproate were 4.42 and 17.56 mg×mL-1, respectively, when the loading concentration is 2.0 mg×mL-1at the flow velocity of 1 cm×min-1. The adsorption capacity for-ketoisocaproate decreased with the increase of NaCl concentration and the elution was achieved by increasing NaCl concentration over 0.3 mol×L-1.The results of this work are helpful for the selection of materials for-ketoisocaproate acid separation from biological preparation.
-ketoisocaproate; croygel; chromatography; separation
TQ028
A
10.3969/j.issn.1003-9015.2022.01.006
1003-9015(2022)01-0046-07
2021-07-20;
2021-10-10。
国家自然科学基金(22078296,21576240);浙江省自然科学基金(LD21B060001)。
曲兴(1993-),男,山东青岛人,浙江工业大学硕士生。
张颂红,E-mail:zhangsh@zjut.edu.cn
曲兴, 楼小玲, 张颂红, 贠军贤.半疏水基质阴离子交换晶胶对-酮异己酸的层析吸附特性[J]. 高校化学工程学报, 2022, 36(1): 46-52.
:QU Xing, LOU Xiao-ling, ZHANG Song-hong, YUN Jun-xian. Chromatographic and adsorption characteristics of-ketoisocaproate in semi-hydrophobic anion exchange croygel [J]. Journal of Chemical Engineering of Chinese Universities, 2022, 36(1): 46-52.

