刺激响应型抗菌剂研究进展及在胶原抗菌防腐中应用展望
孙莎莎,侯德隆,杨高夫,陈意
(四川大学轻工科学与工程学院,四川 成都 610065)
前言
胶原是细胞外基质的主要成分,其化学、空间结构独特,兼具低免疫原性、可生物降解性、止血和修复功能[1-2],在当代组织工程、医美等领域占据重要地位。
然而,胶原蛋白是一种富营养的生物大分子,极易受细菌等微生物侵蚀。研究表明,细菌新陈代谢会产生多种蛋白酶,进而破坏胶原化学、空间结构,使其凝血、促细胞粘附和增殖等生物活性降低[3]。此外,胶原器件中累积的微生物代谢产物中含多种有害物质,对使用者的健康也会造成威胁[4-5]。因此,抗菌防腐是天然胶原作为医用材料高值利用的必要前提。
长期以来,通过外添加抗菌剂以提高胶原的抗菌防腐性被证明是一种行之有效的方法。然而,常用抗菌剂大多具有生理毒性;临床应用时,胶原器件所含抗菌剂可能引发过敏、炎症、神经紊乱、甚至肾脏损伤等不良反应[6-9],破坏胶原固有生物相容性。与此同时,这些胶原器件被丢弃后,所含抗菌剂仍有活性,其环境累积可能造成细菌耐药性产生[10]。
为解决上述问题,从上世纪50年代开始,相关研究主要围绕低毒、低耐药性新型抗菌剂的研发、使用而展开,但面临投资大、风险高、周期长、收益低等问题[11]。
为传统抗菌剂分子设置活性开关是按需规避其生理毒性、抑制耐药性产生的另一有效途径。诺贝尔化学奖得主Ben L.Feringa 教授是这一研究方向的倡导者和奠基人。他曾指出[12]:“That is a whole new way of thinking about drug research—这是一种(抗菌剂)药物研究的全新方式”,同时呼吁“New approaches are needed…stimulate others to find better original solutions—(该领域)需要新的(开关)方法…(希望能)激发他人找到更好的原创解决方案”。过去十年间,科学家们通过设计高效、高选择性化学反应,已将一系列响应基团引入抗菌剂分子,利用光、温度、pH、磁、主客体等外部刺激,实现了对抗菌剂活性的按需开关控制,已取得的研究进展为解决抗菌剂的毒性及耐药性问题提供了新思路,在胶原等生物质材料的抗菌防腐中具有应用前景。
1 光响应型抗菌剂
在各种外部刺激中, 光刺激具有时空分辨率高、远程操控性强、强度/波长易控制等优点[13-15]。鉴于此,在抗菌剂分子中引入特定的感光基团,可以使其结构、物化性质对光产生响应性变化,从而实现抗菌剂活性开关控制。
2000年,美国韦恩州立大学的Lee 等人[16]首次报道了一种光致失活型β-内酰胺抗菌剂。该抗菌剂的分子结构中具有一个活性肼,并受到光敏邻硝基苄酯保护。正常状态下,该抗菌剂具有广谱抗菌活性;当其进入环境后,在可见光照射下,邻硝基苄酯会在数小时后全部断裂,暴露后的活性肼随即与抗菌剂中内酰胺羰基反应成环。该环状结构并不稳定,会继续发生降解反应,导致抗菌剂失活,可有效避免活性抗菌剂在环境中累积引起耐药性。然而,上述策略须将邻硝基苄酯保护的活性肼引入抗菌剂分子特定位置,合成步骤较为繁琐;与此同时,改性后的抗菌剂活性是否能达到抗菌剂原有水平,Lee等人并未在其文章中明确说明。
上述光致失活策略虽行之有效,但并不具有普适性,因为并非所有抗菌剂都具备分子内成环的结构基础。鉴于此,科研工作者开始探索其他更具普适性的抗菌剂改性及活性调控方法。2013年,荷兰Ben L.Feringa 课题组的Velema 等人[17]发现,将芳基偶氮共价连接于喹诺酮抗菌剂苯环后,喹诺酮的抗菌活性在紫外光(λ=365 nm)照射前后有明显变化:照射前,该抗菌剂对大肠杆菌和滕黄微球菌的最小抑菌浓度(MIC) 分别为>64 μg/mL 和16 μg/mL;照射后,对上述菌种的MIC 分别下降至16 μg/mL 和2 μg/mL,抗菌活性显著上升。虽然Velema等人并未说明造成这一现象的根本原因,但猜测与芳基偶氮光致反→顺异构有关。更为重要的是,在紫外光照射后,芳基偶氮受热会恢复至反式构象,导致抗菌剂失活,即:这类抗菌剂在发挥完抗菌作用后会自动失活,可避免活性抗菌剂在环境中累积并造成耐药性。
因紫外光具有细胞毒性[18],且穿透深度不足[19],限制了其实际应用。为解决这一问题,2017年,Ben L. Feringa 课题组的Wegener 等人[20]又以甲氧苄氨嘧啶为模型抗菌剂,使用氯代偶氮苯对其非药效基团进行光可异构化改性,获得了可在绿、紫或红光光照射下发生构象转变的刺激响应型抗菌剂。其中,基于红光刺激的氯代偶氮苯改性甲氧苄氨嘧啶照射前对大肠杆菌的MIC>80 μM,照射后MIC 降至10 μM,抗菌活性提高至少8 倍。由于可见光无毒、穿透性更强,上述工作为实现光响应抗菌剂在生理条件下的实际应用奠定了基础。
Ben L.Feringa 课题组的研究工作证实,将光敏基团共价偶联于抗菌剂非药效基团,可在光刺激下实现多种抗菌剂活性开关控制。这一设计思路看似具有普适性,但光敏基团被永久固定于抗菌剂分子中,已破坏了抗菌剂原有化学、空间结构。因此,研究人员发现,即使处于“开启”状态,这些光敏抗菌剂的活性已无法再现改性前水平[21]。为此,2020年,四川大学的Hou 等人[22]报道了一种全新的光响应抗菌剂设计方法,即将光敏邻硝基苄酯直接偶联于环丙沙星3-羧基,利用邻硝基苄酯暂时掩蔽抗菌剂母核及其光致分解特性,同时实现高开关比与“开启”状态下环丙沙星强抗菌活性再现。实验结果显示,母核改性后的环丙沙星MIC提升至8.0 μM,其抗菌活性被邻硝基苄酯大幅掩蔽。高效液相色谱检测结果表明,在365 nm 紫外光照射下,邻硝基苄酯随之断裂,抗菌剂MIC 降至0.5 μM(开关比=16),与环丙沙星原有抗菌活性基本相当,即其抗菌活性可光控激活。这种光响应抗菌特性在活死细胞染色、紫外光随机引入、细菌图案化生长实验中得到了进一步证实。上述设计思路基于邻硝基苄酯光解反应机理,以保留抗菌剂原有活性、获得高开关比为目的,为解决前人光响应抗菌剂设计中存在的共性问题提供了借鉴。2021年初,瑞士苏黎世大学的Shchelik 等人[23]采用这种掩蔽抗菌剂母核的策略,实现了万古霉素和头孢菌素两类抗菌剂的光致激活。
2 热响应型抗菌剂
医用胶原器件通常储存于低温水介质中,一旦与活组织接触,将立即升温至35~37 ℃。这一自然温差为科研工作者设计热响应抗菌剂,实现胶原所含抗菌剂活性“自适应”调节提供了有利条件。
革兰氏阴性菌外膜外侧被具有准晶态结构的脂多糖占据,渗透性极低;许多具有胞内靶标的抗菌剂(如磺胺类、喹诺酮类、β-内酰胺类等)在跨细菌外膜转运时,须利用外膜孔蛋白作为非特异性通道;这些孔蛋白的内腔直径固定(0.7~1.2 nm),具有尺寸选择性,只允许短小的线型亲水分子通过,对长度或截面积超限的分子则具有阻透作用[24]。
受细菌外膜孔蛋白对渗透物的尺寸选择性启发,四川大学的Chang 等人[25]利用可逆加成-断裂链转移聚合技术,控制N-异丙基丙烯酰胺和N-丙烯酰化环丙沙星顺序聚合,将热敏聚N-异丙基丙烯酰胺(PNIPAM)共价偶联到环丙沙星分子上,利用PNIPAM 在低临界溶解温度上下的伸展- 塌缩构象转变,控制环丙沙星跨外膜与其胞内靶标接触的能力,实现对环丙沙星抗菌活性的温控调节(如图1 所示)。实验结果发现,当PNIPAM 的数均相对分子质量从2592 增加到10 190 时,在开关温度(33 ℃)以下,热响应环丙沙星对野生型大肠杆菌的MIC 从6 μg/mL 降至1.5 μg/mL,而在开关温度以上,其MIC 由96 μg/mL 降至3 μg/mL,即开关比随PNIPAM 分子量增加由16 降至2。与野生型大肠杆菌相比,热响应环丙沙星对孔蛋白缺失型大肠杆菌的MIC 在开关温度上下没有明显差异,证实外膜孔蛋白参与控制热响应环丙沙星与胞内靶标接触。

图1 PNIPAM 改性环丙沙星抗菌剂合成路线及产物抗菌活性温控开关机制[25]
为揭示上述热响应抗菌剂的工作机制,Chang等人进一步采用动/静态光散射、X 射线光电子能谱、荧光标记法及流式细胞术证实:在开关温度以下,PNIPAM 链呈现伸展构象,垂直于其长度方向具有较小的横截面,此时的热响应型环丙沙星可穿过外膜孔蛋白内腔与其胞内靶标接触,具有抗菌活性;在开关温度以上,PNIPAM 链受热塌缩成球体,热响应环丙沙星尺寸大于孔蛋白内径,无法透过孔蛋白与其胞内靶标接触,其抗菌活性得以掩蔽。
由于上述热响应抗菌剂的开关温度(约32 ℃)正好在医用胶原存储温度与活组织温度之间,Chang 等人[26]进一步提出:可将上述热响应抗菌剂共价固定于胶原表面,利用医用胶原存储温度与活组织温度间自然温差,实现胶原储存稳定性与使用安全性“自适应”调节。在低温存储条件下,固定于胶原表面的热响应环丙沙星处于伸展状态,仍可利用细菌外膜孔蛋白通道进入胞内发挥抗菌作用,保证胶原器件不受微生物侵蚀;一旦与活组织接触,上述热响应抗菌剂受生理温度影响迅速塌缩,环丙沙星由于无法通过孔蛋白而失活,其毒副作用随之屏蔽。上述“自适应”抗菌模式无需任何物理或化学干涉即可进行,为解决天然胶原抗菌防腐必要性与维持生物相容性完整间由来已久的矛盾提供了新思路。
当然,PNIPAM 共价偶联会改变抗菌剂原有化学结构,既影响抗菌剂抗菌活性,合成步骤又较为繁琐。直接以热敏PNIPAM 为抗菌剂载体可很好地解决上述问题。例如,Hathaway 等人[27]直接将溶葡萄球菌酶和噬菌体内吞酶两类抗菌剂负载于PNIPAM纳米颗粒。在低温状态下,两类抗菌剂被限制在PNIPAM 纳米颗粒内,处于“失活”状态;在开关温度以上,PNIPAM 受热收缩,可将噬菌体内吞酶和溶葡萄球菌酶释放出来,并在特定部位聚集,发挥协同抗菌作用,表现出受温度控制的抗菌活性开关。
3 pH 响应型抗菌剂
一般而言,抗菌剂的结构、物化性质非常稳定,不会随环境pH 值发生改变。因此,为制备pH 值响应型抗菌剂,只能将抗菌剂负载于pH 敏感的胶束、纳米颗粒或水凝胶中,利用上述载体在环境pH 变化前后性质突变,实现抗菌剂按需释放,进而“打开”其抗菌活性。
例如,Sonawane 等人[28]制备了一种新型AB2 型两亲嵌段共聚物,其亲水和亲油端由pH 值敏感型腙键连接。在水相中,上述共聚物会自动形成胶束,并将万古霉素抗菌剂包覆于疏水内核中。当环境pH 值由7.4 下降到6.0 时,腙键逐渐断裂,造成胶束解体,万古霉素抗菌剂随即从胶束中释放出来。通过这种方式,可按需调控所需抗菌剂浓度,实现抗菌剂活性开关控制。
除此之外,Pichavant 等人[29]利用聚乙二醇将硫酸庆大霉素抗菌剂与降冰片烯偶联,再以上述偶联体、降冰片烯为单体,通过开环易位共聚反应,合成出pH 响应型抗菌纳米颗粒。这种智能抗菌材料正常工作的关键在于:硫酸庆大霉素通过pH 敏感的亚胺键与聚乙二醇偶联。当环境pH 值由7.0 下降至4.0 时,起连接作用的亚胺键随即断裂,进而实现硫酸庆大霉素按需释放。受此影响,上述纳米颗粒对表皮葡萄球菌的MIC 由108 μg/mL 下降至10 μg/mL,其抗菌功能受环境pH 值变化显著增强。
4 磁响应型抗菌剂
将抗菌剂负载于磁性纳米粒子上,可制得磁响应型抗菌剂。这类抗菌剂具有两种工作模式:首先,在磁场作用下,抗菌剂的局部浓度会发生突变,表现出突然增强的抗菌活性。例如,Pageni 等人[30]利用表面引发可逆加成- 断裂链转移自由基聚合法(RAFT),将含钴金属聚合物接枝到磁性四氧化三铁纳米粒子表面,再通过静电相互作用将青霉素-G与该金属聚合物结合(如图2 所示)。实验发现,施加外部磁场前,青霉素-G 较为分散,局部浓度不足以杀灭细菌;在施加外部磁场后,由于青霉素-G 在局部富集,具有良好的抗菌效果,能有效杀灭金黄色葡萄球菌、蜡样芽孢杆菌、大肠杆菌、普通变形杆菌和肺炎克雷伯菌。
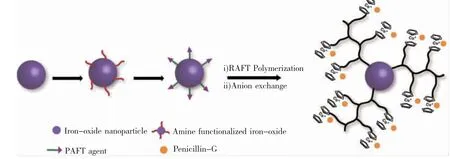
图2 表面引发RAFT 聚合法制备含青霉素-G 磁性四氧化三铁抗菌材料[30]
其次,当磁性抗菌剂完成抗菌使命后,也可利用磁场作用,将抗菌剂重新富集以减少其环境累积。例如,四川大学Chang 等人[6]利用环丙沙星非药效仲胺基团与丙烯酰氯间酰胺化反应,制备出N-丙烯酰化环丙沙星;然后,基于N-丙烯酰化环丙沙星与丙烯酸间自由基共聚反应,将环丙沙星固定于乙烯基改性的纳米四氧化三铁表面,利用纳米四氧化三铁的磁响应特性,实现了环丙沙星在胶原溶液中的可控回收,为解决活性抗菌剂在胶原溶液中的残留问题提供了技术支撑。
5 主客体响应型抗菌剂
基于分子识别的主客体化学是一门发展迅速的新兴交叉学科,是当今科学研究的热点之一。近年来,基于主客体反应制备刺激响应型抗菌剂也取得了一定进展。
葫芦[7]脲(CB[7])是由七个苷脲单元通过亚甲基桥联而成的刚性大环化合物,具有一个疏水空腔和两个由羰基环绕而成的富电子洞口,可依靠疏水作用、离子-偶极相互作用,选择性包合与其极性、大小匹配的化合物[31]。利用葫芦[7]脲主客体相互作用,中科院Shu Wang 课题组的Bai 等人[32]开发了一种超分子抗菌剂活性开关。他们采用的抗菌剂为带季铵阳离子基团(QA)侧链的聚(亚苯基亚乙烯基)衍生物(PPV),其侧链季铵阳离子基团可杀灭细菌。当CB[7]将QA 侧链超分子包合时,PPV 的抗菌活性随之关闭;在加入能与CB[7]竞争结合的金刚烷胺后,QA 侧链随之暴露,并重新表现出抗菌活性(如图3 所示)。通过这种方式,可实现抗菌剂生物活性的按需打开与关闭,且无需对抗菌剂进行任何化学修饰,具有方法简单、快速高效的特点。基于类似的响应机制,Shu Wang 课题组的Huang 等人[33]还通过控制CB[7]主体添加量,实现了聚-L-赖氨酸客体抗菌活性强弱按需控制。
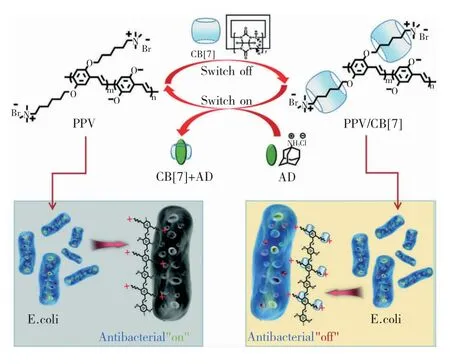
图3 基于主客体相互作用的PPV 抗菌剂活性开关工作机制[32]
由于空腔尺寸较大,葫芦[8]脲能在保证高结合常数的同时包合两个客体分子[34]。鉴于此,Li 等人[35]利用葫芦[8]脲可主客体包合两个苯丙氨酰基分子的特点,以葫芦[8]脲交联含苯丙氨酰支链的聚乙烯亚胺(PEI)。结果发现:可能是由于交联前的苯丙氨酰化PEI 局部浓度较低,呈生物惰性,而葫芦[8]脲交联后可增大抗菌剂局部浓度,赋予上述材料强抗菌活性。在此基础上,加入能与葫芦[8]脲形成更稳定复合物的竞争性客体分子后,苯丙氨酰化PEI 的抗菌活性随之关闭。
最后,本文所述各类刺激响应型抗菌剂使用的模型抗菌剂、响应基团、开关原理、优缺点等基本信息汇总列于表1。
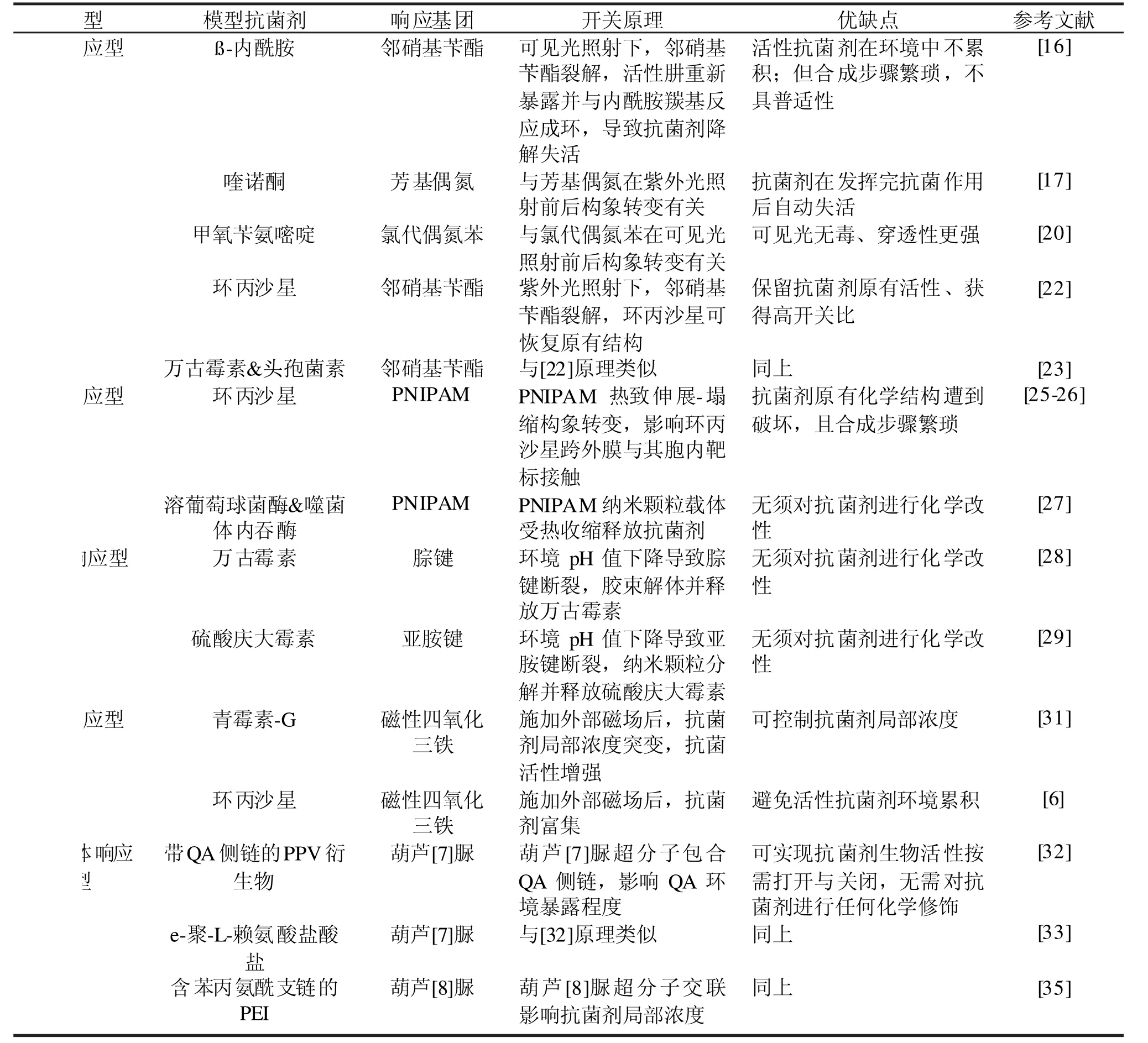
表1 刺激响应型抗菌剂分类汇总Tab.1 A summary of stimulus-responsive antibacterial agents
展望
如前所述,在低毒、低耐药性新型抗菌剂尚缺乏的情况下,已有科研工作者尝试将热、磁响应抗菌剂应用于胶原抗菌防腐,借助胶原储存液与人体自然温差、外部磁场,或“自适应”关闭胶原所含抗菌剂活性,或将胶原所含抗菌剂富集回收,为规避胶原所含抗菌剂毒副作用、防止细菌耐药性产生提供了新思路。
实际上,光、pH、主客体响应型抗菌剂在胶原等生物质的抗菌防腐中同样具有应用前景。不难想象,可将光致失活型抗菌剂负载于胶原基医用材料,利用光照前抗菌剂抗菌功能,防止胶原在储存、使用过程中变质。当胶原基医用材料被丢弃后,所含抗菌剂会按设计在紫外或可见光照射下发生降解反应,避免活性抗菌剂在环境中累积。当然,主客体响应型抗菌剂也可实现同样功能,只要该抗菌剂与主体超分子结合会大幅降低其靶标可及性。
目前,造成刺激响应型抗菌剂在胶原等生物质抗菌防腐中应用受阻的原因包括:(1)为赋予传统抗菌剂刺激响应功能,通常需要对抗菌剂分子结构进行改造,存在合成步骤繁琐、产率低、容易造成抗菌剂活性下降等问题;(2)上述化学改性是否会带来额外的毒副作用尚不得而知;(3)不少已报道的刺激响应抗菌剂工作机制尚不明确,前人相关解释甚至相互矛盾,无法为胶原专用刺激响应抗菌剂的分子设计提供理论指导;(4)刺激响应抗菌剂具有“开→关”、“关→开”两种工作模式,其中只有“开→关”模式可用于规避胶原所含抗菌剂毒副作用并防止细菌耐药性产生,而大量具有“关→开”工作模式的刺激响应型抗菌剂在胶原抗菌防腐领域暂时无用武之地。

