鸦胆子苦醇抑制H1299非小细胞肺癌细胞增殖和促进其凋亡的机制
何 爽,杜玉梅,唐加峰,黄世莹,张 滔,卢睿瑾,李 静,徐 航,陈地龙,
(重庆医科大学1.基础医学院组织学与胚胎学教研室、2.公共卫生与管理学院,重庆 400016;3.重庆三峡医药高等专科学校,重庆 404120)
肺癌是世界上最常见的恶性肿瘤之一,并且发病率和死亡率均居于首位[1]。肺癌按照其病理类型可分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌两种,其中非小细胞肺癌约占85%[2]。目前,对于NSCLC的治疗策略包括手术、放疗化疗、光动力疗法、分子靶向治疗等,但由于其早诊率低,化疗有效率低且副作用大、易耐药和复发率高等导致总体治疗效果不理想,五年生存率仅15%,因此迫切需要开发新的治疗药物[3]。
近年来,天然草药化合物作为单一疗法或者联合放化疗在治疗各种肿瘤中取得了喜人的成果。鸦胆子苦醇(brusatol,BRU)是从中药鸦胆子中提取得到的一种苦木内酯类化合物[4],研究表明,鸦胆子苦醇能够作为核因子红系2相关因子2(nuclear factor-erythroid2 related factor 2,Nrf2)的抑制剂,能以Keap1独立的方式增强Nrf2的泛素化和降解来降低Nrf2的蛋白水平[5-6],从而增强多种癌细胞如大肠癌、肺癌、胆囊癌、胰腺癌对各种化疗药物如顺铂、紫杉醇、吉他西滨、5-氟尿嘧啶等的敏感性[7]。此外,BRU对癌细胞的作用靶标非常广泛,如PI3K、Akt、JNK、p38、MAPK等均受到BRU的影响[8-9]。同时,鸦胆子苦醇对多种肿瘤细胞系具有强大的细胞毒性作用,包括肝细胞癌、大肠癌、胰腺癌、头颈鳞状细胞癌、神经胶质瘤和鼻咽癌等等[8-9]。而鸦胆子苦醇对于非小细胞肺癌的作用及其机制的研究却报道较少。在本研究中,我们选用非小细胞肺癌细胞H1299细胞系作为研究对象,旨在探讨鸦胆子苦醇对非小细胞肺癌的具体作用方式及其可能的机制。
1 材料与方法
1.1 药物与试剂鸦胆子苦醇(BRU,纯度 ≥98%,B26016)购自上海源叶科技有限公司;Cell Counting Kit-8(CCK-8,HY-K0301)购自MCE公司;胎牛血清(10270-106)、蛋白酶抑制剂(IPVH00010)、青-链霉素(10378016)、RPMI 1640培养基(货号1640TS)均购自美国赛默飞公司;磷酸盐缓冲液(PBS,C0221A)、二甲基亚砜(DMSO,ST038)、RIPA裂解液(P0013B)、BCA蛋白浓度测定试剂盒(增强型,P0010)、细胞凋亡-Hoechst33258染色试剂盒(C1017)、一抗抗体Bcl-xL(AB126)均购自碧云天生物技术有限公司;PAGE凝胶快速制备试剂盒(03516100)、双色预染蛋白Marker(WJ101)、无蛋白快速封闭液(PS108)均购自雅酶生物;一抗抗体Bax(5023S)、Bcl-2(4223S)、GAPDH(5174S)、β-actin(3700S)、Histone H3(4499S)、PI3K(4257T)、Akt(4691S)、p-Akt(4058S)、NF-κB-p65(4058S)、GADD45α(4632S)、二抗抗体(7072S、9076S)均购自美国CST公司。
1.2 细胞株H1299人非小细胞肺癌细胞株购自上海中乔新舟生物科技有限公司。
1.3 仪器超净工作台(赛默飞世尔科技);低速离心机(北京白洋医疗器械有限公司);低温高速台式离心机(长沙平凡仪器仪表有限公司);电泳仪、电转仪(北京龙方科技有限公司);倒置荧光显微镜(德国Leica公司);流式细胞仪(美国贝克曼库尔特公司)。
1.4 细胞培养将H1299细胞置于含有10%胎牛血清和1%双抗(青霉素与链霉素混合)的RPMI 1640培养基中,置于37 ℃、5%CO2孵箱中培养,当细胞铺满培养皿底部约70%时进行传代操作。
1.5 CCK-8法检测BRU处理对H1299细胞增殖的影响取对数生长期的H1299细胞,以5×107·L-1接种于96孔板中,每孔100 μL,每组3个复孔。实验分3组:分别为未接种细胞的空白组,接种细胞未加入BRU常规培养的对照组,接种细胞并含不同浓度BRU(31.25、62.5、125、250、500、10 00 nmol·L-1)的加药组。分别培养各组细胞12、24、48 h后弃旧培养基,各孔加入100 μL含10% CCK-8的无血清RPMI 1640培养基后继续在孵箱中孵育两小时,在450 nm吸光度测定各孔吸光度值(A),计算抑制率,抑制率/%=(A对照组-A加药组)/(A对照组-A空白组)×100%,同时计算IC50。实验重复3次。
1.6 EdU法检测BRU处理对H1299细胞增殖的影响取对数生长期的H1299细胞,以1.5×107·L-1接种于6孔板,2 mL/孔。将实验分为3组,对照组:接种细胞常规培养不加入药物;低药物组:处理药物浓度为0.3 μmol·L-1;高药物组:药物浓度为0.6 μmol·L-1。于孵箱中培养24 h后,按照BeyoClickTMEdU-488细胞增殖检测试剂盒说明书操作后使用倒置荧光显微镜拍摄图像。实验重复3次。
1.7 克隆形成实验检测BRU处理对H1299细胞克隆形成能力的影响取对数生长期的H1299细胞,显微镜计数后调整细胞浓度以每孔500个细胞接种于6孔板中,待细胞贴壁后弃旧培养液。分3组,加药处理细胞后于孵箱培养24 h后更换新鲜RPMI 1640完全培养基继续培养约14 d,每3 d更换1次培养液。当6孔板中形成明显的集落时终止培养,弃旧培养液,用PBS洗涤两次后加入4%多聚甲醛固定液固定细胞15 min,弃固定液后PBS洗涤两次加入结晶紫染料染色5 min,流水缓慢冲洗多余染色液,使用倒置荧光显微镜拍照后用软件ImageJ统计分析。实验重复3次。
1.8 Hoechst33258染色实验检测BRU处理对肿瘤细胞凋亡的影响取对数生长期的H1299细胞,以1.5×107·L-1接种于6孔板,每孔2 mL。此实验分为3组,分别为常规培养不加入药物的对照组,药物浓度为0.3、0.6 μmol·L-1的加药组。加入药物后细胞于孵箱中培养24 h,24 h后弃旧培养基,使用PBS洗涤两次,加入固定液固定。弃固定液后,使用PBS洗涤两次,加入Hoechst 33258染液染色5 min。弃染液后PBS洗涤3次,使用倒置荧光显微镜拍照,该实验重复3次。
1.9 流式细胞仪检测BRU处理对H1299细胞凋亡的影响取对数生长期的H1299细胞,以每孔3×104个细胞接种于6孔板,细胞贴壁后弃旧培养基,加入含0、0.3、0.6 μmol·L-1BRU的RPMI1640完全培养基于孵箱中继续培养24 h。培养结束后弃旧培养液,使用PBS清洗两次后用胰酶消化液消化细胞,离心后用PBS离心清洗细胞,反复两次。按照Annexin V-FITC/PI凋亡检测试剂盒说明书操作后用流式细胞仪检测。实验重复3次。
1.10 蛋白质印迹法(Western blot)检测BRU处理H1299细胞后相关蛋白的表达水平将细胞分为3组,分别加入药物处理细胞24 h后收集细胞,提取细胞总蛋白与胞质、胞核蛋白。使用BCA蛋白浓度测定试剂盒(增强型)检测蛋白浓度。SDS-PAGE电泳分离各组蛋白,电转至PVDF膜上,封闭液于常温下封闭20 min,4 ℃孵育一抗Bcl-xL、Bax、Bcl-2、caspase3、cleaved-caspase3、Gadd45α、PI3K、p-PI3K、Akt、p-Akt、NF-κB-p65、GAPDH、β-actin、Histone H3过夜。TBST(1×)清洗3次,二抗室温孵育1 h,TBST(1×)清洗3次,于暗室使用ECL化学发光试剂盒显影。实验重复3次。
1.11 统计学方法所有的计量资料数据均使用Graphpad Prism 6.0 软件进行统计分析,使用单因素方差分析,两组间比较用t检验。
2 结果
2.1 BRU抑制H1299细胞的增殖CCK-8结果(Fig 1)显示,不同浓度的BRU作用于H1299细胞12、24、48 h后,与对照组相比,H1299细胞的增殖明显被抑制,差异具有统计学意义(P<0.05),且抑制作用随着BRU剂量和时间的增加而增强。24与48 h的IC50分别为0.69和0.25 μmol·L-1,故后续实验选用0.6 μmol·L-1的BRU作为细胞的最高处理浓度。
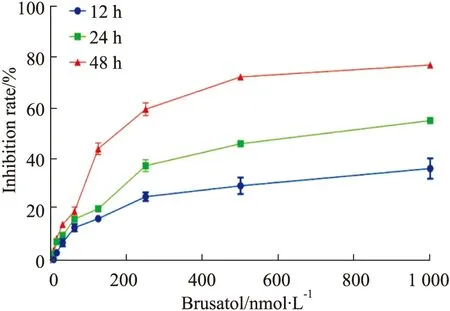
Fig 1 Inhibitory effect of brusatol on H1299 cells by CCK-8 n=3 )
EdU如Fig 2A显示,使用药物BRU处理H1299细胞24 h后,与对照组相比,细胞中EdU的掺入明显降低,并且随着药物浓度的增加呈现下降趋势。
克隆形成实验结果如Fig 2B显示,使用BRU处理H1299细胞后,药物处理组细胞的克隆形成能力明显低于对照组,与对照组相比,药物处理组的克隆形成率分别下降至55.7%、33.8%,且差异具有统计学意义(P<0.05)。
2.2 BRU诱导H1299细胞发生凋亡Hoechst 33258凋亡染色实验结果见Fig 3A,如图可见,对照组细胞形态清晰,细胞核为规则的椭圆形,并且呈弥散均匀的淡蓝色;而使用不同浓度的BRU处理H1299细胞24 h后,H1299细胞核出现细胞形态不清晰,细胞核体积缩小,染色质致密浓染且颜色有些发白等典型细胞凋亡特征。流式细胞仪检测结果见Fig 3B,流式凋亡图共分4个象限,左上象限为坏死细胞、左下象限为正常活细胞、右上象限晚期凋亡细胞、右下象限为早期凋亡细胞,所以细胞的凋亡率应该为右上、右下象限百分率之和。药物处理组的细胞凋亡率分别上升到11.3%和21.7%,明显高于对照组的4.9%,且差异具有统计学意义(P<0.05)。

Fig 2 Results of EdU staining (A,×200)and clone formation assay ( n=3 )

Fig 3 Results of Hoechst 33258 apoptosis staining (A,×200)and the apoptosis results of flow cytometry n=3)

Fig 4 Expression levels of apoptosis proteins in H1299 cells n=3 )
2.3 BRU影响H1299细胞凋亡相关蛋白的表达使用不同浓度的BRU处理H1299细胞24 h后,提取蛋白质,Western blot结果见Fig 4,BRU处理组细胞中抗凋亡标记物Bcl-xL、Bcl-2、caspase-3的表达水平明显低于对照组且随着BRU的浓度增加而降低;而DNA损伤与周期阻滞标记物Gadd45α、凋亡标记物Bax、cleaved-caspase-3的蛋白质水平明显高于对照组,且呈BRU浓度依赖性增加(P<0.05)。
2.4 BRU抑制PI3K/Akt信号通路的激活并抑制NF-κB的核转运为了研究BRU影响H1299细胞凋亡的机制,通过Western blot 实验检测了PI3K、p-PI3K、Akt、p-Akt的表达水平及NF-κB在胞核和胞质内的蛋白质水平。结果如Fig 5所示,使用不同浓度的BRU处理细胞后,磷酸化PI3K与p-Akt的蛋白质水平均剂量依赖性降低,且细胞核中p65的蛋白质水平降低,而细胞质中p65的蛋白质水平上升。
3 讨论
非小细胞肺癌作为一种发病率和死亡率在全球都居于首位的呼吸系统常见的恶性肿瘤,其发病隐匿,早期很难被确诊,患者一经确诊往往已经处于中晚期[10]。对于早期非小细胞肺癌,手术切除治疗是其首选方案,但往往伴随着高风险与较差的预后,患者术后生存率很低。而对于不可切除的中晚期非小细胞肺癌,铂类药物化疗仍是一线治疗方案,尽管已经开发出其它的治疗药物如吉非替尼、吉他西滨等,但严重的副作用与耐药限制了这些药物的疗效,所以当前研究的关键是寻找一种安全高效的NSCLC治疗药物。

Fig 5 Protein expression of PI3K/Akt signaling pathway (A)and NF-κB-p65 (B,C)components in H1299 cells n=3)
大量研究表明,在放化疗治疗癌症的过程中,常使用中草药来增加其疗效并减少这些疗法引起的副作用和并发症,中草药及其提取物在肿瘤治疗方面表现出了极大的潜力[11]。BRU作为一种潜在的抗癌药物,大量的研究已经证实其优秀的抗癌能力。例如,BRU通过抑制Nrf2途径增强了顺铂在突变的KrasG12D诱导的肺癌小鼠模型中抗肿瘤功效[12],还能通过促进活性氧产生和增强DNA损伤来增强A549细胞的放射敏感性[13]。然而,BRU对肺癌的抗癌作用研究多集中于作为化疗或者放疗中的增敏剂,作为单一疗法对肺癌的潜在作用和机制仍有待深入研究。因此,本研究选择非小细胞肺癌H1299细胞系来探究BRU对其的作用及其可能的机制。首先,CCK-8法结果显示,BRU呈浓度和剂量依赖地抑制了H1299细胞的增殖,并且BRU的作用浓度较低,表明H1299细胞对BRU的敏感性较高。同时,克隆形成实验与EdU染色实验也进一步证实了BRU呈浓度依赖地抑制H1299细胞的增殖。
肿瘤细胞可通过凋亡信号的失调,尤其是抗凋亡系统的激活来逃避凋亡或程序性细胞死亡,从而导致恶性增殖,治疗抗性和癌症复发[14]。因此,诱导细胞凋亡是许多抗癌药物的重要作用方式之一。Hoechst 33258染色实验结果表明BRU诱导了H1299细胞的凋亡,同时,流式细胞术结果也证实了BRU能够诱导细胞凋亡,且凋亡率随着药物浓度升高而增加。因此我们进一步探寻了BRU抑制H1299细胞增殖和诱导凋亡的机制。
NF-κB是一种普遍表达的转录因子,具有五个不同的同源和异二聚体复合蛋白,其中一个p65亚基与p50亚基形成p50/p65异二聚体在肿瘤细胞存活、增殖和分化及其他过程中起着至关重要的作用[15]。当p50/p65异二聚体被释放入核后,p50亚基与DNA结合,而p65亚基进行转录激活,诱导或抑制下游靶基因表达。生长阻滞DNA损伤45(Gadd45)蛋白与Bcl-xL蛋白均受到NF-κB的调控。正常情况下,NF-κB抑制癌细胞中Gadd45α的表达,这对于癌细胞的存活起着至关重要的作用,且Gadd45α与癌细胞周期阻滞也密切相关。Bcl-xL作为一种凋亡抑制蛋白,在癌细胞的凋亡调控中同样也起着关键的作用。在本研究中我们发现,BRU能明显降低H1299细胞核中p65的蛋白质表达水平,增加胞质中的p65蛋白质的表达水平,这说明BRU阻止了H1299细胞中p65蛋白质的核转运,从而上调Gadd45α蛋白质表达水平,下调Bcl-xL的蛋白质表达水平,最终抑制肿瘤增殖并促进其凋亡。
磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)通路在调控细胞存活、增殖、分化、血管生成和凋亡中同样发挥重要作用,而PI3K/Akt信号通路的持续激活将会导致肿瘤细胞的异常增殖、转移、侵袭、并抑制肿瘤细胞凋亡[16]。我们通过Western blot实验可以发现BRU处理能降低磷酸化PI3K与Akt的蛋白质水平,这表明BRU能阻止PI3K/Akt信号通路的激活。Bcl-2家族调控着细胞的凋亡,Bcl-2与Bax作为重要的抗凋亡和促凋亡蛋白,肿瘤细胞可以通过上调Bcl-2或下调Bax的蛋白质表达水平来阻止细胞色素C的释放,从而抑制胱天蛋白酶家族蛋白(caspase)的活化,最终导致肿瘤细胞逃避死亡[17]。我们同样发现,BRU处理能降低抗凋亡蛋白Bcl-2的蛋白质水平,并增加促凋亡蛋白Bax与cleved-caspase-3的蛋白质表达水平。研究已经证实,PI3K/Akt通路的激活可诱导抗凋亡蛋白Bcl-2表达,并抑制Bax、caspase-3等凋亡蛋白的激活,同时,PI3K/Akt信号级联是NF-κB上游的主要成分[18]。因此我们有理由相信,BRU通过抑制PI3K与磷酸化Akt的水平来抑制PI3K/Akt信号通路的激活,阻止其下游分子p65的核转运,上调Gadd45α的蛋白质水平,从而抑制细胞的增殖;并同时通过降低抗凋亡蛋白Bcl-xL与Bcl-2,增加促凋亡蛋白Bax与cleved-caspase-3的蛋白质表达水平来协同诱导细胞凋亡。
综上所述,BRU能够有效抑制H1299非小细胞肺癌细胞的增殖并诱导其凋亡,其机制可能与抑制PI3K/Akt信号通路的激活并抑制p65的核转运有关。本研究后续还需继续深入探究两个问题,一是BRU通过什么方式作用于PI3K/Akt信号通路,二是BRU作为一种被大量研究证实的Nrf2抑制剂,在非小细胞肺癌中Nrf2与PI3K/Akt通路可能存在某种关联。BRU作为一种潜在的抗癌药物,在未来可能会展现出更广泛的应用前景,本研究可为后来研究人员提供部分参考价值。

