黄连素对HSV-1病毒感染HEp-2细胞的活性影响及分子机制
崔玉娟,胡丹东,杨颖丽,张 继
(1.北京市延庆区疾病预防控制中心,北京 102100;2.西北师范大学生命科学学院,甘肃 兰州 730070;3.北京市延庆区市场监管检验检测监控中心,北京 102100)
单纯疱疹病毒(herpes simplex virus,HSV)是疱疹病毒中最典型的代表,具有高度的传染性。HSV通常通过黏膜、皮肤、神经组织和其他相关病变感染身体,它可分为HSV-1和HSV-2两种血清型,其中HSV-1的占比超过了约80%。感染HSV-1主要会导致咽炎、唇疱疹和角膜炎,严重者会引起散发性脑炎等危险疾病,HSV-2主要通过受损的皮肤黏膜侵入引起生殖器疱疹[1]。HSV-1感染宿主细胞后,即刻早期基因(α基因)、早期基因(β基因)和晚期基因(γ基因)开始表达[2]。感染细胞蛋白(ICP4)表达在感染后2~4 h达到峰值,激活β基因的表达;ICP8和ICP27调控病毒DNA复制并参与γ基因转录;糖蛋白D(gD)是γ基因编码的晚期蛋白,在感染后12~15 h达到峰值,是病毒包膜的主要成分,有助于病毒吸收进入宿主细胞,所有这些指标均可用于评估HSV-1的活性[3-4]。
黄连素(berberine,BE)是一种原小檗碱类生物碱,存在于小檗科、毛茛科等多种植物科中[5]。BE具有多种药用功效,包括抗炎、抗菌和抗真菌活性,同时作用于一系列信号通路以改善多种疾病[6-7]。多项体外研究发现,BE可以抑制癌细胞的增殖、迁移和转移并诱导细胞凋亡[8-10],通过增加一些相关信号(如 JNK/p38信号分子)来促进细胞凋亡,积累的信号分子可以激活JNK/p38通路,下调抗凋亡蛋白Bcl-XL,导致细胞色素C的释放和半胱天冬酶的激活[11]。近年来,BE被发现对多种病毒具有抗病毒作用,包括甲型流感病毒[12]、呼吸道合胞病毒[13]、基孔肯雅病毒[14]、肠道病毒71[15]等常见病毒。然而,其在HSV-1中的作用和抗病毒分子机制感染情况还需要进一步研究探讨。
本研究旨在探索BE对HSV-1感染的HEp-2细胞的抗病毒作用机制。分子机制通过对gD、ICP4、ICP5、ICP8、LncRNA NRAV、miR-299-3p、RAB5C、PI3K、AKT、JNK、p38转录或翻译水平的变化进行评估。结果表明BE能剂量依赖性地提升HSV-1感染后HEp-2细胞的活性,并抑制其凋亡;还可以剂量依赖性地抑制HEp-2细胞中PI3K、AKT、JNK和p38蛋白的表达。
1 材料与方法
1.1 实验材料HSV-1:美国菌种保存中心;HEp-2悬浮培养细胞:上海泊杰医疗科技有限公司;BE(纯度≥98%):南京朗泽生物科技有限公司、RPMI 1640培养基、Cell Counting Kit-8、TBST、5%脱脂牛奶、硝酸纤维素膜:西格玛奥德里奇(上海)贸易有限公司、HSV-1病毒核酸抽提试剂盒:上海烜雅生物科技有限公司;BCA试剂盒:南京艾思易生物科技有限公司;SYBR green PCR预混液、RIPA裂解液、扩增试剂盒、TRIzol、Lipofectamine 2000:赛默飞世尔科技(中国)有限公司;单克隆抗体:美国Cell Signaling Technology;lncRNA NRAV、miR-299-3p、RAB5C、lncRNA NRAV short-hairpin RNA、miR-299-3p、RAB5C short-hairpin RNA、NC-lncRNA NRAV、NC-miR-299-3p、NC-RAB5C:湖南普拉特泽生物科技有限公司。
1.2 仪器实时荧光定量PCR仪:赛默飞世尔科技(中国)有限公司;TaqMan探针:德国Applied Biosystems;PCR系统StepOnePlus:德国Applied Biosystems;酶标仪:赛默飞世尔科技(中国)有限公司;流式细胞分析仪:美国贝克曼库尔特有限公司。
1.3 方法
1.3.1细胞系培养和分组 HEp-2使用含10%胎牛血清、1%青霉素、1%链霉素的RPMI 1640培养基在37 ℃、5% CO2环境中常规培养。取对数生长期HEp-2按照1×105/孔接种于6孔板中。随机分为对照组(Control组):细胞未经处理;感染组(HSV-1组):细胞感染相应量的HSV-1;低浓度组(5 μmol·L-1-BE组):细胞感染相应量的HSV-1和5 μmol·L-1的BE溶液20 μL;中浓度组(10 μmol·L-1-BE组)细胞感染相应量的HSV-1和10 μmol·L-1的BE溶液20 μL;高浓度组(15 μmol·L-1-BE组):细胞感染相应量的HSV-1和15 μmol·L-1的BE溶液20 μL。随后继续在在37 ℃、5% CO2环境中培养24 h。
1.3.2细胞转染 细胞在60 mm培养皿中以3.0×105个/皿的密度培养24 h。然后,使用Lipofectamine 2000转染试剂将相关质粒或者序列3 μg转染至HEp-2中,培养48 h。随后按照上述操作进行BE干预与HSV-1感染。
1.3.3信号通路干预处理 使用PI3K/AKT信号通路特异性抑制剂LY294002与JNK/p38 MAPK信号通路激动剂Anisomycin对HEp-2预处理24 h,随后按照上述操作进行BE干预与HSV-1感染。
1.3.4细胞活性检测 在对数生长期收获细胞并用于制备单细胞悬液,细胞用结晶紫染色,调整细胞密度并将细胞以4×103/孔的密度转移到96孔板中。细胞在正常条件下(37 ℃,5% CO2)培养,在24 h时按适当顺序加入10 μL CCK-8溶液,孵育48 h后,使用酶标仪测量光密度值(450 nm)。
1.3.5qRT-PCR检测 取各组细胞,加入TRIzol 400~600 μL,充分搅拌至浆液状,并移至EP管中,加入剩余TRIzol,终体积1 mL。冰上孵育5 min,离心(12 000 r·min-1,4 ℃)5 min取得上清液,按照逆转录试剂盒说明书将提取到的总RNA逆转录为cDNA,通过实时荧光定量PCR仪进行qRT-PCR实验,用2-ΔΔCT法计算各组细胞中的gD、ICP-4、ICP-8、ICP-27、LncRNA NRAV、miR-299-3p、RAB5C的mRNA相对表达量,反应体系:4×One step miRNA RT Solution,10×正、反引物序列,RNase Free H2O。反应步骤:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共40个循环。特异性引物序列如Tab 1所示。
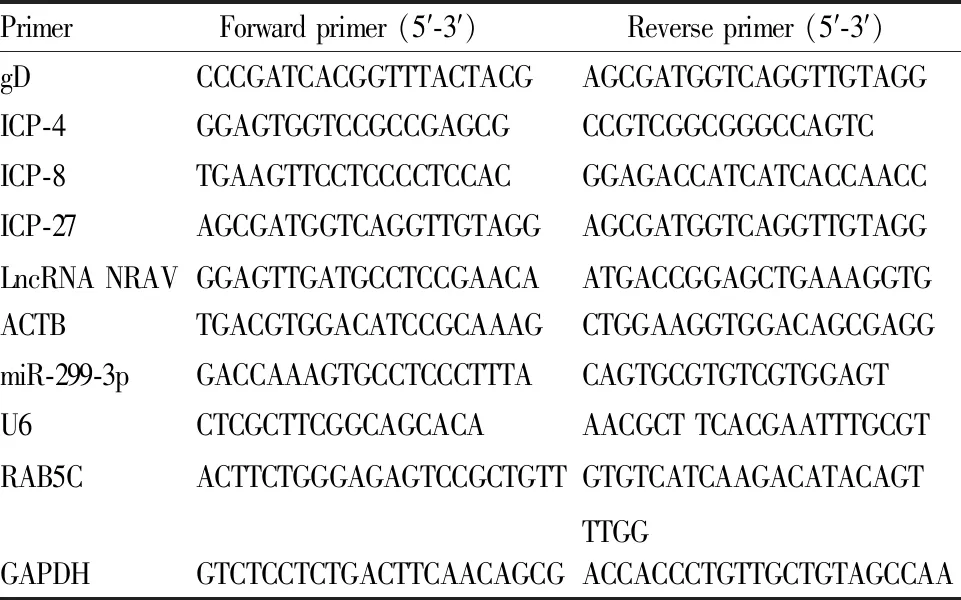
Tab 1 The specific primer sequence
1.3.6Western blot分析 在含有蛋白酶抑制剂的 RIPA缓冲液中收获HEp-2细胞。裂解液离心(12 000 r·min-1,4 ℃)15 min后除去不溶性细胞部分,并使用BCA试剂盒测量蛋白质浓度。通过12%SDS-PAGE电泳从每个样品中分离出等量的蛋白质(20 μg)并转移到NC膜。将NC膜与在含有0.05% Tween-20的TBST缓冲盐溶液和含5%脱脂牛奶在室温孵育2 h封闭。然后将NC膜与一级和二级HRP偶联抗体在4 ℃下孵育过夜。通过增强的化学发光使膜可视化,并测量和量化条带强度。
1.3.7细胞凋亡能力检测 对数生长期细胞置于DMEM+10%胎牛血清(FBS)中培养,将细胞以5×105/孔的密度接种到6孔板上并生长24 h。然后将细胞用无血清培养基饥饿24 h,然后进行转染。48 h后,收集细胞,用冷的PBS洗涤两次,并在冷的70%乙醇中在4 ℃下固定过夜。在PBS中再水化15 min后,将细胞在黑暗中用碘化丙啶(propidium iodide,PI)溶液染色30 min。此外,根据制造商的说明,用膜联蛋白(Annexin)-VFITC和PI对细胞进行染色,通过流式细胞术分析细胞凋亡率。

2 结果
2.1 黄连素对HEp-2细胞中HSV-1活性的影响为评估BE对HEp-2细胞中HSV-1的活性影响,采用qRT-PCR检测HEp-2细胞中HSV-1感染相关基因(包括gD、ICP-4、ICP-8 和ICP-27)的mRNA表达情况。如Fig 1所示,与对照组比较,HSV-1感染组及不同浓度BE组gD、ICP-4、ICP-8和ICP-27的mRNA表达水平均升高(P<0.01)。与感染组比较,各BE浓度组gD、ICP-4、ICP-8和ICP-27的mRNA表达水平均被抑制,但仍高于对照组(P<0.05),且均随BE浓度的升高呈浓度依耐性降低,其中高浓度组(15 μmol·L-1)抑制最明显(P<0.05)。实验结果表明,BE可以降低感染HSV-1的HEp-2的病毒活性。
2.2 黄连素对HSV-1感染的HEp-2细胞生物学行为的影响细胞活性与凋亡率可以直观反映细胞的生物学行为,为了验证BE对HSV-1感染的HEp-2细胞的影响,采用CCK-8与流式细胞计数检测细胞的活性与凋亡率。如Fig 2所示,HSV-1感染组活性为5组中最低,而凋亡率最高(P<0.05),对照组活性为5组中最高,凋亡率最低(P<0.05);与HSV-1感染组比较,低、中、高浓度BE组随浓度升高细胞活性随之升高,而凋亡率也随之降低,且都呈浓度依耐性变化(P<0.05)。上述结果表明,BE可以抑制HSV-1感染的HEp-2的凋亡,提升其活性。

Fig 1 BE affects HSV-1 activity in HEp-2 cells

Fig 2 BE affects biological behavior of HSV-1 infected HEp-2 cells
2.3 黄连素对HSV-1感染HEp-2细胞分子途径分析采用qRT-PCR检测HEp-2细胞中LncRNA NRAV、miR-299-3p、RAB5C mRNA的表达水平,验证BE影响HSV-1感染的HEp-2细胞分子途径。结果如Fig 3所示,对照组LncRNA NRAV与RAB5C mRNA为5组中最低,miR-299-3p为最高,与对照组比较,HSV-1感染细胞后LncRNA NRAV与RAB5C mRNA表达明显增加,而miR-299-3pmRNA表达明显降低(P<0.01)。而BE干预的3组细胞中,高浓度BE组LncRNA NRAV与RAB5C mRNA最低,其次为中浓度BE组、低浓度BE组(P<0.05),miR-299-3p则与之相反(P<0.05)。由此可知,BE可能通过抑制LncRNA NRAV与RAB5C,促进miR-299-3p影响HSV-1的对HEp-2的感染能力。
2.4 LncRNA NRAV、miR-299-3p、RAB5C对感染HSV-1的HEp-2细胞的影响进一步研究分子途径,使用CCK-8与流式细胞计数检测转染lncRNA NRAV高表达pcDNA3.1质粒(pcDNA3.1-NRAV)、lncRNA NRAV short-hairpin RNA质粒(sh-lncRNA NRAV)以及阴性对照NC-lncRNA NRAV的HEp-2细胞,RAB5C高表达pcDNA3.1质粒(pcDNA3.1-RAB5C)、RAB5C short-hairpin RNA质粒(sh-RAB5C)以及阴性对照NC-RAB5C的HEp-2细胞,以及miR-299-3p模拟物序列(mimics-miR-299-3p)、miR-299-3p抑制物序列(inhibition-miR-299-3p)、阴性对照NC-miR-299-3p的HEp-2细胞。如Fig 4A、B、C所示,升高LncRNA NRAV、RAB5C可以抑制感染HSV-1的HEp-2的活性,并促进其凋亡;抑制miR-299-3p可以抑制感染HSV-1的HEp-2的活性,并促进其凋亡,证实了上述实验结果。

Fig 3 BE affects molecular pathways of HSV-1 infection of HEp-2 cells

Fig 4 LncRNA NRAV,miR-299-3p,RAB5C affect HEp-2 cells infected with
2.5 黄连素对HSV-1感染HEp-2细胞PI3K/AKT信号通路的影响为了进一步研究BE影响HSV-1感染HEp-2细胞信号通路的分子机制,Western blot检测HEp-2细胞中PI3K/AKT信号通路相关蛋白表达。如Fig 5A所示,与对照组相比,HSV-1的感染上调了细胞中PI3K、AKT蛋白的表达水平(P<0.01),与HSV-1组相比,BE干预的3组细胞中PI3K、AKT蛋白表达均随浓度的升高呈浓度依耐性下降(P<0.05)。使用CCK-8与流式细胞计数检测使用PI3K/AKT信号通路特异性抑制剂LY294002干预以及无干预的HEp-2细胞,并感染HSV-1,如Fig 5B、C、D所示,LY294002组细胞活性高于无干预组,凋亡率则低于无干预组(P<0.05)。结果表明,BE可能通过抑制PI3K/AKT信号通路的激活影响HSV-1对HEp-2的感染能力。
2.6 黄连素对HSV-1感染HEp-2细胞JNK/p38 MAPK信号通路的影响同样的方法验证对JNK/p38 MAPK信号通路的影响。如Fig 6A所示,HSV-1的感染上调了细胞中JNK、p38蛋白的表达水平(P<0.01),给予BE后,JNK、p38蛋白表达水平随浓度的升高呈浓度依耐性下降(P<0.05)。如Fig 6B、C、D所示,JNK/p38 MAPK信号通路激动剂Anisomycin,细胞活性低于无干预组,凋亡率高于无干预组(P<0.05)。结果表明,BE可能通过抑制JNK/p38 MAPK信号通路的激活影响HSV-1对HEp-2的感染能力。
3 讨论
据世卫组织报告,90%的人口感染了不同类型的疱疹病毒,这些病毒会潜伏或引起口腔和生殖器疱疹、结膜炎、疱疹湿疹和脑炎等疾病,寻找治疗HSV-1的候选药物很重要。黄连素对多种细胞具有细胞毒性,是在寻找HSV-1治疗候选药物时必须考虑的一个因素。在之前的体外研究表明,黄连素对HSV-1感染的细胞具有剂量依赖性的抗病毒作用,而对正常细胞低毒性[16],是一种相对安全有效的体外抑制HSV-1病毒的候选药物。据报道JNK/p38 MAPK信号通路的激活在HSV-1成功感染中发挥了重要作用[17];BE联合人参皂苷Rg3可通过PI3K/Akt信号通路发挥抑制鼻咽癌细胞增殖和诱导细胞凋亡的作用[18]。在本次研究中,首先,对HEp-2细胞中HSV-1的相关基因进行了检测,HSV-1感染组与对照组比较,HSV-1相关基因gD、ICP-4、ICP-8和ICP-27表达均升高,说明HSV-1处于明显的激活状态,而BE的干预使gD、ICP-4、ICP-8和ICP-27表达均降低,并与浓度呈负相关,提示我们HSV-1的活性随着BE浓度的升高受到了更多抑制。接着,细胞生物学行为检测结果表明,在HSV-1的感染下,HEp-2的活性降低,凋亡率升高,说明HSV-1通过促进感染宿主细胞加速凋亡,BE的干预有效的抑制了凋亡加速,并改善细胞的活性。随后,检测了LncRNA NRAV、miR-299-3p与RAB5C的表达情况,发现在HSV-1中LncRNA NRAV、RAB5C均升高,而miR-299-3p则降低,提示三者可能参与了HSV-1感染的发病进程,通过BE的干预,LncRNA NRAV、RAB5C则降低,而miR-299-3p升高;同时检测转染相关质粒的HEp-2细胞,升高LncRNA NRAV、RAB5C可以抑制感染HSV-1的HEp-2的活性,并促进其凋亡,抑制miR-299-3p可以抑制感染HSV-1的HEp-2的活性,并促进其凋亡,结果证实了三者间存在靶向调控关系。最后,研究结果显示,PI3K/AKT信号通路和JNK/p38 MAPK信号通路在HSV-1感染后被激活,在BE干预后,其通路蛋白的表达也得到了抑制;进一步通过信号通路抑制剂和激动剂来验证通路在整个过程中的作用,抑制剂降低了细胞的凋亡,而激动剂则促进了细胞的凋亡,结果表明BE可能通过抑制信号通路的激活影响HSV-1的感染能力。

Fig 5 BE affects PI3K/AKT signaling pathway of HSV-1 infected HEp-2 cells

Fig 6 BE affects JNK/p38 MAPK signaling pathway of HSV-1 infected HEp-2 cells
综上所述,本研究结果表明,HEp-2细胞在HSV-1感染的状态下,高表达的LncRNA NRAV、RAB5C靶向竞争低表达的miR-299-3p,并通过激活PI3K/AKT信号通路和JNK/p38 MAPK信号通路引起了细胞的加速凋亡,使用BE则抑制了细胞中HSV-1的活性,同时干预了上述分子途径的转导,从而改善了HEp-2细胞的活性,并降低其凋亡。

