贯叶金丝桃提取物对缺氧大鼠高原脑水肿的改善作用
任晓霞,马君义,郑一丹,王 芃,阳志强,3,李茂星
(1.西北师范大学生命科学学院,甘肃 兰州 730070;2.联勤保障部队第九四〇医院临床药学科,甘肃 兰州 730050;3.西北民族大学化工学院,甘肃 兰州 730030)
高海拔和高山覆盖了地球表面积的五分之一。随着科技进步和社会发展,越来越多的人进入高海拔地区[1]。高海拔地区具有低压缺氧、低温低湿和强紫外线辐射等特点。其中,低压缺氧影响最大[2]。当长期处于低海拔地区的人们进入到高海拔地区时,有氧运动能力降低,组织氧化还原平衡发生紊乱,血脑屏障通透性增高,进而诱发高原脑水肿(high altitude cerebral edema,HACE)。HACE是急性高原病的终末期,严重时可导致死亡[3]。目前,HACE的发病机制仍不清楚,导致预防和治疗HACE的方法受到限制。越来越多的研究表明,氧化应激和炎症反应在高原相关疾病中起着至关重要的作用[4-5]。
贯叶金丝桃(HypericumperforatumL.)属藤黄科金丝桃属多年生草本植物,又称贯叶连翘,欧洲称其为圣·约翰草(St John′s wort),主要分布于我国河北、陕西、甘肃、山东、江苏、新疆、四川等地。贯叶金丝桃具有抗抑郁、抗菌、抗炎、抗病毒、抗肿瘤、抗缺氧和促进伤口愈合等药理学作用,现已被中医典籍及许多国家的药典收录,成为欧洲治疗抑郁症和东亚治疗炎症的首选药物之一[6-7]。杨柳[8]通过测定大鼠血清中过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase)活性以及丙二醛(malondialdehyde,MDA)含量,表明贯叶金丝桃具有明显的抗氧化能力。Gioti等[9]发现贯叶金丝桃黄酮类化合物的抗氧化机制可能与金属螯合、自由基清除和活性氧淬灭等相关。黄酮类化合物金丝桃苷(hyperoside,HYP)、萘骈二蒽酮类化合物金丝桃素(hypericin)和间苯三酚类化合物贯叶金丝桃素(hyperforin)作为该植物的活性成分经常被用作质量评价指标[10]。国内对贯叶金丝桃的研究主要集中在活性成分的提取和分离,在药理活性及其作用机制方面研究报道甚少。贯叶金丝桃预防和治疗HACE的作用及其抗缺氧活性是否与炎症相关信号通路有关尚无报道。本研究采用大型低压氧舱模拟海拔7 500 m的高原缺氧环境,建立缺氧大鼠HACE模型,通过对缺氧大鼠脑组织中氧化应激与炎症因子相关指标的检测探讨贯叶金丝桃提取物(Hypericumperforatumextract,HPE)对缺氧大鼠HACE的改善作用。
1 材料与方法
1.1 实验动物SPF级,Wistar健康♂大鼠80只,体质量(180~220)g,由联勤保障部队第九四〇医院动物实验科提供,生产许可证号为SCXK(军)2017-0023。动物饲养于联勤保障部队第九四〇医院动物实验科,使用许可证号为SYXK(军)2017-0047。饲养期间大鼠于室温下自由摄食进水,实验程序经联勤保障部队第九四〇医院动物伦理委员会批准后进行,审批编号为2020KYLL064。
1.2 药物与试剂贯叶金丝桃由甘肃省康县福祥中药材种植农民专业合作社提供,经联勤保障部队第九四〇医院李茂星主任药师鉴定为藤黄科贯叶金丝桃干燥地上部分;D101型大孔吸附树脂(天津海光,批号:160305);地塞米松片(dexamethasone,DXM,浙江仙琚制药,批号:200402);羧甲基纤维素钠(carboxymethyl cellulose sodium,CMC-Na,国药集团,批号:20180412);HYP(纯度>98%,江苏永健,批号:CX0012);MDA(批号:A003-1-1)、过氧化氢(hydrogen peroxide,H2O2,批号:A064-1-1)、总超氧化物歧化酶(total superoxide dismutase,T-SOD,批号:A001-1-2)、还原型谷胱甘肽(glutathione,GSH,批号:A006-1-1)和CAT(批号:A007-1-1)测定试剂盒均购自南京建成;BCA蛋白浓度测定试剂盒(批号:20200602)、大鼠白介素-1β(interleukin-1β,IL-1β,批号:SEKR-0002)、白介素-6(interleukin-6,IL-6,批号:SEKR-0005)、血管内皮生长因子(vascular endothelial growth factor,VEGF,批号:SEKR-0032)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α,批号:SEKR-0009)测定试剂盒均购自北京索莱宝。其他试剂均为国产分析纯。
1.3 实验仪器多功能动态热回流提取浓缩机(上海矩源,JYT-50LN);可调旋转蒸发仪(上海亚荣,RE-52A);冷冻干燥机(西班牙,Telster LyoQuest-55 plus);模拟高原低压低氧动物实验舱群(贵州风雷航空军械,DYC-9070);全自动样品快速研磨仪(上海净信,Tissuelyser-24);制冰机(意大利斯科茨曼,AF-80);Sigma 3K15高速冷冻离心机(德国Sigma,3K15);全自动荧光酶标仪(美国Molecular,SpectraMax®i3);水平摇床振荡器(上海旌派,TYZD-BS);正置显微镜(甘肃嘉瑞,BX40)。
1.4 方法
1.4.1贯叶金丝桃提取物的制备 将干燥的贯叶金丝桃地上部分粉碎(3 kg),分别加10、8、8倍量70%乙醇于65 ℃回流提取3次,每次1 h,静置,抽滤,合并3次滤液,减压浓缩得质量浓度为49.11 g·L-1的上样液。然后按样品与树脂的质量比为1 ∶15(g/g)上样,上样液缓慢、匀速地注入预先处理好的D101型大孔吸附树脂柱(9.55 cm × 85 cm)中,以2.4 mL·min-1流速吸附26 h,分别用20%、95%乙醇以2.0 BV·h-1的流速洗脱至流出液为无色。收集95%乙醇洗脱液,40 ℃旋转蒸发,浓缩液经冷冻干燥后加入75倍量的乙酸乙酯,磁力搅拌下50 ℃加热回流提取3次,每次1 h,静置,抽滤,收集滤液,浓缩并冷冻干燥。将干燥后的药粉再加入14倍量的乙酸乙酯,4 ℃静置,滤纸过滤,滤饼干燥后得HPE,参照文献[11]分析方法测得HYP含量为470.10 mg·g-1,金丝桃素含量为17.00 mg·g-1。整个提取分离过程避光操作。
1.4.2动物分组 将80只SPF级Wistar雄性健康大鼠随机分为常压常氧组(normal pressure and normoxia group,NG),低压缺氧组(hypobaric and hypoxia group,HG),贯叶金丝桃提取物低、中、高剂量组(HPE-L、HPE-M、HPE-H,100、200、400 mg·kg-1),金丝桃苷低、高剂量组(HYP-L、HYP-H,50、100 mg·kg-1)和DXM(4 mg·kg-1)等8组,每组10只。灌胃用药均用质量分数为0.5%的CMC-Na助溶,NG和HG灌胃10 mL·kg-1相同质量分数的CMC-Na。所用大鼠在动物实验科饲养适应3 d后开始实验。大鼠标记用质量分数为5%的苦味酸皮毛染色。
1.4.3大鼠高原脑水肿模型的建立 模拟高原低压缺氧动物实验舱群主要由控制系统、实验舱和模拟舱三部分组成。实验舱和模拟舱以及实验舱和外界环境都有独立的舱门相隔。当舱门打开时,两环境下的海拔高度一致;当实验舱和模拟舱舱门关闭时,可单独模拟任一海拔高度的高原低压缺氧环境。8组大鼠按相应剂量连续灌胃给药7 d。d 4时,除NG外,剩余7组均置于模拟海拔7 500 m的高原环境(舱内压力:35.9 kPa,氧分压:8.0 kPa)。实验者每天上午8 ∶30进入实验舱并以2 m·s-1匀速上升至海拔高度4 000 m,同时模拟舱以10 m·s-1匀速下降至海拔高度为4 000 m,当两舱体稳定后(舱内压力:62.1 kPa;氧分压:13.8 kPa),实验者进入模拟舱,进行灌胃给药。每次给药后,实验舱以2 m·s-1匀速下降至兰州海拔高度,模拟舱以10 m·s-1匀速升至7 500 m。期间,动物自由进食摄水,同时观察大鼠生存状态,在该环境下连续缺氧暴露72 h,并于末次给药1 h后进行样本取材。
1.4.4样本取材[5]缺氧暴露72 h结束后,断头处死大鼠,小心打开颅腔,摘取完整大脑组织并沿脑中线将大脑分为左脑和右脑两部分,左脑上半部分组织用于脑含水量的测定,左脑下半部分组织-20 ℃保存并用于其他指标的测定。右脑组织浸泡于质量分数为4%的多聚甲醛溶液中,用于HE染色。NG大鼠同一时间按上述方法在常氧条件下取材。
1.4.5大鼠脑组织含水量的测定 样本取材过程中,将分离出的左脑上半部分组织置于大小适宜的称量纸中,即刻通过传递窗交至实验人员称量湿重后,放入55 ℃电热恒温鼓风干燥箱,直至干重称量误差在0.2 mg内上下波动,再根据干湿比重法计算大鼠脑组织的含水量。
含水量/%=(湿重-干重)/湿重×100%。
1.4.6大鼠脑组织病理切片的制备和观察 将完整大鼠右脑组织浸泡于质量分数为4%的多聚甲醛溶液中室温充分展开固定。组织固定好后,进一步包埋,切片,苏木精-伊红染色(hematoxylin-eosin staining,HE),并于正置显微镜下,放大200倍,观察脑组织的病理学变化。
1.4.7大鼠脑组织氧化应激指标的测定 取-20 ℃保存的大鼠左脑下半部分组织适量,加入9倍体积的预冷生理盐水,用研磨仪充分匀浆,制成质量分数为10%脑组织匀浆,并于4 ℃下4 000 r·min-1离心15 min,BCA法测定脑组织匀浆液中蛋白质含量,根据各试剂盒说明书测定脑组织中MDA、GSH和H2O2的含量以及T-SOD和CAT的活力。
1.4.8大鼠脑组织炎症因子的测定 将脑组织同1.4.7项下方法制成质量分数为10%脑组织匀浆,4 ℃ 4 000 r·min-1离心15 min。采用ELISA法,测定标准品和样本的反应孔吸光度(λmax=450 nm),通过绘制标准曲线计算大鼠脑组织中IL-1β、IL-6、VEGF和TNF-α的含量。

2 结果
2.1 高原缺氧大鼠生存状态的观察在模拟大鼠高原低压缺氧过程中,舱内大鼠主要表现为体重减轻,进食摄水急剧减少,自主活动以卧爬为主,行动迟缓,呼吸困难,情绪暴躁,排便减少,粪便呈深黑色干硬状。缺氧期间,各组动物未发现死亡。NG大鼠进食摄水正常,活泼好动,性情温顺,排便正常,粪便呈棕褐色软糯状,未发现异常及死亡情况。
2.2 HPE对HACE大鼠脑组织含水量的影响如Tab 1所示。与NG相比,HG大鼠脑组织含水量明显升高(P<0.01)。与HG相比,HPE-L、HPE-M、HPE-H及DXM能明显降低脑组织含水量(P<0.05或P<0.01),并呈剂量依赖性;HYP-L和HYP-H虽然有降低脑组织含水量的趋势,但差异无统计学意义(P>0.05)。

Tab 1 Effects of HPE on brain water content in HACE rats
2.3 HPE对HACE大鼠脑组织病理变化的影响大鼠脑组织病理学切片如Fig 1所示。NG大鼠海马组织细胞排列整齐、结构清晰完整,细胞核明显,未出现胞体内大空泡样变。与NG相比,HG大鼠脑组织细胞排列紊乱,出现明显的细胞核质间隙增大(绿色箭头),细胞核固缩浓染(黄色箭头),炎性细胞浸润(蓝色箭头),神经元脱失,胞体内大空泡形成(黑色箭头,可能为内质网的高度扩张与融合),大脑皮质及边缘系统的神经组织因大量神经元内大空泡形成及坏死,呈海绵状变性改变。HPE、HYP及DXM药物干预后,脑组织病理结构得到一定程度的改善,细胞结构趋于正常,核浓染减轻(黄色箭头),神经元完整清晰,细胞空泡样变减少(黑色箭头),炎症反应缓解(蓝色箭头)。其中,HPE-M、HPE-H、HYP-H及DXM与HG相比得到了明显改善。
2.4 HPE对HACE大鼠脑组织氧化应激指标的影响大鼠脑组织中氧化应激指标测定结果如Tab 2和Fig 2所示。与NG相比,HG大鼠脑组织匀浆液中MDA和H2O2含量明显升高(P<0.01),T-SOD活力、GSH含量和CAT活力明显降低(P<0.01)。给予药物干预后,与HG相比,HPE-M、HPE-H和HYP-L大鼠脑组织中MDA含量明显降低(P<0.01或P<0.05);HPE-M、HPE-H、HYP-L、HYP-H和DXM大鼠脑组织中T-SOD活力和CAT活力明显升高(P<0.01或P<0.05)。另外,与HG相比,HPE-H大鼠脑组织中H2O2含量降低、GSH含量升高(P<0.05);其余给药组也有降低或升高趋势,但差异无统计学意义(P>0.05)。
2.5 HPE对HACE大鼠脑组织炎症因子的影响ELISA检测大鼠脑组织中炎症因子的结果如Tab 3和Fig 3所示。与NG相比,HG大鼠脑组织匀浆液中IL-1β、IL-6、VEGF和TNF-α的含量明显升高(P<0.01)。与HG相比,HPE-H、HYP-L和HYP-H能明显降低HACE大鼠脑组织匀浆液中IL-1β、IL-6、VEGF和TNF-α的含量(P<0.01或P<0.05);HPE-M能明显降低IL-1β、IL-6和VEGF的含量(P<0.01或P<0.05);DXM能明显降低IL-1β、VEGF和TNF-α的含量(P<0.01或P<0.05);HPE-L虽有降低HACE大鼠脑组织中炎症因子含量的趋势,但差异无统计学意义(P>0.05)。

Fig 1 Histopathological changes of brain tissues in rats (×200)A:NG;B:HG;C:HPE-L;D:HPE-M;E:HPE-H;F:HYP-L;G:HYP-H;H:DXM

Tab 2 Effects of HPE on brain oxidative stress index in hypoxic rats

Fig 2 Effects of HPE on brain oxidative stress in hypoxic rats
3 讨论
HACE常发生在快速上升到高海拔地区的人身上,其易感性和发展与炎症有关。本研究在建立缺氧大鼠HACE模型的基础上,通过大鼠脑组织含水量的测定、脑组织病理变化的观察以及脑组织氧化应激和炎症因子相关指标的测定,探讨HPE对缺氧大鼠HACE的改善作用。研究结果表明,与HG相比,给予HPE与HYP药物干预后,给药组大鼠脑组织含水量下降,同时脑组织病理学损伤减轻,炎性因子浸润减少,说明HPE能有效改善HACE,保护大鼠脑组织免受氧化应激和炎症因子的损害,维持机体健康。

Tab 3 Effects of HPE on brain tissue inflammatory factors in hypoxic rats

Fig 3 Effects of HPE on brain tissue inflammatory factors in hypoxic rats
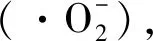
炎性细胞因子IL-1β、IL-6、TNF-α和VEGF在炎症的发生中起着至关重要的作用。IL-1β、IL-6和TNF-α细胞因子由单核细胞、巨噬细胞、淋巴细胞、成纤维细胞和内皮细胞产生,它们在免疫过程中介导细胞间的相互作用、急性期反应和造血。其中,IL-6是一种多功能细胞因子,可诱导免疫细胞增殖和分化,在调节体内复杂的免疫网络中起中心作用,可通过诱导和激活体内各种免疫细胞而导致长期慢性炎症[14]。IL-1β是IL-1的一种亚型,具有广泛的免疫调节作用,可致热和介导炎症[15]。VEGF是一种血小板源性生长因子,由许多细胞和组织在缺氧反应中产生,它具有促进血管通透性增加,血管内皮细胞迁移,细胞外基质变性等作用。缺氧和细胞因子IL-1、IL-6、IL-8和TNF-α等均可诱导VEGF的表达[16]。TNF-α是一种在慢性炎症中有致病作用的脂肪细胞因子,其在体内外均可直接杀伤肿瘤细胞,当血糖水平升高时脂肪组织就会分泌TNF-α,TNF-α的升高可以促进T细胞产生各种炎症因子,进而诱发炎症反应[17]。在此基础上,我们检测了7 500 m高原缺氧模拟环境下大鼠脑组织内炎症因子IL-1β、IL-6、VEGF和TNF-α的变化。结果表明,与NG相比,HG大鼠脑组织中IL-1β、IL-6、TNF-α和VEGF的含量明显升高,这可能是因为氧化应激诱导炎症反应的发生,促使大鼠脑组织内促炎因子的水平上升,同时,炎症因子的增加也可能刺激自由基的产生,调节氧化应激相关通路。HPE与HYP药物干预后,与HG相比,脑组织中IL-1β、IL-6、TNF-α和VEGF含量均有不同程度的下降,说明HPE可以通过降低组织中炎症因子的水平来发挥抗炎活性,从而缓解氧化应激引起的炎症损伤,调节大鼠脑组织适应缺氧环境。因此,贯叶金丝桃有望开发成为治疗HACE的药物制剂,其具体机制还有待进一步研究。

