基于RNA-Seq探讨玉竹多糖对D-半乳糖诱导衰老小鼠的保护作用
何超平 彭莎 陈博威 李力松 廖端芳




〔摘要〕 目的 探討玉竹多糖对D-半乳糖诱导衰老小鼠认知功能保护作用的分子机制。方法 采用水提醇沉法提取玉竹总多糖组分并进行含量测定;将30只昆明小鼠随机分为正常组、模型组、玉竹多糖组(2 g/kg)。模型组及玉竹多糖组小鼠每日皮下注射D-半乳糖(150 mg/kg),正常组及模型组每日灌胃等体积生理盐水,同时玉竹多糖组小鼠灌胃等体积相应剂量的药物。给药8周后处死老鼠并收集海马组织,使用RNA测序(RNA-Seq)分析各组间差异表达的mRNAs,筛选玉竹多糖干预后表达逆转的mRNAs。通过基因本体分析及京都基因与基因组百科全书通路富集分析差异基因参与的主要生物学过程,实时荧光定量PCR(real-time quantitative PCR, RT-qPCR)验证测序结果。结果 玉竹多糖提取率为7.12%,含量为81.27%±0.02%。RNA-Seq分析显示玉竹多糖逆转了衰老小鼠海马组织19个mRNAs的表达,生物信息学分析显示这些基因可能通过各类代谢、血管内皮生长因子信号通路及过氧化物酶体增殖物激活受体信号通路发挥治疗作用,RT-qPCR验证了RNA-Seq结果中差异基因的准确性。结论 玉竹多糖可通过多条信号通路来保护D-半乳糖诱导的衰老小鼠的认知功能。
〔关键词〕 玉竹多糖;衰老;RNA-Seq;认知障碍;D-半乳糖
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.03.004
〔Abstract〕 Objective To explore the molecular mechanism of Polygonatum odoratum polysaccharide on the cognitive function of D-galactose-induced aging mice. Methods The total polysaccharides of Polygonatum odoratum were extracted by water alcohol precipitation method and the content was determined. 30 KM mice were randomly divided into normal group, model group, and Polygonatum odoratum polysaccharide group. (2 g/kg). Mice in the model group and Polygonatum odoratum polysaccharide group were injected subcutaneously with D-galactose (150 mg/kg) daily. At the same time, the normal group and model group were gavaged with equal volume of normal saline daily, and mice in the Polygonatum odoratum polysaccharide group were gavaged with equal volume of corresponding dose. After 8 weeks of administration, the mice were sacrificed and hippocampal tissues were collected. RNA sequencing (RNA-Seq) was used to analyze the differentially expressed mRNAs between the groups, and the mRNAs whose expression was reversed after the intervention of Polygonatum odoratum polysaccharide were screened. Through GO function and KEGG pathway enrichment analysis of the main biological processes involved in differential genes, the sequencing results real-time quantitative PCR (RT-qPCR). Results The extraction rate of Polygonatum odoratum polysaccharide was 7.12%, and the content was 81.27%±0.02%, RNA-Seq analysis showed that Polygonatum odoratum polysaccharide reversed the expression of 19 mRNAs in the hippocampus of aging mice. Bioinformatics analysis showed that these genes may play a therapeutic role through various metabolism, vascular endothelial growth factor signaling pathway and PPAR signaling pathway. RT-qPCR verified the accuracy of RNA-Seq results. Conclusion Polygonatum odoratum polysaccharide may protect the cognitive function of D-galactose-induced aging mice through multiple signaling pathways.
〔Keywords〕 Polygonatum odoratum polysaccharid; aging; RNA-Seq; cognitive impairment; D-galactose
随着人口老龄化的不断加剧,衰老相关疾病发病率也逐渐增高[1]。衰老是机体各组织、器官功能随年龄增长而发生的退行性变化,其中神经退行性病变是指由于神经元进行性变性死亡导致的以大脑为主的中枢神经系统损害的神经系统疾病[2]。与年龄相关的大脑退行性病变是大脑中枢神经系统在生长、发育及成熟之后走向衰老过程中而表现的生物老化的生理现象,其最突出的临床表现是记忆和学习能力下降[3]。目前,如何延缓衰老、改善衰老导致的认知障碍已成为研究热点之一。
玉竹是湖南省道地药材,具有调免疫、降血糖、抗衰老等广泛药理活性[4],可治疗多种疾病,其主要有效成分为玉竹多糖。课题组前期研究已经用行为学结果证实了玉竹多糖改善小鼠认知记忆能力的作用效果,发现玉竹多糖能够抑制D-半乳糖诱导的氧化应激,并降低海马组织中的炎症因子[5]。但既往研究均是基于单一通路或单一靶点,无法系统阐明玉竹多糖改善衰老后认知功能障碍的分子机制。
本实验拟借助RNA-Seq技术,采用D-半乳糖作为致衰剂,建立小鼠亚急性衰老模型,以系统探讨玉竹多糖在生物体内抗衰老及改善认知障碍的分子机制。
1 材料与方法
1.1 药材来源
玉竹来源于湖南省邵东县国家级玉竹规范化种植基地,所有用于实验的玉竹均经湖南中医药大学中药鉴定教研室刘塔斯教授鉴定为百合科玉竹Polygonatum odoratum (Mill.) Druce。
1.2 玉竹多糖的提取与测定
1.2.1 玉竹多糖的提取 取上述玉竹干燥根茎大约1000 g,置70 ℃烘箱中干燥12 h,用粉碎机粉碎,得药材粗粉。加8倍量水,于80 ℃水浴中回流提取2次,每次2 h,趁热过滤,合并2次提取的滤液,并减压浓缩至约20 mL,加4倍量80%乙醇沉淀,离心(r=20 cm,4000 r/min,10 min),沉淀物以无水乙醇、丙酮依次洗涤3次,每次5 mL,合并滤液,得到玉竹总多糖组分,以60 ℃烘干,称质量,计算玉竹总多糖得率,备用。
1.2.2 玉竹多糖脱色、去蛋白 脱色处理:精密称取玉竹总多糖1 g,加适量蒸馏水溶解,定容至50 mL容量瓶中,分别缓慢上AB-8大孔树脂柱,用蒸馏水洗脱,流速1.0 mL/min。取少量洗脱液用Molish反应检测至无紫色环出现或紫色环颜色明显变淡,停止洗脱。收集洗脱液,减压浓缩至200 mL,备用。
木瓜蛋白酶-Sevag法去蛋白:取脱色处理后的玉竹粗多糖洗脱液200 mL,加入0.5%体积的木瓜蛋白酶,搅拌,60 ℃水浴酶解2 h,80 ℃灭酶10 min,放冷,离心20 min,r=20 cm,4000 r/min,弃去沉淀取上清液。将上清液与Sevag试剂(氯仿-正丁醇为4∶1)按4∶1的比例混合振荡20 min,置分液漏斗中静置分层,取上清液,再重复上述操作3次,留上清液测定玉竹多糖浓度。
1.2.3 玉竹多糖含量測定 绘制标准曲线:精密称取无水葡萄糖标准品20.0 mg,加水溶解,并定容于100 mL容量瓶,摇匀,即得浓度为0.200 mg/mL的葡萄糖对照品溶液。精密吸取对照品溶液0.5、1.0、1.5、2.0、2.5、3.0 mL,分别置于10 mL容量瓶中,加水稀释至刻度,摇匀。分别吸取上述不同浓度的对照品溶液,以试剂做空白对照,在490 nm处测定对照品吸光度值,以葡萄糖浓度为横坐标,吸光度为纵坐标绘制标准曲线。按标准曲线项下方法测定样品中玉竹总多糖吸光度,计算玉竹多糖含量。
1.3 主要仪器
Illumina测序平台(美国Illumina公司);9700型PCR仪(美国ABI公司);5418型离心机(德国Eppendorf公司)。
1.4 动物与分组
昆明小鼠30只,雄性,体质量约18~22 g,购于湖南斯莱克景达动物有限公司,动物合格证SCKX(2016-0002),自由饮水饮食。课题组前期研究表明玉竹多糖以每天2 g/kg干预疗效确切[5],因此,本研究采用该剂量进行干预。将动物随机分为3组,每组10只,分别为正常组、模型组及玉竹多糖组,玉竹多糖组及模型组动物分别每天皮下注射D-半乳糖(150 mg/kg)[8],正常组用等量生理盐水代替。同时,玉竹多糖组每天灌胃玉竹多糖,剂量为2 g/kg,正常组与模型组灌胃等体积生理盐水,连续给药8周。
1.5 海马组织取材
小鼠脱颈椎处死后,剪开小鼠的头皮,暴露出头部,用直镊将大脑皮层拨开,暴露出双侧海马组织,将海马组织与大脑皮层及周围的脑组织分开,取出海马组织,置于-80 ℃储存备用。
1.6 RNA-Seq检测
小鼠麻醉后直接断头取脑,冰上操作迅速分离海马组织,放入预先盛满RNA wait液的冻存管中,放入液氮中速冻后按照寄送流程,送至上海派森诺公司进行RNA-Seq检测。采用Trizol法提取总RNA,RNA浓度及质量经检测合格后,进行mRNA纯化、片段化及cDNA合成,建立文库后上机测序。
1.7 基因本体(gene ontology, GO)分析及京都基因与基因组百科全书(Kyoto encyclopedia of genes and
genomes, KEGG)通路富集分析
借助欧易生物云平台富集分析模块(https://cloud.oebiotech.cn/task/),输入差异表达的基因,物种选择为小鼠,进行GO功能及KEGG通路富集分析。GO功能富集分析可描述基因产物可能形式的分子功能、参与的生物过程和所处的细胞环境。KEGG通路富集分析通过将已知的基因组注释信息进行分类,得出最显著的生物学过程。
1.8 实时荧光定量PCR(real-time quantitative PCR, RT-qPCR)验证
将RNA-Seq检测后的剩余样本进行RT-qPCR验证。随机选取了5个差异表达的核心mRNAs。实验过程严格参照试剂盒步骤。海马组织总RNA的提取采用Trizol法提取,琼脂糖凝胶电泳检测RNA完整性后逆转录成cDNA,PCR反应程序:预变性95 ℃,30 s;变性94 ℃,5 s;退火60 ℃,40个循环。溶解曲线反应程序:从60 ℃缓慢升温至97 ℃(20 min)。内参基因选用β-actin,使用2-ΔΔCt法计算基因的相对表达量,各引物序列详见表1。
1.9 统计学分析
采用差异倍数(fold change, FC)≥1.0及P<0.05筛选差异基因。计量资料均以“x±s”进行统计,采用单因素方差分析的统计学方法来比较多组间均数,P<0.05说明差异有统计学意义。运用Graphpad Prism 8作图软件分析并处理。
2 结果
2.1 玉竹多糖含量測定
2.1.1多糖提取率测定 1000 g玉竹根茎按照物料比1﹕5 g/mL,提取时间2 h回流2次,提取温度80 ℃条件下煎煮浓缩醇沉去蛋白,共提取玉竹多糖71.21 g,玉竹多糖提取率为7.12%。
2.1.2 多糖含量测定 (1)标准曲线的绘制:使用苯酚-硫酸法,以无水葡萄糖为对照品,在490 nm波长处测定对照品质量浓度与吸光度的对应关系,制备标准曲线,得y=0.474 8x-0.010 4,R2=0.999 8,线性范围为61.80~100.84 μg/mL。(2)多糖含量测定:按照苯酚-硫酸法测得玉竹多糖含量,根据葡萄糖标准曲线,得到线性回归方程y=0.474 8x-0.010 4,R2=0.999 8,根据公式得到多糖含量为:81.27%±0.02%。
2.2 差异mRNAs的筛选
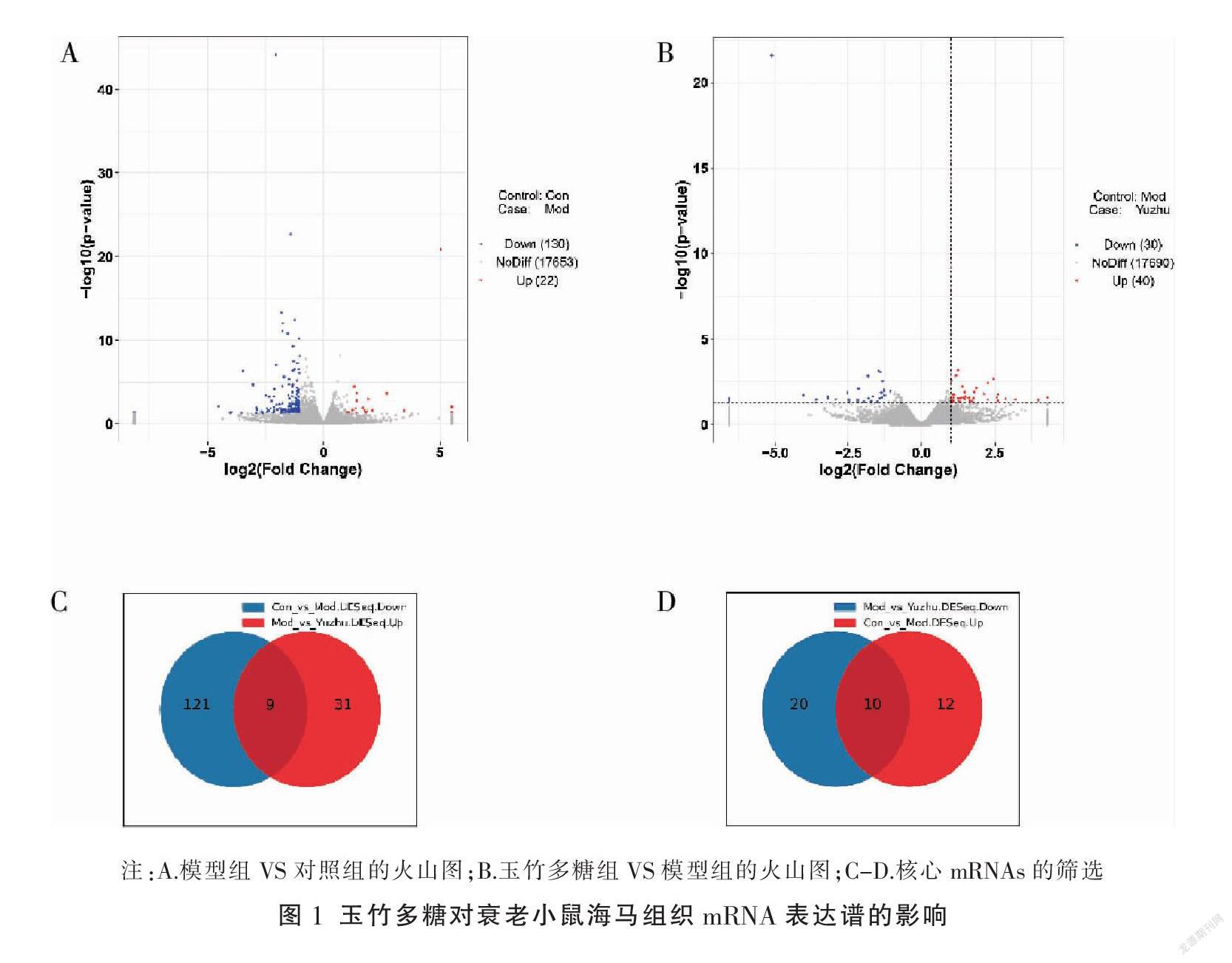
通过RNA-Seq检测,发现衰老小鼠海马组织在衰老后有152个差异表达的mRNAs,其中130个上调,22个下调;另外经玉竹多糖干预后,衰老小鼠海马组织有70个差异表达的mRNAs,其中30个上调、40个下调,详见图1A及图1B。通过对两次比较中的差异基因进行交集分析表明,玉竹多糖能够逆转在衰老后表达失调的19个mRNAs的表达水平,其中9个mRNAs在衰老后表达上调,经玉竹多糖干预后表达下降;10个mRNAs在衰老后表达下调,经玉竹多糖干预后表达上升,详见图1C及图1D。推测这19个mRNAs可能是玉竹多糖的核心作用靶点。见表2。
2.3 核心差异mRNA的富集分析
发现mRNAs GO功能的生物过程主要为神经递质运输、蛋白水解及对细胞因子的反应等;细胞组成主要为质膜的组成部分、突触小泡与轴突等;分子功能主要为金属羧肽酶活性、转运活性与胆碱跨膜转运蛋白活性等,详见图2A。KEGG通路富集分析结果主要为各类代谢、VEGF信号通路及PPAR信号通路等,详见图2B。
2.4 核心差异mRNA的RT-qPCR验证
通过RT-qPCR验证测序结果,发现H2-B1及Cbp1在模型组中表达下调,玉竹多糖能够逆转其表达趋势(P<0.01或P<0.05);Aldh1a2、Sphk1及Slc22a2在模型组中表达上调,玉竹多糖干预后与模型组比较能够下调其表达(P<0.01或P<0.05),结果均与测序结果趋势一致,证明其结果具有一定的可靠性,详见图3。
3 讨论
脑部的衰老会引起大脑的解剖生理变化,而这些变化会影响到认知功能,尤其是处理速度、工作记忆以及行为的执行功能[8]。脑衰老的病因和发病机制复杂,假说主要有Aβ学说、胆碱能学说、氧化应激脂代谢异常学说、神经炎症学说和神经凋亡学说等[6-9],因此,衰老是一个复杂的过程,针对这一复杂过程,中药多成分、多靶点的特点就体现出了独到的优势。
玉竹为滋养肺阴常用中药,具有多种药理学活性,多糖是其有效成分之一,现代药理研究认为玉竹多糖具有免疫调节、降低血糖、抗衰老、抗氧化、抗肿瘤等广泛的药理活性[4]。目前,针对玉竹多糖治疗脑衰老的研究尚未深入,虽然本课题组前期研究已经证实了玉竹多糖可以改善衰老小鼠的认知功能障碍[5],但是对于玉竹多糖抗脑衰老还需要进一步系统性研究。
中草药药效物质基础极其复杂,仅依靠传统研究方法无法系统阐明中药基于“整体观念”治疗的分子机制。目前,基于高通量测序的检测手段能够从整个转录组水平探讨药物的治疗机制,并已逐渐用于筛选中医证候特异性标志物及中药治疗机制研究[10-11]。本研究发现衰老小鼠海马组织有152个差异表达的mRNAs,玉竹多糖逆转了衰老小鼠海马组织中19个mRNAs的表达,相关文献亦证实了相关mRNA的作用:如有学者发现Sphk1在衰老小鼠的海马组织中表达上调,抑制Sphk1的表达可以改善小鼠认知功能障碍,并抑制炎症反应[12]。
通过GO功能富集分析与KEGG通路富集,发现神经递质运输、蛋白水解、突触小泡、金属羧肽酶活性及转运活性等生物过程,VEGF信号通路及PPAR号通路等可能与玉竹多糖的抗衰老的机制密切相关。VEGF是一种细胞有丝分裂原,参与了血管生成的生理和病理过程,具有促进血管生长和渗透调节等作用[13]。最近的研究表明,在神经系统中,VEGF也有保护神经的作用,其对神经生长、营养神经、轴突的生成等方面也有直接作用。PPAR信号通路与认知功能障碍的氧化应激密切相关。氧化应激是指由于氧自由基的产生与清除出现异常致使活性氧蓄积在细胞内,进而诱发机体氧化损伤的过程。机体正常生命活动中,氧化应激是基本的调控保护机制,可以调控细胞生长增殖、组织再生修复、炎症免疫应答等过程[14-17]。当机体在经历衰老和老化时,受氧化应激影响,反应性活性氧簇和反应性活性氮簇产生过多,氧化系统和抗氧化系统就会失衡,活性物质应激性反应导致组织损伤。研究发现,异常的氧化应激能引起细胞或组织的蛋白变性、脂质过氧化、DNA损伤和其他生理功能改变,导致细胞凋亡和组织损伤,是衰老等神经退行性疾病的主要危险因素[18-19]。前期研究结果表明,衰老的模型小鼠海马匀浆中超氧化物歧化酶活性和总抗氧化能力均显著降低,MDA含量显著升高[20],用玉竹多糖干预后,有明显的改善,提示玉竹多糖可以提高细胞抗氧化的能力,达到延缓衰老和抑制氧化损伤的作用[5]。上述报道表明,玉竹多糖能够通过多靶点改善衰老后的认知功能障碍,也进一步验证了本研究的准确性。
综上所述,玉竹多糖能够通过海马组织影响
mRNA表达谱,调控VEGF信号通路及PPAR信号通路,改善衰老后认知功能障碍。本研究为进一步明确玉竹多糖抗衰老的分子机制提供了方向。
参文文献
[1] MAHJOOB M, STOCHAJ U. Curcumin nanoformulations to combat aging-related diseases[J]. Ageing Research Reviews, 2021, 69: 101364.
[2] TURNHEIM K. When drug therapy gets old: Pharmacokinetics and pharmacodynamics in the elderly[J]. Experimental Gerontology, 2003, 38(8): 843-853.
[3] CANNIZZO E S, CLEMENT C C, SAHU R, et al. Oxidative stress, inflamm-aging and immunosenescence[J]. Journal of Proteomics, 2011, 74(11): 2313-2323.
[4] ZHAO P, ZHAO C C, LI X, et al. The genus Polygonatum: A review of ethnopharmacology, phytochemistry and pharmacology[J]. Journal of Ethnopharmacology, 2018, 214: 274-291.
[5] 彭 壯,李 弘,彭 莎,等.玉竹多糖对D-半乳糖诱导衰老小鼠认知障碍的改善[J].中华中医药学刊,2020,38(11):254-258, 302.
[6] SCHNEIDER J A, ARVANITAKIS Z, LEURGANS S E, et al. The neuropathology of probable Alzheimer disease and mild cognitive impairment[J]. Annals of Neurology, 2009, 66(2): 200-208.
[7] CHEN P, CHEN F C, LEI J X, et al. Activation of the miR-34a-mediated SIRT1/mTOR signaling pathway by urolithin A attenuates D-galactose-induced brain aging in mice[J]. Neurotherapeutics: the Journal of the American Society for Experimental NeuroTherapeutics, 2019, 16(4): 1269-1282.
[8] JOUBERT C, CHAINAY H. Aging brain: The effect of combined cognitive and physical training on cognition as compared to cognitive and physical training alone-a systematic review[J]. Clinical Interventions in Aging, 2018, 13: 1267-1301.
[9] SERRANO-POZO A, FROSCH M P, MASLIAH E, et al. Neuropathological alterations in Alzheimer disease[J]. Cold Spring Harbor Perspectives in Medicine, 2011, 1(1): a006189.
[10] 贺春香,宋祯彦,李 泽,等.基于环状RNA测序探讨当归芍药散对APPswe/PS1ΔE9转基因小鼠的神经保护作用[J].中国实验方剂学杂志,2021,27(5):16-24.
[11] 张 技,韩玉萍,罗 梅.2型糖尿病肾阴虚证患者差异lncRNA的筛选及分析[J].中医杂志,2018,59(2):124-127,136.
[12] 郭品豪.右美托咪定通过调节SPHK1改善POCD小鼠认知功能[D]上海:中国人民解放军海军军医大学,2020.
[13] NOWACKA M M, OBUCHOWICZ E. Vascular endothelial growth factor (VEGF) and its role in the central nervous system: A new element in the neurotrophic hypothesis of antidepressant drug action[J]. Neuropeptides, 2012, 46(1): 1-10.
[14] JIANG S R, NANDY P, WANG W Z, et al. Mfn2 ablation causes an oxidative stress response and eventual neuronal death in the Hippocampus and cortex[J]. Molecular Neurodegeneration, 2018, 13(1): 5.
[15] BÖCKLER S, CHELIUS X, HOCK N, et al. Fusion, fission, and transport control asymmetric inheritance of mitochondria and protein aggregates[J]. The Journal of Cell Biology, 2017, 216(8): 2481-2498.
[16] IVANOV A V, BARTOSCH B, ISAGULIANTS M G. Oxidative stress in infection and consequent disease[J]. Oxidative Medicine and Cellular Longevity, 2017, 2017: 3496043.
[17] LONNEMANN N, HOSSEINI S, MARCHETTI C, et al. The NLRP3 inflammasome inhibitor OLT1177 rescues cognitive impairment in a mouse model of Alzheimer's disease[J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(50): 32145-32154.
[18] CHIU K B, LEE K M, ROBILLARD K N, et al. A method to investigate astrocyte and microglial morphological changes in the aging brain of the rhesus macaque[J]. Methods in Molecular Biology, 2019, 1938: 265-276.
[19] BLASKO I, STAMPFER-KOUNTCHEV M, ROBATSCHER P, et al. How chronic inflammation can affect the brain and support the development of Alzheimer's disease in old age: The role of microglia and astrocytes[J]. Aging Cell, 2004, 3(4): 169-176.
[20] 耿廣琴,刘 坤,夏光萍,等.黄芪与红芪提取物对衰老模型小鼠脑组织抗氧化能力和海马结构功能的影响[J].中国现代应用药学,2017,34(4):500-504.

