基于代谢组学技术的不同白酒挥发性成分差异分析
◎ 张春生,赵文静,董良飞,施 蕊
(1.云南财经大学 旅游与酒店管理学院,云南 昆明 650221;2.云南财经大学 统计与数学学院,云南 昆明 650221;3.西南林业大学 园林园艺学院,云南 昆明 650224)
白酒系世界七大蒸馏酒之一,其历史悠久、风味独特,深受我国广大消费者的喜爱与青睐。白酒是一种复杂的多组分体系,主要成分为乙醇和水,约占总质量的98%~99%,剩余的微量成分为一些酯类、醛类、酸类、芳香族及高级醇类化合物[1]。虽然这些微量成分总占比不足2%,但却是影响白酒品质的关键,其种类、含量及相互间比例的差异赋予了白酒不同的香型与风味[2-3]。目前,用于白酒微量成分分析的技术手段主要有色谱[4]、质谱[5]、光谱[6]和电子传感技术[7]等,其中气相色谱-质谱联用技术(Gas Chromatography-Mass Spectrometry,GC-MS)对于低沸点的挥发性组分灵敏度高、分离性好,已广泛用于白酒的掺假识别[8]、香型判定[9]及年份鉴定[10]等。此外,近年的应用实践表明,顶空固相微萃取箭型(Headspace Solid-Phase Microextraction Arrow,HS-SPME Arrow)技术可显著降低前处理时白酒挥发性成分的流失,且新型的SPME Arrow比常规型号拥有更大的吸附表面积与体积,富集效果更佳,检测结果也更接近真实酒样[11-12]。
代谢组学是继蛋白质组学和基因组学后新近兴起的一种组学技术,旨在利用现代分析仪器对生物体内的小分子代谢物(相对分子量<1 kDa)进行检测与鉴定,以寻找内源分子与生理病理变化间的相对关系[13]。根据研究对象的不同,代谢组学可分为靶向和非靶向两类,前者主要聚焦一类、一组或一群特定代谢物的分析,后者则是无偏向性地对所有检出的代谢物进行全面分析[14],其间最关键、最核心的问题是多变量数据矩阵的处理[15]。代谢组学自20世纪90年代末诞生以来发展迅速,目前已成为临床医学、生命科学、环境科学等领域的重要研究工具,同时也为食品科学研究提供了新思路、新方法,如食品成分分析[16]、质量鉴别[17]、风险监测[18]。
基于此,本文将新型HS-SPME Arrow与GC-MS联用,结合代谢组学技术建立白酒挥发性成分差异分析方法,以同一品牌不同酱香型白酒为例,在全面解析挥发性成分的基础上对差异成分进行筛选和标示,以期为白酒品质的客观评定提供理论依据和现实参考。
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料
实验选取贵州茅台镇某酒业公司两种酒精度为53%(体积分数)的酱香型白酒(编号为GB和1915)作为研究对象,GB和1915各成一组,每组设3个平行酒样,6个酒样依次编号为GB-a、GB-b、GB-c、1915-a、1915-b和1915-c。质控样本由GB和1915酒样等量混合制备而成,对应编号依次为mix01、mix02、mix03。
1.1.2 仪器与试剂
Agilent 8890-5977B气相色谱质谱联用仪;Agilent DVB/CAR/PDMS三相Arrow萃取头;Millipore-Q超纯水系统。正己烷(Merck)为色谱纯;氯化钠(国药)为分析纯;标准品(Sigma-Aldrich)为色谱纯;实验用水为超纯水。
1.2 试验方法
1.2.1 酒样前处理
取1 mL酒样于进样瓶中,向瓶内加入5 mL饱和氯化钠溶液和10 μL正己烷内标液,采用全自动HSSPME进行挥发性成分萃取富集以供GC-MS分析。
1.2.2 固相微萃取条件
老化温度:250 ℃,老化时间:5 min;孵化温度:60 ℃,孵化时间:10 min;萃取温度:60 ℃,萃取时间:20 min;转子转速:400 r·min-1;解吸时间:5 min。
1.2.3 气相色谱及质谱条件
色 谱 柱:DB-5MS(30 m×0.25 mm×0.25 μm)毛细管柱;进样口温度:250 ℃;升温程序:40 ℃保持5 min,以6 ℃·min-1升至280 ℃,维持5 min。载气:氦气;流速:1 mL·min-1;质谱条件:EI离子源,离子源温度230 ℃,传输线温度280 ℃,电离电压70 eV,四极杆温度150 ℃。
1.3 数据处理
基于迈维(嘉兴)生物技术有限公司MVGC 1.0数据库,运用MassHunter软件(Agilent)进行质谱峰信息提取,经数据过滤、保留指数计算、归一化处理完成酒样挥发性成分的定性定量分析。采用多元统计方法对酒样质谱数据进行主成分分析(Principal Component Analysis,PCA)、正交偏最小二乘法判别分 析(Orthogonal Partial Least Squares Discriminant Analysis,OPLS-DA),并对差异判定模型进行评价。结合OPLS-DA模型的变量重要性投影VIP值(Variable Importance in Project)、P值(P-value)和差异倍数FC值(Fold Change)筛选差异成分,运用3.5.0版R软件Pheatmap程序(版本1.0.12)绘制差异成分聚类热图,对差异倍数值进行对数处理(log2FC)进一步明晰差异显著的前20个成分。
2 结果与分析
2.1 酒样挥发性成分总体分析
GB、1915酒样和质控样本mix经前处理后,在优化设定的GC-MS条件下首先获得总离子流图,继而基于MVGC 1.0数据库,运用MassHunter软件完成酒样挥发性成分定性定量分析。表1的统计结果显示,GB和1915两种酒样无论是挥发性成分的种类还是数量都保持高度一致,即15类229个挥发性成分,这是由于两酒样系同一品牌的两款同香型白酒所致。229个挥发性成分中,被视为白酒香味主体物质的酯类数量占绝对优势,达82个,占比超35%,其次为芳烃类、杂环化合物、酮、醛、烷烃等,酸、硫化物、醚、烯烃和其他类物质检出量均不超过2个,占比均不足1%。

表1 GB和1915两种酒样挥发性成分分类与数量统计表
2.2 酒样差异判定与差异挥发性成分筛选
2.2.1 主成分分析(PCA)
主成分分析是一种常用的“线性降维”方法,即在尽可能保证数据矩阵“信息量不丢失、不减少”的情况下使用少数几个综合指标(主成分)概览和揭示原始变量的内部结构,并将多维度数据转化为可视化的散点图[19]。通过主成分分析可初步了解样品组间和组内样品间的相似性或差异度大小,GB和1915两种酒样质谱数据主成分分析结果见图1。从二维主成分分析结果,即图1(a)中可以直观看出,GB和1915酒样组间分离明显,这说明虽然两种酒样挥发性成分种类、数量高度一致,但含量方面存在可视化差异,从组内差异来看,1915酒样总体小于GB酒样,这意味着1915酒样间的相似度更高,挥发性成分的质量控制更为稳定。三维主成分分析结果如图1(b)所示,由图可知,PC1、PC2和PC3的可解释差异分别为74.8%、12.17%和5.76%,累计可解释差异达92.73%[15]。

图1 两种酒样二维和三维主成分分析散点图
2.2.2 正交偏最小二乘法判别分析(OPLS-DA)
PCA虽能有效提取样品间的差异度信息,但对相关性较小的变量并不敏感,PLS-DA(Partial Least Squares Discriminant Analysis)作为一种有监督模式识别的分析方法可有效消除此缺陷[15]。OPLS-DA则是一种结合了正交信号矫正和PLS-DA的回归建模方法,其最大特点是可以去除自变量与分类变量无关的数据变异,从而使模型变得简单和易于解释,判别效果及主成分得分图的可视化效果更加明显[20-21]。根据OPLS-DA模型对GB和1915两种酒样质谱数据进行分析后绘制的OPLS-DA得分图如图2(a)所示,沿横坐标方向可以看出,1915酒样分布在置信区间左侧,GB酒样分布在置信区间右侧,两酒样组间分离明显,沿纵坐标方向可以看出,GB酒样组间差异度较大,这与PCA分析结果相一致,PC1、PC2两者累计可解释差异86.5%。OPLS-DA模型验证图2(b)显示,R2X=0.865,R2Y=0.999,Q2=0.991,即模型符合要求,具备出色的预测能力[15]。

图2 OPLS-DA得分图和模型验证图
2.2.3 差异挥发性成分筛选
基于OPLS-DA结果,采用将差异倍数值FC、P值与OPLS-DA模型的变量重要性投影VIP值相结合的方法进行差异成分筛选,凡满足FC≥2,FC≤0.5,P<1和VIP≥1任一条件,即认为该成分在两酒样组间存在显著差异。据此标准,GB与1915酒样数据结果经筛查共得到12类79个差异显著的挥发性成分(表1),占共有物质(229个)的34.50%。其中差异较多的成分分别为酯(19个)、杂环化合物(16个)和芳烃(14个)3类物质,分别占比24.05%、20.25%和17.72%,累计占差异成分总数的62.03%。
2.3 酒样挥发性差异成分分析
2.3.1 差异成分聚类热图分析为更直观地观察差异成分的变化规律,采用等方差缩放(Unit Variance Scaling,UV)方法对各变量进行归一化处理,进而运用R软件的Pheatmap程序绘制GB与1915酒样组间差异成分聚类热图,结果如图3所示。经统计,79个差异成分中,1915酒样有26个挥发性成分相对含量显著高于GB酒样,占79个差异成分的32.91%,53个挥发性成分相对含量显著低于GB酒样,占79个差异成分的67.09%。

图3 差异成分聚类热图
2.3.2 差异成分分析
对GB和1915两种酒样差异成分的差异倍数进行对数处理(log2FC),含量差异较大的前20个成分见表2。与GB相比,1915酒样中的2-二甲基-4-乙烯基-1-苯、(2,2-二乙氧基乙基)-苯、1,2,3,4-四氢-2,6-二甲基萘、2-萘酚、4-十一烷酮、(Z)-6-十五碳烯-2-酮、4-十三烷酮、2,4,6-三(1-甲基乙基)苯酚、3-甲基-2(3H)-苯并呋喃酮以及苯乙醛的相对含量明显较高;4-甲基-2-(2-甲基丙基)-1,3-二氧戊环、异戊基二甲基吡嗪、吡咯、2,3-二甲基-5-[(甲硫基)丙基]吡嗪、甲基丁酸乙酯、2-O-庚-4-基1-O-(2-甲基丙基)苯-1,2-二羧酸酯、N-(1-甲基乙基)-苯甲胺、萘、3-甲醛以及1-(2,4-二羟基苯基)-乙酮的相对含量明显较低。
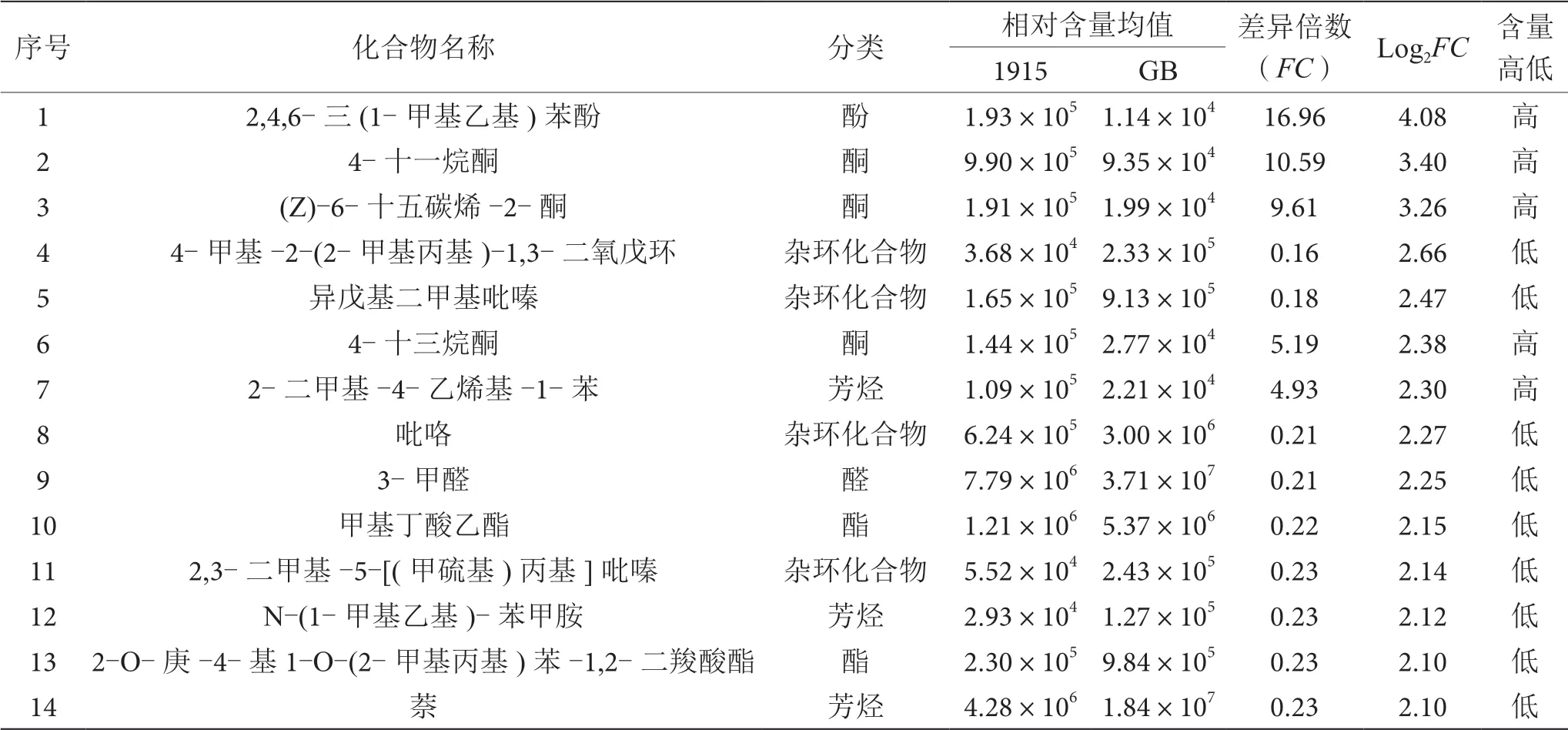
表2 GB和1915酒样含量差异最大的20个成分表

续表2
3 结论
白酒风味物质种类繁多,含量甚微,传统的单一手段难以准确快速地完成样品(组)间的差异判定与成分筛选。本研究将HS-SPME-Arrow-GC-MS检测手段与代谢组学技术结合应用于不同白酒挥发性组分差异分析中。经比对,两种酱香型白酒检出成分的种类、数量高度一致,酯类物质占比超35%。主成分分析结果显示,两酒样组间可视化差异明显,1915酒样组内相似度更高,提取到的PC1、PC2和PC3累计可解释差异达92.73%。基于OPLS-DA建立的差异成分识别模型,229个检出成分中共筛选出12类79个差异成分,酯类、杂环化合物和芳烃为差异个数最多的3类成分,1915酒样中26个差异成分相对含量高于GB。通过对酒样组间差异成分的倍数进行对数处理明确得出了差异最大的前20个成分。本研究建立的不同白酒挥发性成分差异分析方法高效可行,结果可视化效果佳,可为白酒的真伪鉴别和品质评定提供理论依据与实践参考。

