一株二甲基二硫醚降解菌的筛选、鉴定与降解性能
丁军,吴洪生*,孙倩,王娜,程诚,石陶然,MuhammadFaheem,倪妮,田伟,吴云成,单正军
(1.南京信息工程大学应用气象学院农业资源与环境系,南京 210044;2.生态环境部南京环境科学研究所,南京 210012)
伴随着现代工业、农业、畜牧业、烟草业、纺织业、家具业、汽车业以及电子电气等行业的快速发展,在生产过程中产生了大量的含非甲烷烃类(烷烃、烯烃、炔烃、芳香烃)、含氯有机物、含氮有机物、含氧有机物、含硫有机物等挥发性有机污染物(VOCs)。这些污染物未经过系统化的处理,直接排放到环境中,使得土壤、地下水以及农作物受到严重的污染,同时也不利于人体身心健康。人体通过饮用含污染物的水,或者呼吸吸入一定浓度的VOC气体后,会出现不同程度的头痛、呕吐、乏力等症状,严重时会出现抽搐和休克,并且会伤害人的肾脏、肝脏、大脑和一些神经系统中枢,造成行动迟缓、记忆力衰退等不良后果。
二甲基二硫醚(Dimethyl disulfide,缩写为DMDS,分子式CHSCH)是一种典型的挥发性含硫有机物,是农药生产过程中的一种中间体,具有烂菜叶的腐臭味。DMDS也被列为我国《恶臭污染物排放标准》(GB 14554—1993)中限制排放的几种恶臭污染物之一。DMDS严重污染生存环境,威胁人体健康,研究其在土壤及地下水中的滞留浓度,以及自然降解的时间和动态变化,可以有效控制其污染环境的程度。环境因素如温度、水分、土壤类型、含氧量等都会对DMDS在土壤中的分布残留有显著的影响。针对DMDS大量排放,滞留在环境中的浓度超过限制标准问题,很多科研工作者开始寻找一种有效的降解方式。目前的降解方式主要有物理吸附、化学吸附、光催化、生物联合技术、生物过滤、臭氧降解、生物降解等。
生物降解具有绿色高效的特点,是通过污染环境中的土壤、水体筛选纯化出一种或者多种具有降解污染物能力的菌株,利用生物技术手段,可以改变菌株生存的环境,在最佳的生长环境下,高效降解菌可以将环境中复杂的有机污染物转化为简单的无机物,使环境中的各种元素得到循环,复杂的有机物得到降解,保持生态系统的良性循环。微生物主要是通过代谢作用降解环境中的污染物,使污染物浓度下降、毒性减轻。代谢降解过程存在两种方式:一种是微生物以污染物为唯一碳源,通过利用污染物达到降解的效果;另一种是人为施加碳氮源,通过增加微生物的生物量,增加其对于碳氮源的需求量,使环境污染物得到一定的利用。
DMDS可以作为某种菌的碳源及营养来源,通过菌自身的能量消耗,达到降解DMDS的效果。但DMDS的挥发性极强,且恶臭气味十分明显,所以在室内试验时需要一定的技术手段,同时探寻一种高效的色谱条件测定DMDS的含量也极其重要。目前,生物滤塔和生物联合工艺的发展极为迅速,二者均可以利用最佳的降解环境条件,使微生物污染物降解,并可达到持续循环降解的效果。
本试验从苏州某农药厂附近采集土壤及地下水样品,并于室内分离纯化出能降解DMDS的微生物,研究该微生物的降解性能和环境因子对其的影响,为农田土壤及地下水中残留的异味有机污染物DMDS治理提供技术参考。
1 材料与方法
1.1 试验材料
1.1.1 材料样品及试剂
从苏州某废弃农药厂厂房四周选取4个点,于2 m深处取一定量的土壤样品和地下水样品进行混合,混合样放置于4℃的冰柜中冷藏保存,作为本试验的降解菌筛选来源样品。DMDS标准品(化学式CHS,纯度99.3%)选购于阿尔塔科技有限公司。乙醇选用色谱级,所有使用的纯水均为艾肯水精灵制造的RO超纯水机制备。细菌总DNA提取采用索莱宝细菌基因组DNA提取试剂盒。
1.1.2 仪器与设备
试验过程中DMDS生物降解产物采用顶空-气相色谱-质谱联用仪测定,型号78908B15977A,Agilent Technologies GC System,色 谱 柱:HP-5 ms-(60~325℃):30 m×250μm×0.25μm;微生物分离培养采用微电脑智能化控制隔水式恒温培养箱(GNP-9160型);微生物液体药瓶培养采用全温摇瓶柜(HYG-A型);微生物DNA扩增和检测采用PCR分析仪(上海培清科技有限公司,型号:JS-680D)。
1.1.3 培养基
无机盐培养基(MSM):0.630 g NHCl,1.965 g KHPO·3HO,0.5 g KHPO,1 g NaCl,0.1 g MgSO,1 g EDTA,超纯水1 000 mL。用0.1 mol·L的NaOH溶液或HCl溶液调节pH至7.0。
牛肉膏蛋白胨培养基:牛肉膏0.5 g,蛋白胨1 g,NaCl 0.5 g,超纯水100 mL。用0.1 mol·L的NaOH溶液或HCl溶液调节pH至7.2。固体培养基加入1.5 g左右的琼脂。
LB培养基:胰化蛋白胨1 g,酵母提取物0.5 g,NaCl 1 g,超纯水100 mL。用0.1 mol·L的NaOH溶液或HCl溶液调节pH至7.0。固体培养基加入1.5 g左右的琼脂。
高氏合成一号培养基:2 g可溶性淀粉,0.1 g KNO,0.05 g KHPO·3HO,0.05 g NaCl,0.05 g MgSO·7HO,0.001 g FeSO·7HO,超纯水100 mL。用0.1 mol·L的NaOH溶液或HCl溶液调节pH至7.4。固体状态需要加入1.5 g的琼脂。
1.2 试验方法
1.2.1 菌株的分离纯化特征及鉴定
取25 g试验土样于250 mL锥形瓶中,并加入100 mL超纯水,放几粒玻璃珠,在120 r·min、30℃的恒温摇床上振荡混匀。24 h后,取出锥形瓶,静置10 min,吸取0.5 mL上清液置于提前配制好的LB固体培养基上,并用涂抹玻璃棒进行四周旋转涂抹,将所有的土样进行相同操作后,置于恒温培养箱,30℃倒置培养48 h。观察平板上的菌落形态,并且从平板上挑取不同的菌落进行单菌落分离,涂布平板,培养48 h。经过连续3次单菌落分离纯化后,挑取单菌落在LB液体培养基中培养48 h,待菌液浑浊,如菌液不浑浊需再进行一轮液体富集培养直至菌液浑浊。使用DNA提取试剂盒提取总DNA,提取后进行PCR扩增、凝胶电泳检测,并将其送至基因测序公司进行16SrDNA基因测序,将所得到的16SrDNA序列于NCBI数据库进行98%同源性比对,确定菌名。
1.2.2 单菌体对DMDS的降解分析
在超净工作台上将分离纯化后的菌株,按照5%的接种量接种于以200 mg·LDMDS为唯一碳源的无机盐培养基中,用胶塞封口并裹上封口膜,在25℃、120 r·min的恒温摇床上培养72 h后,吸取2 mL待测液置于灭菌后的顶空瓶子中,使用顶空-气相色谱-质谱联用仪进行DMDS扫描,测定含量。色谱条件:单扫描系统设置,柱箱温度35℃,色谱柱-1计算流量为1.5 mL·min,离子源温度为230℃,MS-四极杆温度为150℃,前进样口设定值加热器180℃,压力6.777 76 Pa,隔垫扫吹流量为3 mL·min,后进样口设定值加热器250℃,压力11.604 Pa,隔垫扫吹流量3 mL·min,恒定流量后运行为2 mL·min,平衡时间为30 min,GC循环15 min,样品持续进样0.2 min。根据降解率=(对照样品的残余含量-试验样品的残余含量)/对照样品的残余含量×100%,确定各个单一菌体的降解率,选择降解效果最明显的菌株作为试验菌。
1.2.3 生长曲线
将分离纯化后的菌株接种于含有200 mg·LDMDS的无机盐液体培养基中,25℃、120 r·min条件下摇床培养,每个处理3次重复,在不同的时间(0、2、8、16、24、32、40、48、56、64、72、80 h)取样,用分光光度计在600 nm波长下测定菌液的OD值,由此确定菌株的生长曲线。
1.2.4 环境因子对菌体生长的影响
采用单因素进行有关环境因子试验,将分离纯化后的菌株,按照接种量为5%规格接种于含有DMDS的无机盐培养基中,测定其同一时间的OD和DMDS的浓度,计算降解率,比较环境因子对该菌降解DMDS的影响。
环境因子如下:
(1)DMDS初始浓度:接种5%体积分数的菌液于含有50、100、150、200、250、300 mg·LDMDS的无机盐培养基中,在温度为30℃、pH为7、转速为120 r·min的条件下培养72 h,设不加菌为对照,每个处理重复3次。
(2)pH:接种5%体积分数的菌液于含有50 mg·LDMDS的无机盐培养基中,以DMDS为唯一碳源,温度为30℃,转速为120 r·min,调节pH为5、7、9,振荡培养72 h。设不加菌为对照,每个处理重复3次。
(3)温度:接种5%体积分数的菌液于含有50 mg·LDMDS的无机盐培养基中,DMDS为唯一碳源,在pH为7,转速为120 r·min时,设置温度分别为10、20、30℃,振荡培养72 h。设不加菌为对照,每个处理重复3次。
(4)转速:接种5%体积分数的菌液于含有50 mg·LDMDS的无机盐培养基中,DMDS为唯一碳源,在pH为7,温度为30℃时,调节转速分别为65、130、200 r·min,振荡培养72 h。设不加菌为对照,每个处理重复3次。
(5)外加碳源:接种5%体积分数的菌液于含有50 mg·LDMDS的无机盐培养基中,另外同时向培养基中分别加入2 g的淀粉、葡萄糖或蔗糖,在pH为7、温度为30℃、转速为120 r·min条件下,振荡培养72 h。设不加碳源为对照,每个处理重复3次。
(6)外加氮源:接种5%体积分数的菌液于含有50 mg·LDMDS的无机盐培养基中,外加0.1 g的蛋白胨、尿素或明胶,在pH为7、温度为30℃、转速为120 r·min的条件下,振荡培养72 h。设不加氮源为对照,每个处理重复3次。
1.3 数据处理与分析
采用Excel 2010进行数据处理和图表绘制,结果表示为3个重复的平均值±标准误差。采用Mega 7.0进行细菌进化树绘制,使用SPSS 22.0进行单因素方差分析(ANOVA),置信限为95%。
2 结果与分析
2.1 菌株的鉴定
经过多次的培养纯化富集、初筛、复筛,得到一株降解能力较好的菌株SZT-1,该菌能以DMDS为唯一碳源在平板上生长(图1),平板上的菌落形态粗糙,不透明,白色微黄,隆起褶皱。在光学显微镜上进行观察(图2),SZT-1周生鞭毛,可活动,革兰氏染色为阳性。与16SrDNA测序结果在NCBI上比对的结果表明,该菌株的序列与多种芽孢杆菌属菌株具有高度相似性,菌株系统发育进化树如图3所示。

图1 SZT-1平板菌落形态Figure 1 SZT-1 plate colony morphology
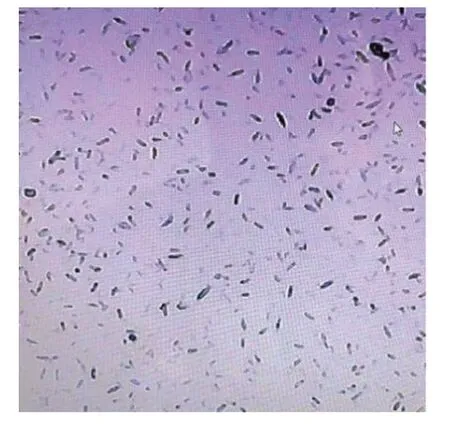
图2 SZT-1镜检形态(×100倍)Figure 2 Microscopic examination of SZT-1 morphology(×100 times)

图3 SZT-1系统进化树Figure 3 Phylogenetic treeof SZT-1
2.2 SZT-1的生长曲线
由图4c STZ-1的生长曲线可以看出,波长为600 nm时,该菌株在32 h之前的OD值均比较低,说明菌株生长较为缓慢,一般情况下,24 h前菌株生长应该比较旺盛,生长较为缓慢可能是因为DMDS作为唯一碳源导致的。32~56 h,OD值具有迅速上升的趋势,并且在56 h达到最高值2.087,说明该菌株在经过生长迟缓期后,可以迅速进入对数生长期,如图4a和图4b所示,菌液的颜色由清亮变为黄白色。在56 h后,菌株的OD值呈现一定的下降再略上升的趋势,说明这段时间内,在DMDS被菌株降解的过程中,可能产生了某种抑制菌株生长的中间产物。
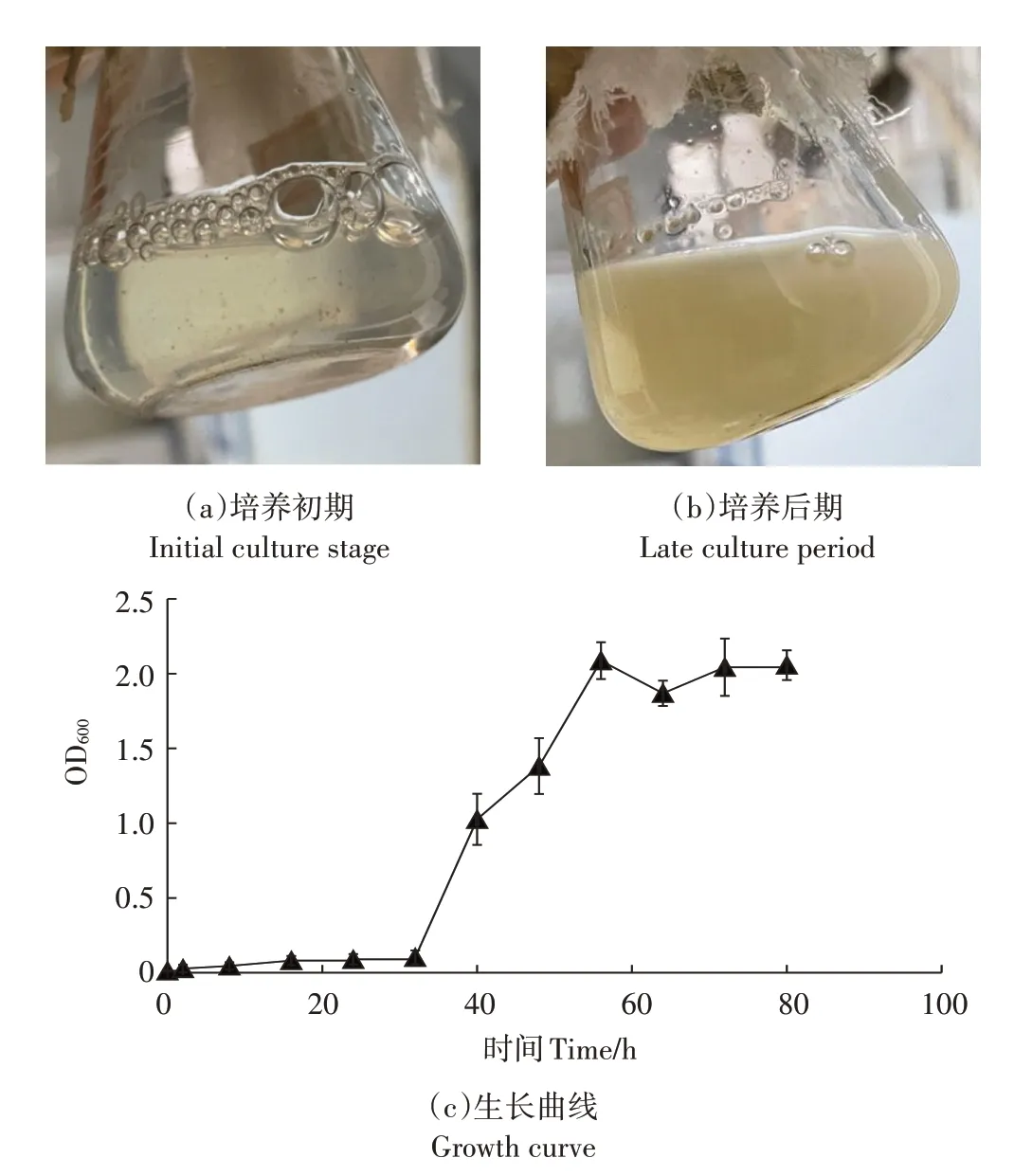
图4 SZT-1生长动态Figure 4 Growth dynamic of SZT-1
2.3 DMDS的降解动力学结果
对比自然条件下和试验条件下,200 mg·LDMDS在无机盐培养基中的降解效果。如表1所示,同等环境条件下,在试验终点72 h时,自然降解后的DMDS浓度为167.8 mg·L,而加入SZT-1后,DMDS浓度仅剩109.4 mg·L,说明SZT-1对DMDS有明显的降解效果。自然条件下,DMDS的降解比较缓慢,降解率比较低,且在72 h内降解率仅有13%左右;而在试验条件下,SZT-1对DMDS的降解率随着时间的延长不断增加,其降解动力学曲线如图5所示,在0~42 h间,某一时刻的DMDS浓度与初始浓度之比(C/)不断下降,在42 h时降解率达到55.7%,42~72 h趋于平稳。菌株在32 h之前的生长比较迟缓,而降解率却在平稳升高,32~56 h菌株生长进入对数生长期,而降解率增加幅度较小,综合考虑原因主要是SZT-1降解DMDS过程存在饱和临界机制,时间延长,缓慢达到饱和的降解临界,整体趋于平稳,同时也与DMDS的初始浓度相关。采用一级动力学模型进行DMDS降解过程拟合,自然条件的对照组和SZT-1的试验组的都在0.9以上,说明拟合程度较好,符合一级动力学的发展模式,从表2可以明显看出,接种SZT-1后,DMDS的半衰期缩短至86.6 h,说明接种SZT-1可以有效提高DMDS的降解效率。

表1 72 h内自然和试验条件下二甲基二硫醚的剩余浓度(mg·L-1)Table 1 Residual concentration of dimethyl disulfide with and without bacteria within72 h(mg·L-1)
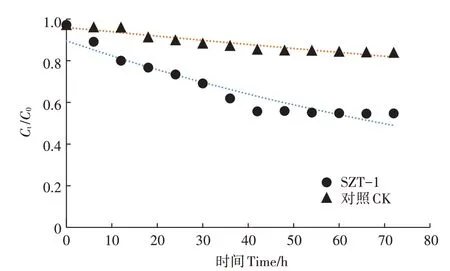
图5 二甲基二硫醚的降解动力学曲线Figure 5 Dynamic curve of DMDSdegrading
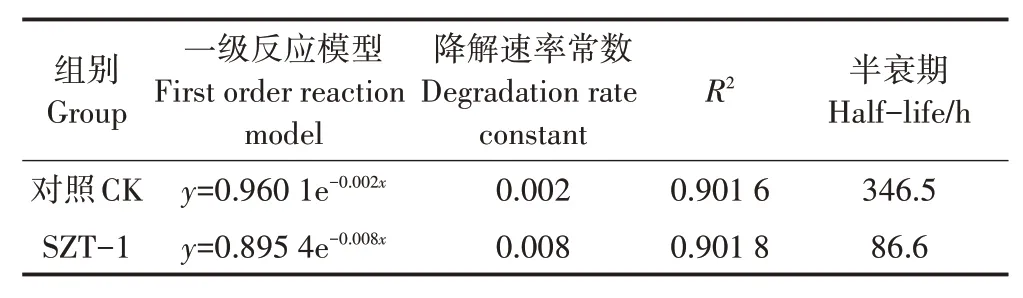
表2 SZT-1对二甲基二硫醚降解的一级动力学曲线拟合性Table 2 The fitness of grade 1 dynamics equation with DMDS degradation curve by SZT-1
2.4 环境因子对SZT-1降解DMDS的影响
2.4.1 DMDS的初始浓度
如图6所示,在低浓度(50 mg·L)DMDS时,降解率仅为10.69%;高浓度(250 mg·L)DMDS时,降解率为60.97%,说明DMDS的初始浓度明显影响菌株对其的降解率;而在最高浓度(300 mg·L)DMDS时,出现小幅下降,此时吸光度值也有一定的下降,可能是DMDS浓度过高抑制了菌株的生长,导致降解率下降。
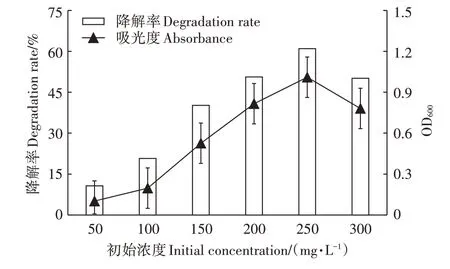
图6 DMDS初始浓度对SZT-1降解效率的影响Figure 6 Effects of initial DMDSconcentrations on the degrading of DMDSby SZT-1
2.4.2 pH
如图7所示,随着p H升高,降解率降低,在pH为5的弱酸性条件下,降解率可以达到23.58%,此时的吸光度也最高,达到0.613,说明菌落生长旺盛,增强了对DMDS的降解;在pH为9的碱性条件下,降解率大幅度下降,此时吸光度值也比较小,说明菌落在碱性条件下,生长会受到抑制,不利于其对DMDS的降解。
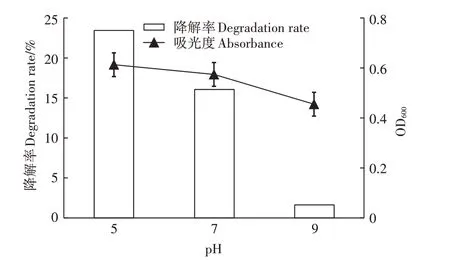
图7 pH对SZT-1降解DMDS的影响Figure 7 Effects of pH on DMDSdegrading by SZT-1
2.4.3 温度
如图8所示,降解率和吸光度值均随着温度的升高而升高,10℃时,吸光度值为0.301,此时降解率仅有7.47%,说明低温不利于菌株的生长,导致DMDS的降解率较低;在30℃时,吸光度值和降解率较20℃时大幅度增加,说明在试验温度范围内,当温度为30℃时,菌株生长最旺盛,温度差异对降解率的影响较大。

图8 温度对SZT-1降解DMDS的影响Figure 8 Effectsof temperature on DMDSdegrading by SZT-1
2.4.4 转速
如图9所示,菌株对DMDS的降解率趋势与其吸光度所体现的生长曲线趋势相同。转速高低对液体摇瓶通气量有很大影响,转速不同即通气量不同会影响菌株的生长,SZT-1是好氧菌,需要充足的氧气,因此转速会影响菌株对DMDS的降解。当转速为130 r·min时,吸光度值最大,降解率最大达到15.3%。但是极高转速条件不利于菌株生长,同时也不利于菌株对DMDS的降解。
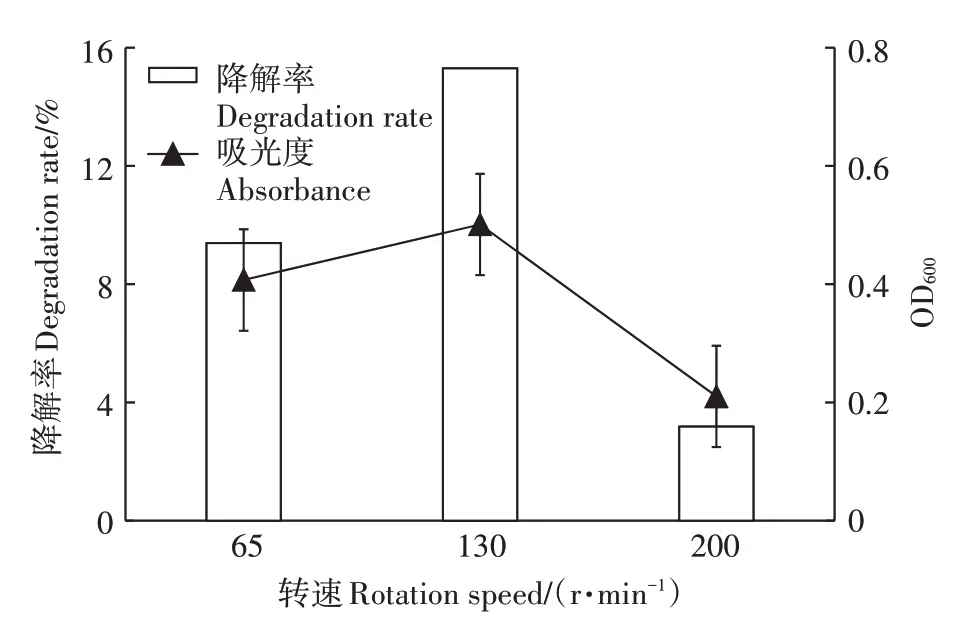
图9 转速(通气量)对SZT-1降解DMDS的影响Figure 9 Effects of rotation per minute(aeration)on DMDS degrading by SZT-1
2.4.5 外加碳源
如图10所示,对照组中,以DMDS为唯一碳源时,降解率仅4.62%,外加任何碳源后,降解率都会有一定的增加,说明外加碳源对降解率的影响较大,其中外加淀粉时菌株生长最好,降解率达到68.54%,为最优碳源。外加蔗糖时的吸光度值下降,此时菌落生长较差,但对应的降解率却达到54.96%,说明蔗糖对DMDS的降解与其菌落生长的关系影响较小,可能某个降解产物抑制了菌落生长。
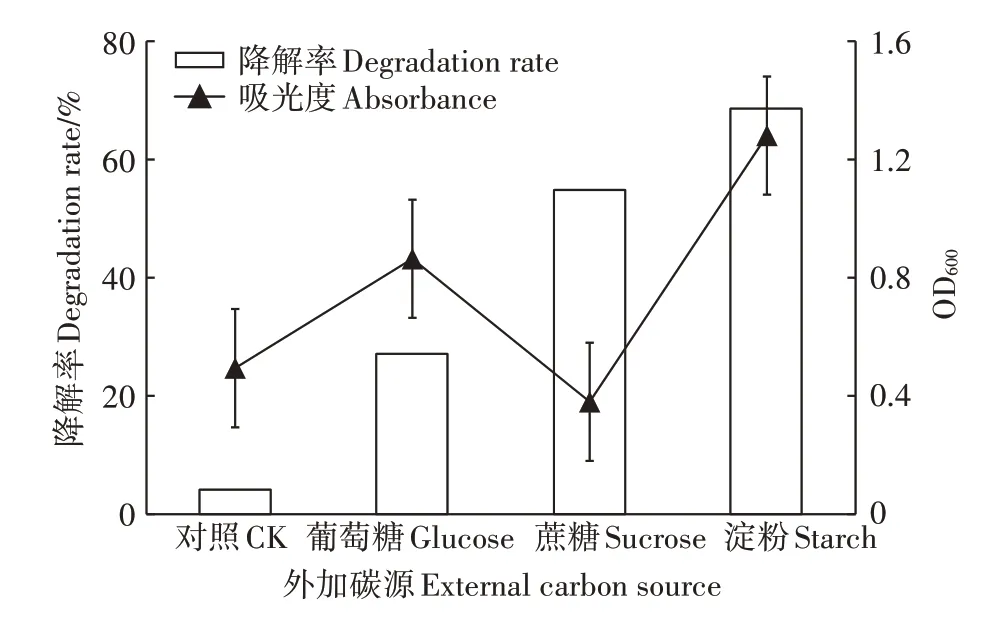
图10 外加碳源对SZT-1降解DMDS的影响Figure 10 Effectsof exogenously addition of carbon sources on DMDSdegrading by SZT-1
2.4.6 外加氮源
如图11所示,外加氮源后,菌株对DMDS的降解率都有增加,其中添加蛋白胨后,降解率为78.41%,为最佳的氮源选择。添加明胶时,吸光度明显高于其他处理,但其降解率却低于其他处理,可能是菌落快速生长,对氮源的需求量较大,明胶的添加量不足以支撑其凸显降解效果。
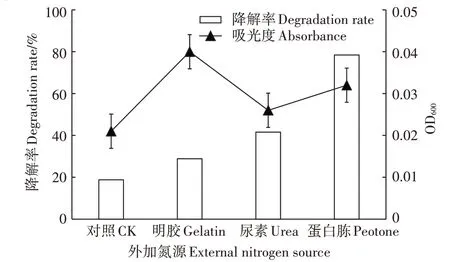
图11 外源氮源对SZT-1降解DMDS的影响Figure 11 Effects of exogenously addition of nitrogen sources on DMDSdegrading by SZT-1
3 讨论
目前,国内外针对DMDS的生物降解研究比较少,相应的降解菌也较少。卢信等在研究有机基质诱发水体黑臭的机制时发现,添加硫酸还原菌可以使蛋氨酸快速分解DMDS,并且降解率高达95%。王集军从广州某垃圾场分离筛选出一株可同时降解乙硫醇和DMDS的高效降解菌,该菌株属于纺锤形赖氨酸芽孢杆菌(),其可在68 h对DMDS达到100%的降解效果。本研究从苏州某农药厂土壤中筛选出一株具有降解DMDS的降解菌,在试验设计的最优环境下降解率可达50%,将其命名为SZT-1,属于芽孢杆菌属(Cohn)。
对于VOCs污染物的降解性,目前已有很多突破性的研究。於建明等从活性淤泥中成功筛选出一株苯乙烯高效降解菌——恶臭假单胞菌(),其在温度为30℃时的降解率较高。门娟等的研究同样发现在30℃时,铜绿假单胞菌()对苯乙烯的降解率较高。陈艺洋筛选出一株具有高效降解邻苯二甲酸二丁酯的菌株DNB-S1,其在pH为7、温度为30℃时降解率显著提高。以上结果与本试验的最佳降解温度一致,可以推测,对VOCs污染物的降解可以在30℃时体现出明显的优势。
樊军浩等发现枯草芽孢杆菌()的最适生长pH为弱酸性,本试验中的单因素分析,同样体现了在pH为5时,菌落生长较好,且此条件下的降解率也较高。宋君等在研究碳氮源对短小芽孢杆菌()的无机氮降解试验中,对比了多种碳源,发现葡萄糖作为碳源时的降解率较高。本试验中发现,淀粉作为外加碳源时降解率比较高,这是因为降解对象不同,且微生物生长环境有所差异。王姊威等发现在无机盐培养基中加入淀粉作为唯一碳源,尿素为氮源时可以高效降解邻苯二甲酸二甲酯,这与本试验中的淀粉作为外加碳源可以提高降解率的结果相吻合,说明淀粉可以为微生物提供足够的碳源进行降解。刘娜等发现单一碳氮源的微生物培养效果远不如复合碳氮源的培养,而本试验只针对单因素分析,后期还将完善复合碳氮源的对比降解研究。
张园园等在对9种氮源对微生物生长的影响进行对比后发现,蛋白胨为唯一氮源的时候,朱红硫磺菌[()().]菌丝生长比较好,生长速度显著提高,这与本试验中以蛋白胨为唯一氮源可以提高SZT-1对DMDS的降解效果相符合。何媛媛等发现以淀粉为碳源、蛋白胨为氮源的碳氮源组合,可以使得菌活性更高、生长更旺盛。李月月等优化枯草芽孢杆菌()发酵液的试验中,发现环境为弱酸性、温度为30℃、转速为150 r·min时,发酵液中的活菌数最高,芽孢率达到84%,与本试验的转速120 r·min、温度30℃、pH为5时,降解效果最好的结果相符合。刘韶娜等对芽孢杆菌()进行筛选试验时,同样发现温度为30℃、弱酸性条件、碳源为淀粉、氮源为蛋白胨时菌株生长最快。
孙洁等观察不同环境条件下枯草芽孢杆菌()的活菌数时发现,pH在3~7、温度在20~40℃时,活菌数最高,这个最适区间与本试验的最佳条件相吻合。在汤瑜婧等对枯草芽孢杆菌生长培养优化后,同样将环境设置成弱酸性、氮源设置为淀粉。在对枯草芽孢杆菌的应用降解研究中,孙玲玉则发现枯草芽孢杆菌对黄曲霉素具有一定的降解效果,枯草芽孢杆菌作为国际公认的安全饲料添加菌种,在以后的生物降解研究中也将会发挥巨大的作用。
本研究采用多重筛选、纯化的方法,从苏州某废弃农药厂的土壤中筛选出一株能够有效降解DMDS的降解菌SZT-1。该菌为芽孢杆菌属的一种,已经在市政和工业污水处理、工业循环污水处理、化粪池、畜牧养殖动物废料、臭味的处理等方面有一定的应用,是一种具有多功能的微生物。而对于SZT-1降解DMDS的研究尚未见文献报道,本试验是首次在污染土壤中分离筛选出SZT-1,单因素试验结果表明,在最佳降解条件(初始浓度为250 mg·L、pH 5、温度30℃、转速130 r·min、外加碳源为淀粉、氮源为蛋白胨)下,综合评估其降解率可达到50%。根据GC-MS测定结果,STZ-1降解DMDS的最终目标产物主要为CO、SO、HO,可能分泌某些酶类切断C—S键,推测其中间产物含有三硫化二甲基和一些含硫基团、甲基团,由于本试验条件的限制和不足,各个单因素没有继续扩展试验,以及具体的降解中间产物研究还在进一步完善,将补充金属离子试验、Eh试验等,随着试验环境条件的继续优化,降解机制的深入研究,降解率会不断提升。综上所述,本研究结果丰富了芽孢杆菌属的生物降解应用范围,且有望应用于DMDS污染的水和土壤环境治理当中。但是目前本项工作只进行了部分环境单因子试验,没有进行广泛的多因子试验,有关该菌的最佳降解性能、野外实际降解效果和降解环境条件、环境中其他微生物的影响、降解产物的二次污染性、降解机理等还需要进一步研究。
4 结论
从苏州某废弃农药厂土壤分离纯化的芽孢杆菌SZT-1能够有效降解水中的二甲基二硫醚异味污染物,经过表型分析及16SrDNA基因序列同源性比对鉴定,该菌株序列与芽孢杆菌属有98%以上的相似性,能以二甲基二硫醚作为唯一碳源生长,在添加适当的外源碳源(淀粉)和氮源(蛋白胨),pH为5、温度30℃、转速为130 r·min的条件下,可以大幅提高SZT-1的降解效果,最高降解效果达到50%。
:本项研究得到科技部国家重点研发计划《农药行业场地异味清除材料与控制技术》(2019YFC1806100)的支持,南京信息工程大学农业资源与环境系2017级本科生刘斌文、2018级本科生张磊参与了部分试验。

