miR-125b-5p靶向ΔNp63α对角质形成细胞分化的影响及其机制
丁毅,李敏,陈龙,张美林,冯树梅*
1新疆医科大学基础医学院组织学与胚胎学教研室,乌鲁木齐 830011;2新疆第二医学院基础医学院解剖组胚教研室,乌鲁木齐 830011;3新疆医科大学基础医学院技能中心,乌鲁木齐 830011;4新疆乌鲁木齐市中心血站,乌鲁木齐 830011
皮肤是生物体远离外界环境影响的第一道屏障,位于皮肤最外层的表皮层主要由不断经历自我更新、分化和退化过程的角质形成细胞组成[1-2]。角质形成细胞的异常分化与银屑病、特应性皮炎及皮肤鳞癌等的发生关系密切[3-4]。因此,阐明角质形成细胞的分化机制对于了解皮肤疾病的发生非常重要。MicroRNAs(miRNAs)是一类内源性、长度为22~23个核苷酸的非编码小RNA,通过与靶基因的3'非翻译区(3'-UTR)配对来调节基因的表达[5]。多项研究发现,miRNA可调控分化、增殖和凋亡等多种重要的细胞功能,并且其表达异常与皮肤疾病密切相关[4-6]。miR-125b-5p作为一种重要的抑癌分子,在银屑病、皮肤鳞癌和黑色素瘤中低表达,并可调节细胞凋亡,参与肿瘤的发生发展[7-8];过表达miR-125b-5p可抑制角质形成细胞和黑色素瘤细胞的增殖[9]。ΔNp63α是皮肤发育的重要调控因子,在银屑病和皮肤鳞癌中表达上调[10],过表达ΔNp63α可促进角质形成细胞增殖[11]。靶基因预测发现,miR-125b-5p与ΔNp63α密切相关,但miR-125b-5p能否通过调控ΔNp63α的表达影响角质形成细胞的分化鲜见报道。本研究旨在分析miR-125b-5p和ΔNp63α对角质形成细胞分化的影响及可能机制,以期为了解皮肤病的发病机制提供新的理论依据。
1 材料与方法
1.1 主要试剂及仪器 DMEM培养基、胎牛血清、青霉素-链霉素溶液购自美国Gibco公司;转染试剂riboFECTTM CP、miR-125b-5p的模拟物及抑制剂、阴性对照模拟物/抑制剂购自广州锐博生物科技有限公司;ΔNp63α单抗(ab203826)、β-actin单抗(ab75186)、蛋白激酶B(protein kinase B,Akt;ab179463)、p-Akt(Ser473;ab192623)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR;ab32028)、p-mTOR(Ser2448;ab109268)购自英国Abcam公司;磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K;sc-365290)、细胞角蛋白10(cytokeratin 10,CK10;sc-53252)、外皮蛋白(involucrin,Inv;sc-21748)、谷氨酰胺转移酶1(transglutaminase,TG1;sc-166767)单抗购自美国Santa Cruz公司;皂素(saponin)购自美国Sigma公司;辣根过氧化物酶标记的二抗购自上海爱必信生物科技有限公司;反转录试剂盒、实时荧光定量PCR(qRT-PCR)检测试剂盒购自北京全式金生物技术有限公司;BCA蛋白分析试剂盒和RIPA裂解液购自北京索莱宝科技有限公司;ECL化学发光底物试剂盒购自中国Biosharp公司。生物安全柜和CO2培养箱购自美国Thermo Fisher公司;激光共聚焦显微镜(Nikon C2)购自日本Nikon公司。
1.2 细胞培养 人正常皮肤永生化角质形成细胞株HaCaT购自武汉大学中国典型培养物保藏中心,用含15%灭活胎牛血清(FBS)、1%青霉素和链霉素的DMEM培养。
1.3 角质形成细胞分化模型的构建 取对数生长期HaCaT细胞,按照3×105个/孔接种于6孔板中,加入1.8 mmol/L氯化钙处理0、1、5、7 d,提取RNA行qRT-PCR检测。
1.4 细胞免疫荧光分析ΔNp63α的表达情况 取对数生长期HaCaT细胞,按照8000个/孔铺于含细胞爬片的6孔板中,次日加入1.8 mmol/L氯化钙处理0、5 d。用PBS清洗3次,4%多聚甲醛溶液固定15 min;PBS洗涤10 min×3次,将ΔNp63α一抗(1∶300)于saponin中稀释后加在玻片上孵育1 h;PBS洗涤,加入二抗(1∶300)孵育1 h,PBS洗涤后封片,利用激光共聚焦显微镜进行共聚焦成像分析。
1.5 细胞转染 取对数生长期HaCaT细胞,按照3×105个/孔接种于6孔板中。次日待细胞贴壁后按照如下分组进行转染:阴性对照模拟物组(转染阴性对照模拟物)、miR-125b-5p模拟物组(转染miR-125b-5p模拟物)、阴性对照抑制剂组(转染阴性对照抑制剂)、miR-125b-5p抑制剂组(转染miR-125b-5p抑制剂)。因瞬时转染效率仅可维持3 d左右,故在3 d后重新转染,转染5 d后收集细胞用于后续实验。
1.6 qRT-PCR检测miR-125b-5p及ΔNp63α、CK10、Inv、TG1、PI3K、Akt、mTOR的mRNA表达水平利用Trizol法提取细胞总RNA,采用反转录试剂盒进行反转录。PCR反应条件:94 ℃ 30 s;94 ℃ 5 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 60 s,90 ℃15 s。以U6或β-actin为内参,采用2-ΔΔCt法计算目的基因mRNA的相对表达水平。引物由中国生工生物工程公司合成,引物序列见表1。
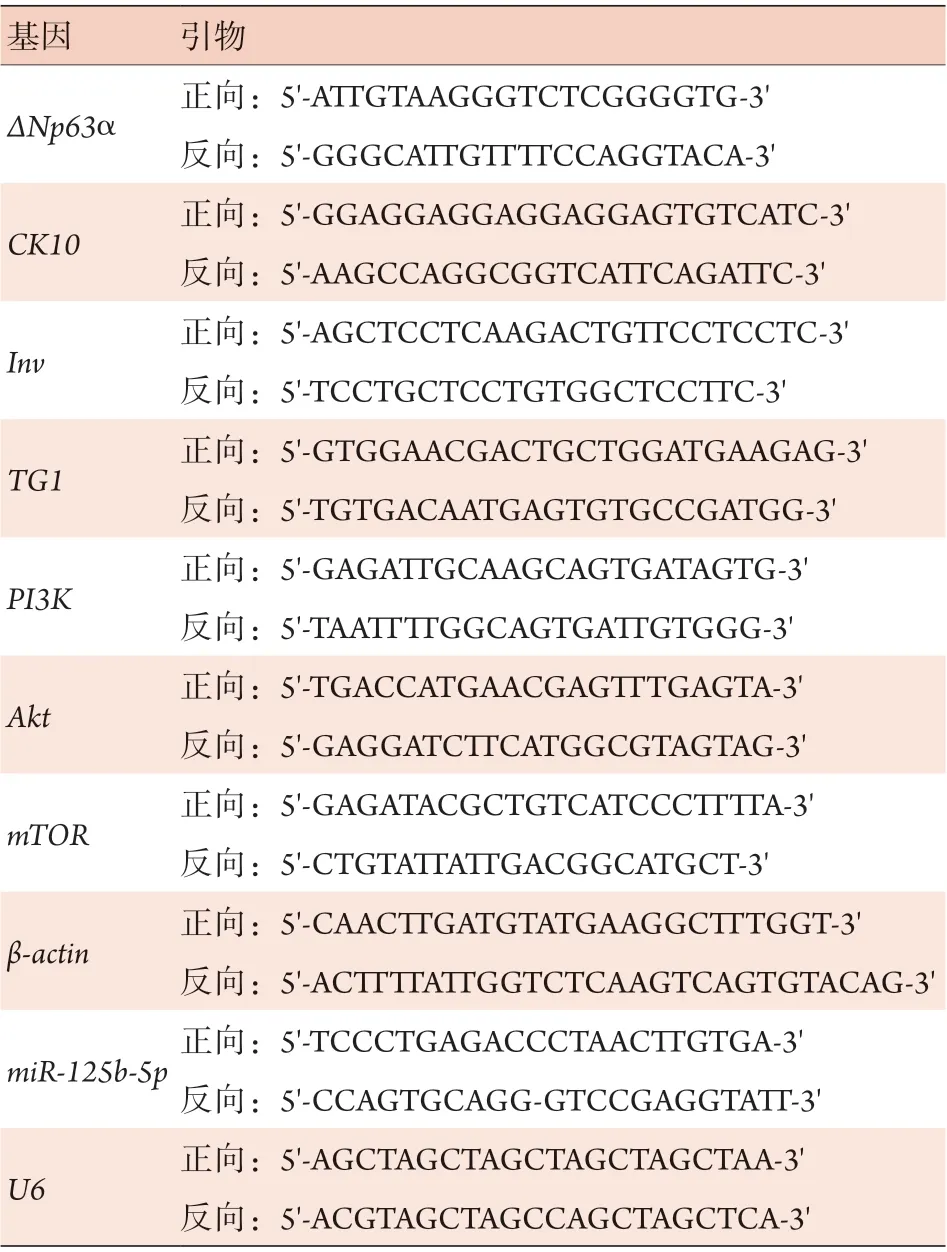
表1 qRT-PCR引物序列Tab.1 Primer sequence of qRT-PCR
1.7 Western blotting检测ΔNp63α、CK10、Inv、TG1、PI3K、Akt、mTOR蛋白表达水平 取转染阴性对照模拟物/抑制剂、miR-125b-5p模拟物/抑制剂的角质形成细胞,RIPA冰上裂解20 min,用BCA蛋白分析试剂盒进行定量检测。蛋白质经SDSPAGE凝胶电泳后,转移到硝酸纤维素膜(NC)上。1×TBST洗涤后,用5%脱脂奶粉封闭2 h,加入TBST稀释的一抗ΔNp63α(1∶1000)、CK10(1∶100)、Inv(1∶100)、TG1(1∶1000)、PI3K(1∶3000)、Akt(1∶3000)、mTOR(1∶3000)和β-actin(1∶1000),4 ℃孵育过夜。加入辣根过氧化物酶(HRP)标记的抗兔/鼠IgG二抗(1∶5000)室温孵育1 h;洗膜后用ECL试剂盒发光显影,然后用ImageJ软件分析蛋白条带的灰度值。
1.8miR-125b-5p与ΔNp63α结合位点预测 在NCBI(https://www.ncbi.nlm.nih.gov/)网站查询miR-125b-5p和ΔNp63α的完整RNA序列,利用bibiserv(https://bibiserv.cebitec.uni-bielefeld.de/)在线网站对miR-125b-5p和ΔNp63α的结合位点进行分析。
1.9 统计学处理 采用SPSS 28.0软件进行统计分析。符合正态分布的计量资料以±s表示,两组间比较采用t检验,多组间比较采用方差分析,进一步两两比较采用Games-Howell检验。P<0.05为差异有统计学意义。
2 结 果
2.1 皮肤分化相关标志物和miR-125b-5p在氯化钙诱导的角质形成细胞分化模型中的表达情况 qRTPCR检测结果显示,氯化钙处理7 d时角质形成细胞中CK10、Inv和TG1mRNA相对表达水平(分别为300.70±13.27、9.14±1.23、5.49±0.34)高于处理0 d(分别为1.10±0.11、1.02±0.23、1.00±0.08)、1 d(分别为2.13±0.45、1.21±0.21、1.33±0.04)和5 d(分别为11.90±2.10、5.86±1.03、2.61±0.11)时,且处理5 d时高于处理1 d时,差异有统计学意义(P<0.05,图1A);氯化钙处理5 d时miR-125b-5p相对表达水平(0.08±0.01)低于处理0 d(1.00±0.02)和1 d(0.17±0.02)时,差异有统计学意义(P<0.0001或P<0.05,图1B),但氯化钙处理5 d与7 d(0.07±0.02)时miR-125b-5p相对表达水平差异无统计学意义(P>0.05)。
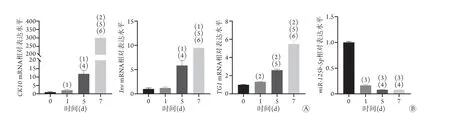
图1 皮肤分化相关标志物和miR-125b-5p在角质形成细胞分化模型中的表达情况Fig.1 Expression of skin differentiation-related markers and miR-125b-5p in keratinocyte differentiation model
2.2 氯化钙处理对角质形成细胞中ΔNp63α表达及PI3K/Akt/mTOR通路的影响 qRT-PCR检测结果显示,氯化钙处理1、5、7 d时角质形成细胞中ΔNp63α mRNA相对表达水平均高于0 d,差异有统计学意义(3.55±0.24、5.58±0.42、20.82±0.58vs. 1.01±0.23,P<0.01,图2A)。激光共聚焦显微镜观察显示,与氯化钙处理0 d时相比,氯化钙处理5 d时角质形成细胞中ΔNp63α阳性细胞率增高,差异有统计学意义(96.9%±0.9%vs. 43.2%±8.2%,t=6.469,P<0.001,图2B)。氯化钙处理1 d(分别为2.28±0.05、1.66±0.04、1.77±0.22)、5 d(分别为4.37±0.22、2.42±0.05、2.47±2.22)和7 d(分别为12.77±0.59、2.88±0.20、4.39±0.33)时PI3K、Akt和mTORmRNA相对表达水平高于0 d(分别为1.00±0.11、1.03±0.05、1.00±0.05),差异有统计学意义(P<0.05,图2C)。
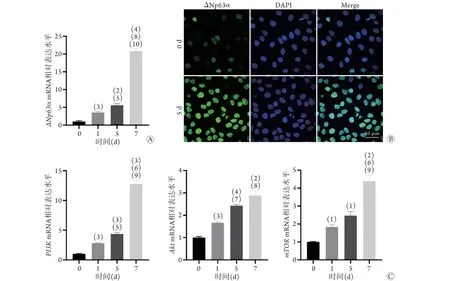
图2 氯化钙促进皮肤角质形成细胞中ΔNp63α的表达且激活PI3K/Akt/mTOR通路Fig.2 Calcium chloride promotes the expression of ΔNp63α and activates PI3K/Akt/mTOR pathway in keratinocyte
2.3ΔNp63α与miR-125b-5p的关系 bibiserv网站预测结果显示,miR-125b-5p与ΔNp63α的3'-UTR区有一个结合位点(图3)。
图3 bibiserv网站预测皮肤角质形成细胞中miR-125b-5p与ΔNp63α的3'-UTR结合位点信息Fig.3 Prediction of 3'-UTR binding sites between miR-125b-5p and ΔNp63α by bibiserv website in keratinocyte
qRT-PCR和Western blotting检测结果显示,miR-125b-5p模拟物组ΔNp63α mRNA和蛋白表达水平明显低于阴性对照模拟物组(mRNA:0.64±0.02vs. 1.00±0.01;蛋白:0.92±0.19vs. 1.22±0.20,P<0.05,图4A、B);miR-125b-5p抑制剂组ΔNp63α mR NA和蛋白表达水平均高于阴性对照抑制剂组(mRNA:1.79±0.13vs. 0.99±0.01;蛋白:0.78±0.09vs. 0.60±0.11,P<0.05,图4C、D)。

图4 皮肤角质形成细胞中ΔNp63α与miR-125b-5p的关系Fig.4 Relationship of ΔNp63α with miR-125b-5p in keratinocyte
2.4miR-125b-5p转染对角质细胞中皮肤分化相关标志物表达的影响 qRT-PCR和Western blotting检测结果显示,miR-125b-5p模拟物组CK10、Inv、TG1mRNA和蛋白表达水平明显低于阴性对照模拟物组(P<0.05,图5A);miR-125b-5p抑制剂组CK10、Inv和TG1mRNA和蛋白表达水平明显高于阴性对照抑制剂组(P<0.05,图5B)。

图5 miR-125b-5p转染对皮肤角质形成细胞中分化相关标志物表达的影响Fig.5 Effect of miR-125b-5p transfection on the expression of skin differentiation-related markers in keratinocytes
2.5miR-125b-5p转染对角质形成细胞中PI3K/Akt/mTOR通路的影响 qRT-PCR和Western blotting检测结果显示,与阴性对照模拟物组相比,miR-125b-5p模拟物组PI3K、Akt、mTORmRNA表达水平降低,PI3K、Akt、p-Akt、mTOR、p-mTOR蛋白表达水平降低,差异均有统计学意义(P<0.05,图6A);与阴性对照抑制剂组相比,miR-125b-5p抑制剂组PI3K、Akt、mTORmRNA表达水平升高,PI3K、Akt、p-Akt、mTOR、p-mTOR蛋白表达水平升高,差异均有统计学意义(P<0.05,图6B)。
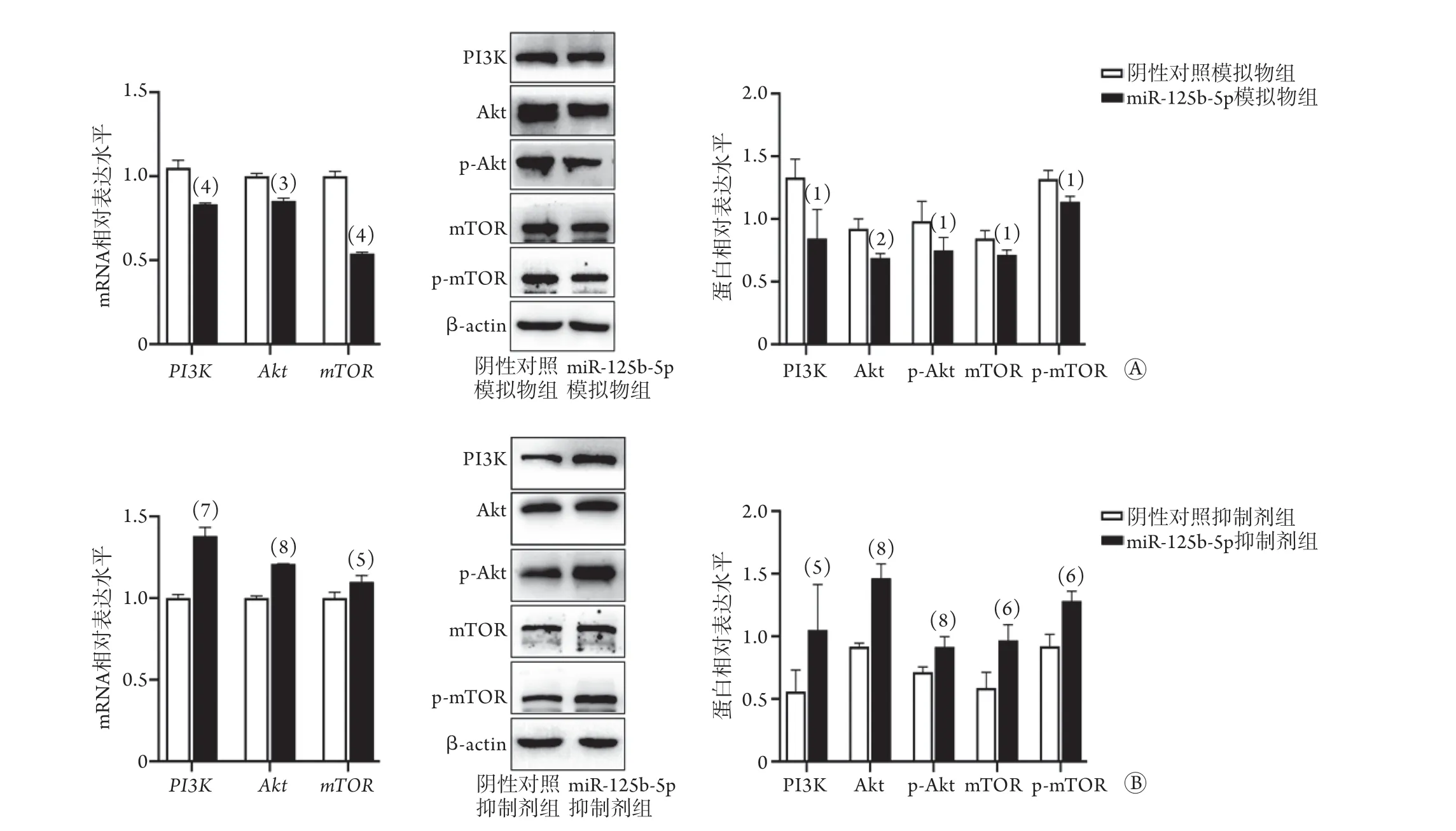
图6 miR-125b-5p表达对皮肤角质形成细胞中PI3K/Akt/mTOR通路的影响Fig. 6 Effects of miR-125b-5p expression on PI3K/Akt/mTOR pathway in keratinocytes
3 讨 论
表皮再生和动态平衡对于维持正常皮肤功能非常重要,且表皮的形成伴随着角质形成细胞的分化、增殖和迁移。分化的基底层角质形成细胞是表皮细胞补充的主要来源[12]。角质形成细胞的异常分化与银屑病和特应性皮炎等皮肤病相关,并与皮肤肿瘤的形成有关[13]。因此,研究角质形成细胞的分化对理解皮肤疾病的发生具有重要意义。
近年来多项研究发现,miRNA与角质形成细胞的分化、增殖和凋亡等相关。Wang等[14]发现,miR-744-3p可通过靶向KLLN抑制银屑病中角质形成细胞的分化。在皮肤表皮层分布的miR-155过表达可明显抑制角质形成细胞的终末分化[15]。但miRNA调控角质形成细胞分化的相关研究较少。据报道,miR-125b-5p在部分癌症中起到癌基因或抑癌基因的作用,这可能是由于miR-125b-5p在不同组织中的靶基因不同而导致的[16]。此外,Zheng等[17]发现,miR-125b-5p在银屑病患者皮肤中呈低表达。Lu等[18]发现,miR-125b-5p在皮肤鳞癌中呈低表达。过表达miR-125b-5p可促进皮肤鳞癌细胞的凋亡,抑制肿瘤的增长。Tian等[19]也得到了相似的结果。同时,miR-125b-5p在口腔鳞癌、头颈鳞癌、肺鳞癌和食管鳞癌中也呈低表达[20-22]。由此可见,miR-125b-5p可能在角质形成细胞中作为一种抑癌基因而存在。本研究对角质形成细胞分化模型中miR-125b-5p的表达情况进行分析,发现miR-125b-5p的表达水平随着角质形成细胞的分化而降低,推测miR-125b-5p可能参与角质形成细胞的分化。本研究结果显示,miR-125b-5p模拟物组CK10、Inv、TG1的mRNA和蛋白表达水平明显降低,且转染miR-125b-5p抑制剂后可逆转这一效应,提示miR-125b-5p在角质形成细胞分化过程中发挥着重要作用。采用生物信息学技术分析发现,miR-125b-5p可以与ΔNp63α的3'-UTR区结合。过表达miR-125b-5p可降低ΔNp63α mRNA和蛋白的表达水平,进一步表明miR-125b-5p抑制角质形成细胞的分化是通过下调ΔNp63α实现的。
ΔNp63α为p53家族的成员,在上皮组织分化和组织发育中发挥重要作用,且与多种肿瘤的发生发展密切相关。ΔNp63α在皮肤鳞癌、宫颈癌、肺癌组织中高表达,且其表达水平与肿瘤的浸润、转移关系密切[23-24]。有研究发现,ΔNp63α表达水平与皮肤鳞癌患者的生存率呈负相关[23]。此外,ΔNp63α过度表达可促进皮肤鳞癌的发生和发展[25]。King等[26]发现,ΔNp63α敲除小鼠的表皮不再生长。Nylander等[27]发现,在p63敲除小鼠中过表达ΔNp63α可以恢复皮肤分化标志物的水平,并维持上皮的完整性。上述研究表明,ΔNp63α在皮肤发育中发挥着重要的调控作用。
此外,本研究证实,miR-125b-5p和ΔNp63α对角质形成细胞分化的作用可能与PI3K/Akt/mTOR通路有关。既往研究发现,激活PI3K/Akt/mTOR信号通路可促进角质形成细胞的分化[28-29]。Troiano等[30]发现,在皮肤鳞癌中ΔNp63α过表达与PI3K/Akt/mTOR信号通路异常激活有关。因此,本研究评价miR-125b-5p和ΔNp63α对角质形成细胞分化的影响时,重点关注了PI3K/Akt/mTOR信号通路的作用。结果表明,上调miR-125b-5p可降低角质形成细胞中PI3K/Akt/mTOR通路mRNA、总蛋白及磷酸化蛋白的表达水平,而下调miR-125b-5p则促进了PI3K/Akt/mTOR通路的激活,提示miR-125b-5p靶向ΔNp63α通过PI3K/Akt/mTOR信号通路调节角质形成细胞的分化。
综上所述,本研究结果表明,miR-125b-5p靶向ΔNp63α通过PI3K/Akt/mTOR通路抑制角质形成细胞的分化。该结果为理解皮肤疾病的发病机制提供了新的见解,并为表皮细胞生物学研究奠定了基础。但本研究仅在体外细胞水平证实miR-125b-5p对角质形成细胞分化的影响,且ΔNp63α调控角质形成细胞分化是否与PI3K/Akt/mTOR信号通路相关尚无法证实。因此,体内功能验证及ΔNp63α的潜在机制尚需进一步研究。

