大丽花花粉活力及离体萌发研究
段 青,蔡晶晶,杜文文,杨 楠,王祥宁,贾文杰,马璐琳
(1云南省农业科学院花卉研究所,昆明 650205;2国家观赏园艺工程技术研究中心,昆明 650205;3云南省花卉育种重点实验室,昆明 650205;4云南农业大学园林园艺学院,昆明 650225)
0 引言
大丽花是隶属于菊科大丽花属的多年生球根花卉,原产于美洲,墨西哥是其多样化中心,现世界各地广为栽培。大丽花品种繁多、花姿优美、花色艳丽、花期长,是世界著名的观赏花卉[1-3]。大丽花最早由墨西哥人从山地引种至庭院种植,后传至欧洲、美国、日本等地,大约在20世纪初大丽花被引入中国,主要用于庭院观赏和盆栽[3]。近年来,大丽花切花逐渐在国内流行,大量的国外品种被引入国内,新品种选育也逐渐在国内受到重视。杂交育种是选育大丽花新品种的主要途径,其中,亲本的花粉活力直接影响了杂交授粉的成功率[4]。因此,对大丽花花粉活力进行准确有效的检测,是保证育种工作顺利开展的重要条件,对杂交育种成功与否具有实际指导作用。确定大丽花花粉活力的有效测定方法、优化方案以及了解不同品种的花粉活力情况是促进大丽花人工授粉杂交结实、培育新品种的必要研究基础。目前,国内对大丽花的研究主要集中于引种评价[1-3,5-8]、繁育与栽培[9-12]、生理[13-15]等方面的研究,而对杂交育种中关键部分花粉活力萌发的研究极少,仅有张云仙[16]对大丽花散粉与结实特性进行了初步研究。大丽花品种已超过3万个,是园艺上庞大而重要的花卉,大量品种尚未被研究。本研究采用TTC染色法、I2-KI染色法、孢粉染色法和离体萌发法测定大丽花花粉活力,在此基础上通过单因素和正交设计试验分别对大丽花花粉的离体萌发培养条件及培养基组分进行优化,得到最优方案后进一步比较不同品种之间花粉活力大小的差异,旨在为大丽花的花粉活力鉴定、杂交育种的亲本选择提供理论依据。
1 材料与方法
1.1 材料
试验于2020年7—9月在云南省农业科学院花卉研究所花卉遗传育种重点实验室完成。以22个大丽花栽培品种为试验材料(图1),其中,选取‘紫珠’、‘黄金缕’、‘紫霞’、‘白色飘雪’、‘爱丁堡’5个品种用于不同花粉活力测定方法比较试验;选取‘紫珠’用于不同培养条件对大丽花花粉萌发的影响试验;选取‘白色飘雪’用于不同培养基组分对大丽花花粉萌发的影响试验;选取‘波彻儿’等22个品种用于不同大丽花品种花粉萌发率比较试验。所有材料均种植于云南省农业科学院花卉研究所团结基地。

图1 试验材料的花部形态
1.2 方法
1.2.1 大丽花花粉的采集 选择发育正常、无病虫害且开放程度相近、但花药尚未散粉的花朵,于8:00—10:00连同花枝一起采下,迅速插入盛有清水的三角瓶中带回实验室,待花朵散粉当天使用毛笔蘸取花粉直接用于试验。
1.2.2 花粉活力测定方法
(1)TTC染色法。用蒸馏水将2%TTC染色液(Solarbio,北京)稀释成0.5%或1%TTC染色液,贮于棕色瓶中于4℃避光保存备用。用毛笔将花粉轻弹到滴有1~2滴TTC染液的载玻片上,盖上盖玻片放入培养皿内,置于35℃恒温箱内,黑暗条件下染色30 min后进行镜检观察花粉染色情况。根据花粉的颜色判断花粉活力的高低,红色的花粉粒有活力,淡红色或无色的花粉粒活力低或无活力[17-18]。
(2)I2-KI染色法。称取0.25 g KI溶于10 mL蒸馏水中,待其充分溶解后,加入0.125 g I2,用蒸馏水定容至50 mL,完全溶解后贮于棕色瓶中,室温避光保存备用。用毛笔将花粉轻弹到滴有1~2滴I2-KI染液的载玻片上,盖上盖玻片放入培养皿内,室温染色10 min后进行镜检观察。根据染色后花粉粒的颜色来判断花粉活力,活力强的花粉呈蓝色,活力弱或内含物少的花粉呈黄褐色,无活力的花粉不着色[19-20]。
(3)孢粉染色法。用孔雀绿10 mg、酚5 g、水合氯醛5 g、酸性品红50 mg、桔红G 5 mg、冰醋酸1~4 mL、95%乙醇10 mL、蒸馏水50 mL、丙三醇25 mL配制孢粉混合染液,置于棕色瓶内4℃避光保存备用。用毛笔将花粉轻弹到滴有1~2滴孢粉染液的载玻片上,盖上盖玻片放入培养皿内,室温染色30 min后进行镜检观察花粉染色情况。有活力的花粉细胞质被染成红色,无活力的花粉细胞壁被染成绿色[20-21]。
(4)离体萌发法。采用BK液体培养基,现配现用。取干净载玻片置于垫有滤纸的培养皿内,滴加适量培养基,用毛笔轻弹少量花粉到培养基中,用牙签轻轻搅动使花粉均匀分散其中,盖上培养皿盖子,置于恒温培养箱内培养1.0~3.0 h(期间注意观察,若培养基干了要及时添加),取出盖上盖玻片,显微镜观察并统计花粉萌发率,当花粉管萌发长度超过1/2花粉直径时即视为具有活力[21-22]。
1.2.3 不同培养条件的单因素试验 以BK(0.01% H3BO3+0.03% CaCl2·2H2O+0.02% MgSO4·7H2O+0.01% KNO3+4%蔗糖+2% PEG4000)为基本培养基,设置不同pH、培养温度和培养时间分别进行单因素试验(表1)。通过萌发率最高统计结果确定最佳pH和最佳培养温度,在此基础上进行不同时间的花粉萌发培养,通过花粉管长度确定最佳培养时间。由此确定的最佳pH、培养温度和培养时间用于下一步正交试验。

表1 单因素试验
1.2.4 不同培养基组分的正交试验 以BK为基本培养基,设置PEG4000、蔗糖、硼酸3个因素,每个因素设置4个水平进行正交设计试验(表2),每处理设置3次重复。按不同配方配制,所有培养基均为液体培养基,现配现用,无需灭菌。

表2 正交试验因素及水平
1.2.5 镜检及结果统计 在显微镜Leica DM6000 B(目镜10×,物镜10倍)下放大100倍观察花粉粒着色及萌发情况,并采集相应的视野照片。每个品种(处理)设3次重复,每个重复制备5个玻片,每个玻片取5个视野,每个视野不少于30粒花粉(不多于150粒)。单个重复内观察到的染色或萌发花粉粒及花粉粒总数采用数字累计相加后再进行花粉活力或萌发率计算,最后取3次重复的平均值。

1.2.6 数据处理 采用WPS Office软件对数据进行预处理,正交设计试验采用正交设计助手ⅡⅤ3.1软件计算K值和极差R值,SPSSAU进行方差分析。使用R软件绘制不同品种大丽花花粉萌发箱图和聚类图。
2 结果与分析
2.1 不同花粉活力测定方法比较与分析
采用TTC染色法、I2-KI染色法、孢粉染色法和离体萌发法4种方法对大丽花品种‘紫珠’、‘黄金缕’、‘紫霞’、‘白色飘雪’、‘爱丁堡’5个品种的花粉活力进行测定,结果(表3和图2)显示,经0.5%或1%TTC溶液染色后,所有花粉颜色无明显变化;经I2-KI染色后,所有花粉均呈黄褐色,未见蓝色、蓝黑色花粉粒以及未着色花粉粒;经孢粉染液染色后,所有花粉均呈紫红色,未见绿色及未着色花粉粒;而离体萌发法效果良好,容易鉴别。TTC染色法、I2-KI染色法、孢粉染色法不适用于大丽花花粉活力的检测,而离体萌发法虽耗时较长,但萌发效果良好,可准确直观地反映大丽花花粉活力状况。

表3 不同方法检测大丽花花粉活力的效果

图2 不同方法检测大丽花花粉活力镜检效果
2.2 不同培养条件对大丽花花粉萌发的影响
2.2.1 pH 在培养温度25℃,培养时间2 h的条件下,设置pH 5.0、5.5、6.0、6.5、7.0共5个梯度进行单因素试验,‘紫珠’花粉萌发率统计结果见表4。图3显示随pH的升高,花粉萌发率呈明显上升趋势,pH 6.0时花粉萌发率最高,达58.37%,然后随着pH升高,花粉萌发率下降。进一步方差分析结果表明,pH 6.0处理组与其他处理达到了极显著性差异(P<0.01)。

表4 pH对花粉萌发率的影响及方差分析

图3 不同培养pH条件下的大丽花花粉萌发率
2.2.2 培养温度 在pH 6.0、培养时间2 h的条件下,设置15、20、25、30、35℃ 5个温度梯度进行单因素试验。图4显示温度过高或过低都不利于大丽花花粉萌发,当培养温度为25℃时,花粉萌发率最高,为59.77%。进一步方差分析结果(表5)表明,培养温度对花粉萌发呈现出极显著性差异(P<0.01)。

图4 不同培养温度条件下的大丽花花粉萌发率

表5 培养温度花粉萌发率的影响及方差分析
2.2.3 培养时间 在pH 6.0、培养温度25℃的条件下,设置1.0、1.5、2.0、2.5、3.0 h 5个时间梯度进行单因素试验,花粉萌发率统计结果见表6。从图5可知,随培养时间延长,花粉萌发率呈上升趋势。当培养时间达2.5 h时,花粉萌发率达64.7%,随后进入缓慢上升趋势。培养2.5 h时,花粉管长度明显伸长(图6),且与培养时间为3.0 h相比无显著差异。

图5 不同培养时间的大丽花花粉萌发率

表6 培养时间对大丽花花粉萌发率的影响及方差分析

图6 不同培养时间条件下的大丽花花粉萌发及花粉管伸长情况
2.3 不同培养基组分对大丽花花粉萌发的影响
表7结果显示RA>RB>RC,可以判断3个试验因素对‘白色飘雪’花粉萌发率的影响程度由大到小依次为PEG、蔗糖、硼酸;从K1、K2、K3、K4的平均值看,最佳组合为A3B3C2,但该组合并未出现在正交设计表中。A1B1C1处理的‘白色飘雪’平均花粉萌发率最低,仅为3.0%;A3B4C2处理的平均花粉萌发率最高,平均可达62.1%,即实际最佳处理组合为A3B4C2。采用SPSSAU进行进一步的方差分析(表8),A、B因素对花粉萌发率的影响达到极显著水平(P<0.01),而C因素并不会对试验结果产生差异(P>0.05)。
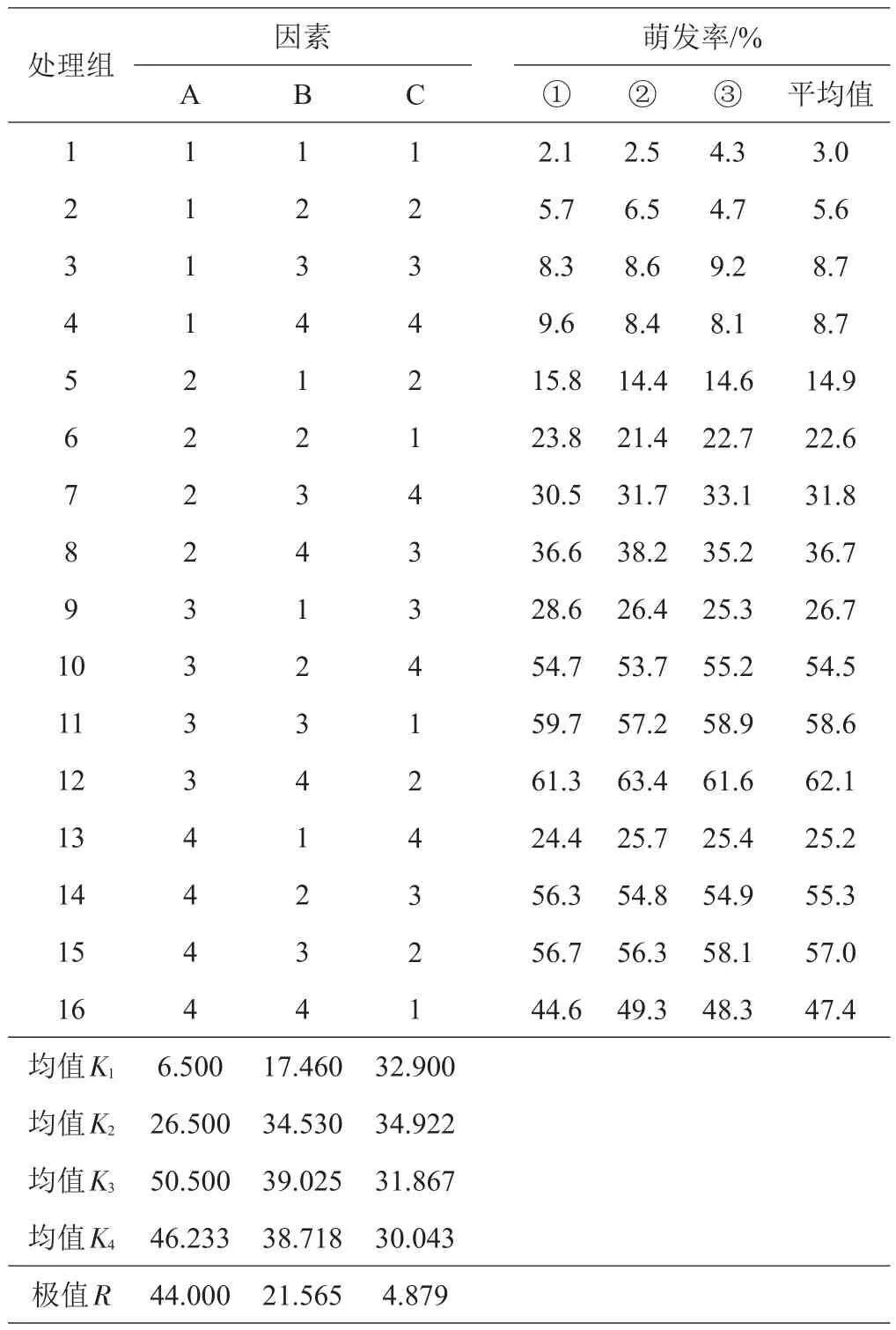
表7 L16(43)正交试验设计表及大丽花花粉萌发率统计结果

表8 SPSSAU的方差分析表
2.4 不同大丽花品种的花粉萌发率比较与分析
采用筛选出的实际最佳培养基组合,即0.05% H3BO3+0.03% CaCl2·2H2O+0.02% MgSO4·7H2O+0.01% KNO3+25 g/L PEG4000+6%蔗糖对22个大丽花品种的花粉萌发率进行检测。采用SPSSAU进行方差分析。结果(表9和图7)显示,不同品种的花粉萌发率全部呈现出显著性差异(F=156.003,P=0.000),花粉萌发率11.75%~78.72%,平均为54.00%;萌发率在70%以上的品种有7个,占检测品种数的31.82%;萌发率在60%~70%的品种3个,占13.64%;萌发率在50%~60%的品种4个,占18.18%;萌发率在40%~50%的品种有3个,占13.64%;萌发率在40%以下的品种有5个,占22.72%。其中‘波彻儿’的花粉萌发率最高(78.72%),而‘兰花公主’的花粉萌发率最低,仅为11.75%。进一步采用事后多重比较,品种两两比较结果差异用字母标注(A~J),从结果可知,除‘波彻儿’和‘回忆’,‘紫珠’和‘绿野仙踪’,‘琳达夫人’和‘简.万.斯卡法拉’,‘芬克里夫的错觉’、‘白色飘雪’和‘疯狂的爱’,‘热情似火’和
‘雪莲花’,‘潇洒’、‘可美大地’和‘紫霞’,‘欢乐万圣节’、‘黄金缕’、‘琳达’和‘爱丁堡’的花粉萌发率标注的字母一样外(P>0.01),其他品种的花粉萌发率两两比较,标注字母均不同,存在显著性差异(P<0.01),说明大丽花花粉活力多样性丰富。

表9 22个大丽花品种的花粉萌发率测定结果

图7 不同大丽花品种花粉萌发情况
采用最短距离法,以花粉萌发率为变量对大丽花进行聚类分析,供试的22个大丽花品种可以分为5个类群(图8)。其中,Ⅰ类群包括了‘琳达夫人’等10个品种,花粉萌发率为63.84%~78.72%,是正常可育品种;Ⅱ类群包括‘雪莲花’等4个品种,花粉萌发率为51.20%~57.25%,是正常可育品种;Ⅲ类群包括‘紫霞’、‘潇洒’、‘可美大地’,花粉萌发率为40.69%~45.02%,为低不育品种;Ⅳ类群包括‘爱丁堡’等4个品种,花粉萌发率为24.78%~29.35%,为半不育品种;Ⅴ类群仅有‘兰花公主’1个品种,花粉萌发率为11.75%,为半不育品种。

图8 不同大丽花花粉萌发率聚类图
3 结论
离体萌发法能够准确直观地反映花粉是否具有活力,是测定大丽花花粉活力有效方法。pH 6.0、培养温度25℃、培养时间2.5 h是大丽花花粉离体萌发最适宜的培养条件。培养基组分对大丽花花粉萌发的影响程度依次为PEG>蔗糖>硼酸,实际最佳处理组合为A3B4C2,即PEG4000 25 g/L、蔗糖60 g/L、硼酸50 mg/L的处理组合。本研究中22个大丽花品种的花粉萌发率为11.75%~78.72%,不同品种的花粉萌发率差异大,可以分为5个类群,其中有14个品种正常可育,杂交时可用作父本;8个品种为半不育或低不育,杂交时更适合作母本。
4 讨论
4.1 大丽花花粉活力测定方法
本研究采用TTC染色法、I2-KI染色法、孢粉染色法和离体萌发法4种方法测定了大丽花花粉活力,结果表明,TTC染液不能使大丽花花粉粒着色,I2-KI和孢粉染液可使所有花粉着色,但是不能区分有活力花粉和败育花粉。染色法简便易行,但该方法是以花粉细胞中的活性物质或者细胞膜的通透性与完整性为基础,受花粉自身特性,如细胞壁的厚薄、细胞外壁成分、细胞内各种酶活性的强弱等的影响较大,其适用性和准确性在不同物种之间的差异极大[23-24]。本试验中,TTC、I2-KI和孢粉染液的染色效果不佳,可能是大丽花花粉外壁太厚或花粉内含物中支链淀粉含量太少等原因造成的。离体萌发法耗时长,但该方法是以花粉萌发并长出花粉管为判断依据,能够准确直观地反映花粉是否具有活力。Stone等[25]指出花粉离体萌发法被普遍认为可以提供植物体内花粉生活力的最佳估计值。本试验的研究结果也表明离体萌发法是测定大丽花花粉活力的有效方法。了解植物的花粉活力状况是杂交育种工作的基础,本研究确定了离体萌发法是大丽花花粉活力的有效测定方法,为促进大丽花人工授粉杂交结实、培育新品种提供了必要的研究基础。但测定花粉活力的方法很多,本研究仅采用了4种测定方法,除离体萌发法,是否还有其他有效测定方法有待于进一步探索。
4.2 不同培养条件对大丽花花粉离体萌发的影响
花粉萌发需要在一定的环境条件下进行。张露等[26]研究发现当pH 5.5、培养温度25℃时矾根的花粉萌发率明显提高,培养120 min时花粉管明显伸长,认为采用适宜的培养条件对矾根的花粉萌发很有必要。詹妮和黄烈健[27]也认为不同培养温度对厚荚相相思花粉的体外萌发影响较大,当培养温度为24℃时,厚荚相相思的花粉萌发效果最好。本研究采用单因素试验研究pH、温度、时间对大丽花花粉离体萌发的影响,结果表明pH 6.0时,大丽花花粉的萌发率较其他pH条件的萌发率高,达到58.37%;在此基础上,给予不同的培养温度,温度过高或过低都不利于大丽花花粉离体萌发,当培养温度为25℃时大丽花花粉的离体萌发率最高,达到59.77%。当培养时间达到2.5 h时大丽花花粉管发生明显伸长。本研究中,在筛选到离体萌发法可以有效测定大丽花花粉萌发的基础上,进一步优化了培养条件,确定了pH 6.0、培养温度25℃、培养时间2.5 h是大丽花品种‘紫珠’花粉离体萌发最适宜的培养条件,但大丽花品种繁多,品种之间具有差异性,该方案是否适用于其他品种还需要进一步研究。
4.3 不同培养基组分对大丽花花粉萌发的影响
花粉离体萌发在人工配制的培养基上进行,受到培养基组分的影响。本研究采用3因素4水平的正交试验来研究蔗糖、PEG、硼酸对大丽花花粉离体萌发的影响,从试验结果可知,3个试验因素对大丽花‘白色飘雪’花粉萌发率的影响程度依次为PEG>蔗糖>硼酸,PEG和蔗糖的影响达到了极显著水平,而硼酸的影响较小;用于大丽花‘白色飘雪’花粉离体萌发的实际最佳组合为A3B4C2,即当PEG含量为25 mg/L、蔗糖含量为60 g/L、硼酸含量为50 mg/L时,‘白色飘雪’花粉离体萌发率达到最高,为62.1%。PEG是一种高分子渗透剂,能够提高细胞膜的柔软程度和通透性,从而促进花粉萌发和花粉管生长[26-28]。前人研究发现,适宜浓度的PEG能促进桔梗[28]、菊花[29-30]、梅花[31]、山茶[32]等植物的花粉萌发。本研究结果也验证了在一定范围内,PEG能显著促进大丽花花粉萌发,最适宜大丽花花粉萌发的PEG浓度为25 g/L,浓度过高反而会抑制花粉的萌发。
蔗糖为花粉离体萌发提供碳源并维持一定的渗透压,它对花粉萌发和花粉管生长具有重要作用。研究表明,在一定范围内,矾根[26]、核桃楸[33]、平榛[34]、淫羊藿[35-36]等植物的花粉萌发率随蔗糖浓度的升高而增加,但蔗糖浓度过高反而会抑制花粉萌发。在本研究中蔗糖浓度设置了0、20、40、60 g/L 4个水平,从正交试验的K值看,最佳的蔗糖浓度为40 g/L,也验证了前人的结论,即蔗糖浓度过低或过高均不利于大丽花花粉的离体萌发,当糖浓度过低时会造成花粉壁破裂,内溶物析出,导致花粉失去生活力,而蔗糖浓度过高时又会造成花粉的质壁分离从而抑制萌发[23,37]。
前人研究表明,由于硼酸能够增加花粉对糖的吸收、转运和代谢,适量的硼酸有利于花粉萌发[19,33,38]。然而,本研究结果表明,硼酸对大丽花花粉的萌发不产生影响或影响极小,这可能是大丽花自身的花柱和柱头内具有足够的硼离子来补偿或者是由于大丽花对硼离子的需求不高造成的。
4.4 不同大丽花品种的花粉活力
花粉萌发率的测定是开花植物学特性研究中的一个重要组成部分,萌发率的高低会影响到植物的授粉、受精和结实。因此,花粉萌发率对引种栽培工作和杂交育种工作的开展具有重要指导意义。本研究在筛选出离体萌发法,以及最适宜的培养条件和培养基组分的基础上,测定了22个大丽花品种的花粉活力,结果表明不同品种的花粉萌发率差异明显,说明大丽花花粉活力多样性丰富。花粉活力能够作为反映雄配子发育状况的一项指标,对花粉活力进行分级,可以将不同品种划分为不同等级的育性,并为后续杂交亲本选配提供依据。一般花粉可育率0%为全不育,小于5%为高不育,6%~30%为半不育,31%~50%为低不育,大于50%为正常可育[21]。根据聚类结果可知,Ⅰ类群和Ⅱ类群的花粉萌发率均大于50%,为正常可育品种,人工杂交授粉时可用作父本;Ⅲ类群的花粉萌发率低于50%、大于30%,为低不育品种,在亲本选配不建议用作父本,更适宜用作母本;Ⅳ类群和Ⅴ类群的花粉萌发率低于30%,为半不育品种,若在杂交育种工作中选作亲本时,需要采取相应的辅助措施才有助于提高杂交结实率。

