基于UPLC-Q-TOF-MS/MS和网络药理学方法探讨五味子藤茎保肝的潜在药效物质及作用机制
曲中原,罗龙坦,张文君,胡 扬,杨小龙,邴一凡,王淇漩,李文兰, 2,邹 翔
基于UPLC-Q-TOF-MS/MS和网络药理学方法探讨五味子藤茎保肝的潜在药效物质及作用机制
曲中原1,罗龙坦1,张文君1,胡 扬1,杨小龙1,邴一凡1,王淇漩1,李文兰1, 2,邹 翔2, 3*
1. 哈尔滨商业大学药学院 中药学专业教研室,黑龙江 哈尔滨 150076 2. 哈尔滨商业大学药学院 药物工程技术研究中心,黑龙江 哈尔滨 150076 3. 哈尔滨宇洲仁泰药物工程研究中心有限公司,黑龙江 哈尔滨 150076
基于高效液相色谱-四极杆飞行时间串联质谱法(UPLC-Q-TOF-MS/MS)分析五味子藤茎的主要成分,并结合网络药理学和分子对接方法预测保肝药效物质和潜在的作用靶点及通路。根据UPLC-Q-TOF-MS/MS二级质谱裂解碎片信息,并结合文献数据,对五味子藤茎化学成分进行分析鉴定;通过中药系统药理学数据库和分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP),从鉴定获得的化学成分中筛选出口服生物利用度(oral bioavailability,OB)≥30%且符合类药五原则的活性成分;运用TCSMP数据库和SwissTargetPrediction数据库查找和预测五味子藤茎的成分靶点;通过在线人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM)、GeneCards数据库和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库筛选疾病靶点。采用String11.5数据库和Cytoscape 3.7.2软件构建PPI网络,并筛选核心靶点。利用DAVID 6.8进行基因本体(gene ontology,GO)注释和KEGG通路富集分析,并通过AutoDockTools 1.5.6软件对五味子藤茎的活性成分与作用靶点进行分子对接验证。构建酒精致肝细胞损伤体外模型,并考察五味子藤茎提取物对肝损伤细胞的保护作用。从五味子藤茎中共鉴定出40个主要成分,包括木脂素类、黄酮类、有机酸类化合物;进一步筛选出活性成分12个,活性成分与疾病交集靶点118个;通过网络拓扑筛选获得核心靶点16个;富集分析发现五味子藤茎保肝作用主要涉及的通路包括:肿瘤坏死因子(tumor necrosis factor,TNF)、丙型肝炎(hepatitis C)、乙型肝炎(hepatitis B)、血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路等。分子对接结果表明,五味子甲素、五味子乙素、五味子丙素、五味子酯甲、槲皮素、戈米辛M2、戈米辛R等成分可与表皮生长因子(epidermal growth factor receptor,EGFR)、磷脂酰肌醇-3-激酶催化亚基α(phosphatidylinositol-3-kinase catalytic subunit alpha isoform,PIK3CA)、TNF、人半胱氨酸-天冬氨酸蛋白酶3(cysteine aspartic protease-3,Caspase-3)等靶点蛋白发生相互作用,结合活性良好。五味子藤茎可抑制酒精引起的人正常肝细胞系L-02存活率降低,降低谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)活性。五味子藤茎具有保肝作用,主要药效物质为木脂素类,可通过多靶点、多通路发挥保肝作用。
五味子藤茎;保肝;活性成分;网络药理学;分子对接;五味子甲素;五味子乙素;五味子丙素;五味子酯甲;槲皮素;戈米辛M2;戈米辛R
肝脏是人体最重要的内脏器官之一,涉及胆汁分泌、解毒排泄、生物代谢与转化、凝血因子合成及免疫等多种重要的生物过程[1]。作为人体最主要的解毒器官,肝脏更易受到各种因素的影响而受到损伤。研究发现,病毒感染、酗酒、药物滥用、高脂饮食、不良情绪等都是引起肝损伤的主要原因。目前,我国仍是全世界肝病患病人数最多和肝病负担最重的国家[2]。因此,保护肝脏对维持人体健康,防治相关疾病发生具有重要意义。现代研究表明,中药凭借其多成分、多靶点的特点,在保肝方面发挥重要的作用。五味子、柴胡、葛根、金银花、龙胆等多种中草药都具有明确的保肝护肝作用[3]。其中,五味子是木兰科植物五味子(Turcz.) Baill的干燥成熟果实,具有收敛固涩、益气生津、补肾宁心之功效[4],是传统的保肝中药,在保肝经典方剂扶正化瘀方以及中成药护肝片中均含有五味子[5-6]。研究发现,五味子藤茎含有与果实相同的木脂素类成分,且含量较高[7]。同时,五味子藤茎木脂素可显著降低四氯化碳(CCl4)急性肝损伤模型小鼠血清谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)活性和三酰甘油(triacylglycerol,TG)水平;五味子藤茎木脂素和多糖可显著升高肝脏中超氧化物歧化酶的活性,降低肝脏中丙二醛的含量,进而发挥保肝作用[8]。进一步研究发现,五味子藤茎提取物可降低肝纤维化模型大鼠血清及肝组织中透明质酸、层黏连蛋白、Ⅲ型前胶原水平,进而发挥抗肝纤维化的作用,且其机制可能与降低肝组织转化生长因子-β1(transforming growth factor-β1,TGF-β1)和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的表达水平,与抑制肝星状细胞的活化和阻止肝纤维化时细胞外基质的产生和蓄积有关[9]。上述研究均表明,五味子藤茎也具有较好的保肝作用,具有一定的开发应用前景。但在以往的种植过程中,为了五味子的增产,每年大量的五味子藤茎被剪枝丢弃,造成了资源的极大浪费[10]。
本研究采用UPLC-Q-TOF-MS/MS技术分析五味子藤茎的化学成分,利用网络药理学及分子对接等手段探究其保肝作用的靶点和分子机制,为五味子藤茎这一药用资源的合理开发利用提供科学依据。
1 材料
1.1 细胞
人正常肝细胞系L-02,由哈尔滨商业大学抗肿瘤天然药物教育部工程研究中心提供。
1.2 药品与试剂
五味子藤茎采于黑龙江中医药大学药用植物园,经哈尔滨商业大学药学院曲中原教授鉴定为木兰科植物五味子(Turcz.) Baill的藤茎;对照品五味子醇甲(MUST-18031905,质量分数99.46%)、戈米辛J(MUST-18041102,质量分数98.28%)、戈米辛M2(MUST-18010412,质量分数98.75%)均购自成都曼斯特生物科技有限公司;对照品五味子醇乙(AM407S)、五味子甲素(AM268S)、五味子乙素对照品(AB266S)、五味子丙素(AM509W)、五味子酯甲(批号MUST-18041108),购自天津一方科技有限公司,质量分数均≥98%;色谱甲醇、乙腈购自德国默克公司;色谱甲酸购自美国Fisher公司;PBS缓冲液、胰蛋白酶、胎牛血清、RPMI 1640培养液购自美国Gibco公司;DMSO购自天津巴斯夫化工有限公司;青链霉素双抗购自美国Hyclone公司;ALT测定试剂盒、AST测定试剂盒购自南京建成生物工程研究所;联苯双酯(内蒙古兰太药业有限责任公司);水为屈臣氏蒸馏水,其他试剂均为分析纯。
1.3 仪器
ACQUITY UPLC(美国Waters公司);AB SCEIX Triple-TOFTM 5600型质谱仪(美国应用生物系统公司);CO-150型二氧化碳培养箱(美国NBS公司);iMark酶标仪(上海伯乐生命医药产品有限公司);Olympus CKX41SF型倒置显微镜(日本Olympus公司);超低温冰箱(英国NBS公司)。
1.4 数据库与软件
中药系统药理学数据库和分析平台(TCMSP,https://tcmspw.com/index.php),PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/);SwissTargetPred iction数据库(http://www.swisstargetprediction.ch/);在线人类孟德尔遗传数据库(OMIM,http://www. omim.org/);GeneCards数据库(https://www.gene cards.org/);KEGG数据库(http://www.kegg. jp/);UniProt数据库(https://www.uniprot.org/);DAVID 6.8数据库(https://david.ncifcrf.gov/);蛋白结构数据库(PDB,http://www.rcsb.org/);Cytoscape 3.7.2软件;AutoDockTools1.5.6软件;PyRx0.8软件;PyMOL2.1.1软件;GraphPad Prism 8.0。
2 方法
2.1 供试品溶液的制备
2.1.1 五味子藤茎样品溶液 称取五味子藤茎1 g,加10倍量的乙醇回流提取2 h,之后取滤渣再提取1 h,合并2次滤液,浓缩。取浸膏加乙腈复溶,25 mL量瓶定容,制成质量浓度为0.04 g/mL五味子藤茎供试品溶液,经0.22 μm微孔滤膜滤过,备用。
2.1.2 对照品溶液 精密称取五味子醇甲、五味子醇乙、五味子甲素、五味子乙素、五味子丙素、五味子酯甲、戈米辛J、戈米辛M2对照品各1 mg,分别加甲醇超声溶解,5 mL量瓶定容,制成0.2 mg/mL的对照品溶液。
2.2 色谱条件
色谱柱:ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm)色谱柱,流动相为0.1%甲酸水(A)-乙腈(B),梯度洗脱:0~3 min,23% B;3~7 min,23%~40% B;7~8 min,40%~42% B;8~11.5 min,42%~55% B;11.5~13 min,55%~65% B;13~14.5 min,65%~75% B;14.5~19 min:75%~100% B;19~28 min:100%~23% B。体积流量0.2 mL/min,柱温35 ℃,进样量5 μL,检测波长216 nm。
2.3 质谱条件
离子化模式为电喷雾正、负离子模式,正负离子源电压分别为5500 V和−4500 V,离子源温度为550 ℃,裂解电压(DP)分别为80、−80 V,碰撞能量分别为35、−35 eV,碰撞能量扩展分别为15、−15 eV。雾化气(gas1)为380 kPa,辅助气(gas 2)为35 kPa,气帘气(curtain gas)为240 kPa。一级质谱母离子扫描范围为/80~1500,IDA设置响应值超过100 cps的8个最高峰进行二级质谱扫描,子离子扫描范围为/50~1500。
2.4 基于网络药理学五味子藤茎保肝作用机制预测
选取鉴定的全部五味子藤茎成分为目标成分,将其分别输入TCMSP和SwissTargetPrediction数据库,根据口服生物利用度(oral bioavailability,OB)≥30%条件和Lipinski类药五原则筛选其活性成分[11-12]。采用TCMSP数据库和SwissTargetPrediction数据库查找和预测成分靶点,合并去重后获得五味子藤茎成分靶点。采用OMIM、GeneCards、KEGG数据库,以“hepatitis”与“hepatic injury”为关键词检索,获取与肝炎和肝损伤相关的疾病靶点,选择score≥3.26的靶点作为疾病靶点[13-15]。采用Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/index.html)将成分靶点和疾病靶点取交集,获得交集靶点。将交集靶点导入String(https://string-db.org/cgi/input)数据库[16],获得靶点间相互作用关系并导入Cytoscape 3.2.1软件,构建蛋白质-蛋白质互作(PPI)网络,同时计算degree值,并按>2倍degree中位数条件筛选获得核心靶点。采用DAVID 6.8数据库对靶点进行GO生物过程富集分析和KEGG通路分析[17],并采用OmicShare云平台进行数据可视化。最终,构建五味子藤茎保肝作用的“活性成分-核心靶点-通路”关联网络。
2.5 分子对接验证
将上述筛选获得的活性成分与核心靶点依次进行分子对接。首先在PubChem数据库下载活性成分2D结构的sdf格式文件,在RCSB数据库下载核心靶点蛋白3D结构pdb格式文件。进一步使用Autodock Tools1.5.6对蛋白和成分数据进行加氢、除水等处理并保存为pdbqt格式。采用Vina和PyMoL2.1.1软件对活性成分和靶点蛋白进行对接打分,并以对接评分Affinity评价对接结果[18-19]。采用GraphPad Prism8.0和PyMoL2.1.1进行结果的可视化。
2.6 五味子藤茎对乙醇诱导的人正常肝细胞L-02损伤的保护作用研究
收集对数生长期L-02细胞,计数并配制成浓度为3×105个/mL的细胞悬液,接种于96孔板内,每孔加100 μL,培养24 h,弃去培养液,加入含不同浓度(1%、2%、3%、4%、5%、6%)乙醇的完全培养基,分别培养12、24、48 h后,以MTT法于510 nm采用酶标仪检测吸光度()值,计算细胞存活率。进一步以3%乙醇造模(除对照组),细胞接种后培养24 h后,随机设立6组(对照组、模型组、阳性对照组和3个给药组),每组6个复孔。对照组加入同体积完全培养基,阳性对照组加入联苯双酯(终质量浓度10 μg/mL),给药组加入五味子藤茎提取物(终质量浓度25、50、100 μg/mL),培养24 h后以MTT法于510 nm采用酶标仪检测值,计算细胞存活率。按相同方法接种和给药,并按照试剂盒说明书分别测定联苯双酯(10 μg/mL)和五味子藤茎提取物(100 μg/mL)对细胞上清液ALT和AST活性的影响。
2.7 统计学分析
3 结果
3.1 五味子藤茎化学成分的鉴定
采用UPLC-Q-TOF-MS/MS技术对五味子藤茎中的化学成分进行定性分析,总离子流图见图1。通过一级和二级质谱信息分析并结合相关文献,从五味子藤茎样品图谱中共鉴定和表征出40个化学成分,主要为木脂素类、有机酸类、黄酮类和倍半萜类成分(表1)。对7种成分的二级质谱图及其对照品进行了对比,其中五味子酯甲和五味子乙素对照品的镜像对比图谱见图2。
3.2 基于网络药理学五味子藤茎保肝作用机制的预测结果
3.2.1 五味子藤茎活性成分筛选及其作用靶点预测针对上述鉴定获得的五味子藤茎中的40个化学成分,采用TCMSP数据库查找OB≥30%且满足Lipinski类药五原则的成分,结合文献报道共筛选获得活性成分12个(表2)。进一步采用TCMSP数据库和SwissTargetPrediction数据库分别查找和预测获得成分靶点456和502个,删除重复靶点后共得到成分靶点504个。
表1 五味子藤茎化学成分鉴定分析
Table 1 Identification and analysis of chemical constituents in SCRS
峰号tR/min误差(×10−6)离子模式理论值检测值离子碎片分子式化合物 10.92−3.00[M-H]−354.309 0353.037 8317, 299, 257, 153C16H18O9新绿原酸 21.30−3.20[M-H]−192.124 0191.018 7173, 110C6H8O7柠檬酸 31.605.99[M-H]−154.120 0153.019 3108C7H6O4原儿茶酸 42.603.10[M-H]−122.121 0121.031 3108C7H6O2对羟基苯甲醛 54.304.40[M-H]−290.268 1289.071 8205, 187, 159, 137, 121C15H14O6儿茶素 65.600.74[M-H]−280.316 0279.122 9217, 189C15H20O5psilostachyin A 76.41−1.80[M-H]−168.147 0167.035 0149, 131C8H8O4香草酸 86.798.74[M-H]−462.404 0461.111 2416, 254C22H22O11异山梨醇 97.493.22[M-H]−264.317 0263.128 6245, 201, 174C15H20O4脱落酸 109.801.20[M-H]−228.371 0227.201 7209, 191, 146C14H28O2myristic acid 1112.304.90[M-H]−270.236 9269.045 8252, 224, 169C15H10O5芹菜素 1226.060.70[M-H]−470.684 0469.346 7451, 433, 405, 377C30H46O4nigranoic acid 131.43−1.26[M+H]+126.045 5127.038 898, 82C6H6O33-羟甲基-2-糠醛 145.690.16[M+H]+610.518 0611.160 7593, 578, 550, 507, 478, 458C27H30O16芦丁 155.92−0.49[M+H]+302.236 0303.049 7285, 270C15H10O7槲皮素 166.81−0.93[M+H]+196.286 0197.153 4179, 161, 146, 131C12H20O2neryl acetate 1710.200.45[M+H]+418.480 0419.206 6369, 324, 295C23H30O7戈米辛S/T 1810.20−1.00[M+H]+418.199 0419.206 6401, 386, 370, 355C23H30O7henricine A 1912.740.77[M+H]+326.386 0327.159 3283, 203, 188, 171C20H22O4里卡灵A 2012.960.52[M+H]+416.464 0417.196 7399, 385, 357, 314, 285, 265C23H28O7五味子醇乙* 2112.96−0.80[M+H]+390.500 0391.211 3327, 257C22H30O6前戈米辛 2213.10−4.80[M+H]+388.454 0389.194 0357, 325, 301C22H28O6戈米辛J 2313.450.07[M+H]+530.564 0531.222 5485, 401, 383, 353, 341C28H34O10戈米辛D 2413.451.40[M+H]+530.607 0531.222 5501, 483, 437C29H38O9当归酰戈米辛Q 2513.960.51[M+H]+416.184 0433.222 3415, 400, 384, 369, 338C24H32O7五味子醇甲* 2614.73−3.46[M+H]+500.588 0501.246 5483, 452, 437, 427, 414C28H36O8巴豆酰戈米辛H 2714.74−0.12[M+H]+498.565 0499.232 5481, 463, 439, 421, 403C28H34O8当归酰(异)戈米辛O 2814.80−4.71[M+H]+522.594 0523.230 1508, 493, 409, 393C30H34O8苯甲酰戈米辛H 2915.080.81[M+H]+432.154 0431.206 7400, 372, 356C24H30O7schinsanlignone A 3015.28−3.80[M+H]+536.570 0537.209 8519, 476, 406C30H32O9五味子酯甲* 3116.000.72[M+H]+386.438 0387.180 2372, 355, 325, 285C22H26O6戈米辛R 3216.020.72[M+H]+386.444 0387.180 2372, 355, 324, 285C22H26O6戈米辛M2* 3316.81−0.49[M+H]+524.688 0525.321 1407, 489, 465, 447C32H44O6schisanbilactone A 3417.070.73[M+H]+416.510 0417.227 4402, 371, 315C24H32O6五味子甲素* 3517.32−1.09[M+H]+204.351 1205.194 8149, 135, 107C15H24calarene 3617.582.14[M+H]+400.464 8401.196 7386, 370, 300, 285, 269C23H28O6五味子乙素* 3717.582.14[M+H]+400.189 0401.196 7383, 368, 354C23H28O6γ-五味子醇甲 3817.80−4.94[M+H]+520.570 0521.214 4421, 399, 368, 353, 337C30H32O8苯甲酰戈米辛O 3917.81−3.80[M+H]+384.422 0385.164 6355, 285, 257, 242, 212C22H24O6五味子丙素* 4019.02−0.28[M+H]+470.684 0471.346 7453, 435, 417C30H46O4kadsuric acid
*对照品比对的化合物
*compounds aligned against controls
3.2.2 疾病靶点的获得 在OMIM、GeneCards和KEGG等3个数据库中,以“hepatitis”与“hepatic injury”为关键词检索疾病靶点,选择score≥3.26的靶点作为潜在疾病靶点。合并3个数据库的结果,并删除重复项后得到1037个靶点。采用Venny 2.1.0在线平台将成分靶点与疾病靶点取交集,获得交集靶点118个,作为五味子藤茎保肝作用的潜在靶点(图3)。
表2 五味子藤茎有效成分信息
Table 2 Information of effective components of SCRS
编号化合物CAS号分子式 1五味子甲素61281-38-7C24H32O6 2五味子乙素69176-52-9C23H28O6 3五味子丙素61301-33-5C22H24O6 4五味子醇乙58546-54-6C23H28O7 5五味子酯甲58546-56-8C30H32O9 6当归酰(异)戈米辛O83864-70-4C28H34O8 7戈米辛M282425-45-4C22H26O6 8戈米辛R82467-50-3C22H26O6 9里卡灵A51020-86-1C20H22O4 10南五味子酸62393-88-8C30H46O4 11肉豆蔻酸544-63-8C14H28O2 12槲皮素117-39-5C15H10O7
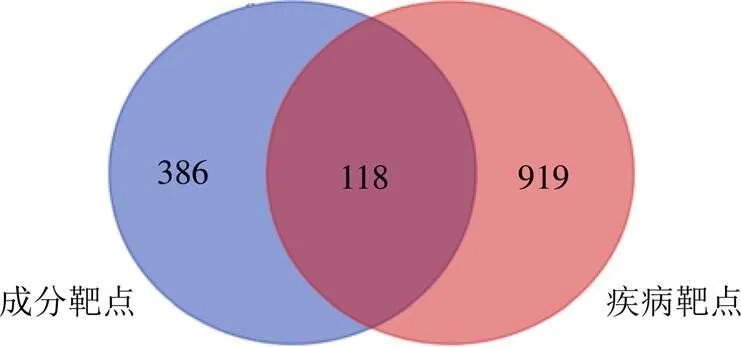
图3 成分靶点与疾病靶点韦恩图
3.2.3 PPI网络的构建及核心靶点筛选 将交集靶点导入String11.5数据库,获得靶点间相互作用关系,保存为TSV文件。进一步将数据导入Cytoscape 3.2.1软件,构建PPI网络(图4)并筛选获得大于2倍degree值的核心靶点16个,包括肿瘤坏死因子(tumor necrosis factor,TNF)、磷脂酰肌醇-3-激酶催化亚基α(phosphatidylinositol-3-kinase catalytic subunit alpha isoform,PIK3CA)、人半胱氨酸-天冬氨酸蛋白酶3(cysteine aspartic protease-3,Caspase 3)、丝氨酸/苏氨酸蛋白激酶AKT(serine/threonine- protein kinase AKT,AKT1)、信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)、原癌基因酪氨酸蛋白激酶(proto- oncogene tyrosine-protein kinase,SRC)等。
3.2.4 富集分析及“成分靶标通路功能”网络的构建 采用DAVID6.8数据库对五味子藤茎保肝的16个核心靶点进行GO功能富集分析和KEGG通路分析。根据FDR≤0.05筛选共获得了317个GO条目,包括226个生物学过程(bioprogress,BP)条目,29个细胞组分(cell components,CC)条目和62个分子功能(molicular function,MF)条目,取前20个条目上传至OmicShare 云平台进行可视化,结果见图5-A。结果表明,上述核心靶点参与的生物学过程主要包括:信号转导(signal transduction)、对RNA聚合酶II启动子的转录正调节(positive regulation of transcription from RNA polymerase II promoter)等。KEGG富集分析共获得FDR≤0.05的通路120条,取前20条最显著的通路进行可视化分析,结果见图5-B。结果表明,与五味子藤茎保肝作用密切相关的信号通路主要包括PI3K-Akt信号通路(PI3K-Akt signaling pathway)、血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路(VEGF signaling pathway)、FoxO信号通路(FoxO signaling pathway)、HIF-1信号通路(HIF-1 signaling pathway)等。进一步构建了五味子藤茎保肝作用的“活性成分-靶基因-通路”网络,结果见图6。
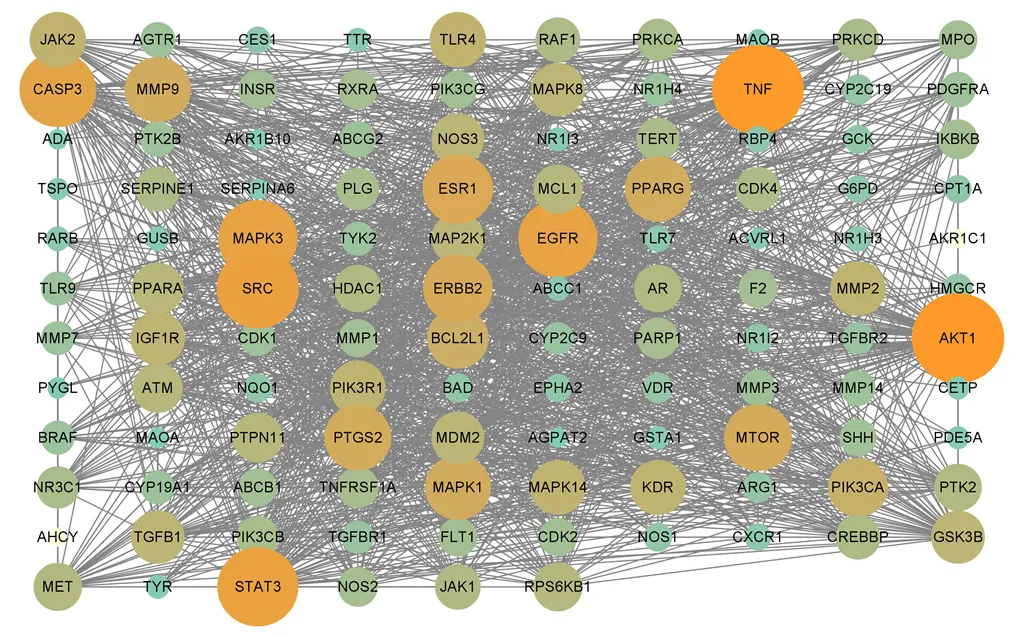
图4 交集靶点的PPI网络

图5 GO (A) 和KEGG (B) 富集分析结果
3.3 分子对接验证
将筛选出的16个核心靶点与12个活性成分依次进行分子对接。对接结果(图7)显示,大于−4.25 kJ/mol的结果占总数的94%,−4.25~−7.00 kJ/mol的结果占总数的49%,大于−7.00 kJ/mol的结果占总数的45%,所有活性成分(除肉豆蔻酸外)均大于−4 kJ/mol。各成分(除肉豆蔻酸外)与EGFR、PIK3CA、CASP3、RXRA和TNF均具有良好的结合活性,其中五味子酯甲、五味子甲素、五味子丙素、五味子乙素、槲皮素、戈米辛M2和戈米辛R显示出强烈结合活性。五味子甲素可与EGFR、PIK3CA和MAPK3发生相互作用,又以与PIK3CA结合活性最好,主要作用于其残基苯丙氨酸(Phe)930、酪氨酸(Tyr)936、异亮氨酸(Ile)932和天冬氨酸(Asp)933。戈米辛M2可与EGFR和TNF等发生相互作用,与TNF结合时,作用于其残基谷氨酰胺(Gln)102和丝氨酸(Ser)99。五味子丙素与PIK3CA结合时,作用于其残基天冬氨酸(Asn)677、赖氨酸(Lys)678、苏氨酸(Thr)471和丝氨酸(Ser)474。五味子乙素与RXRA结合时,作用于其残基Lys232和Ile236。五味子酯甲与MAK3结合时,作用于其残基精氨酸(Arg)41、缬氨酸(Val)205和半胱氨酸(Cys)42。槲皮素与PIK3CA结合时,作用于其残基甘氨酸(Gly)1007、Ser1008和脯氨酸(Pro)447(图8)。

三角形-活性成分 椭圆形-核心靶点 长方形-信号通路
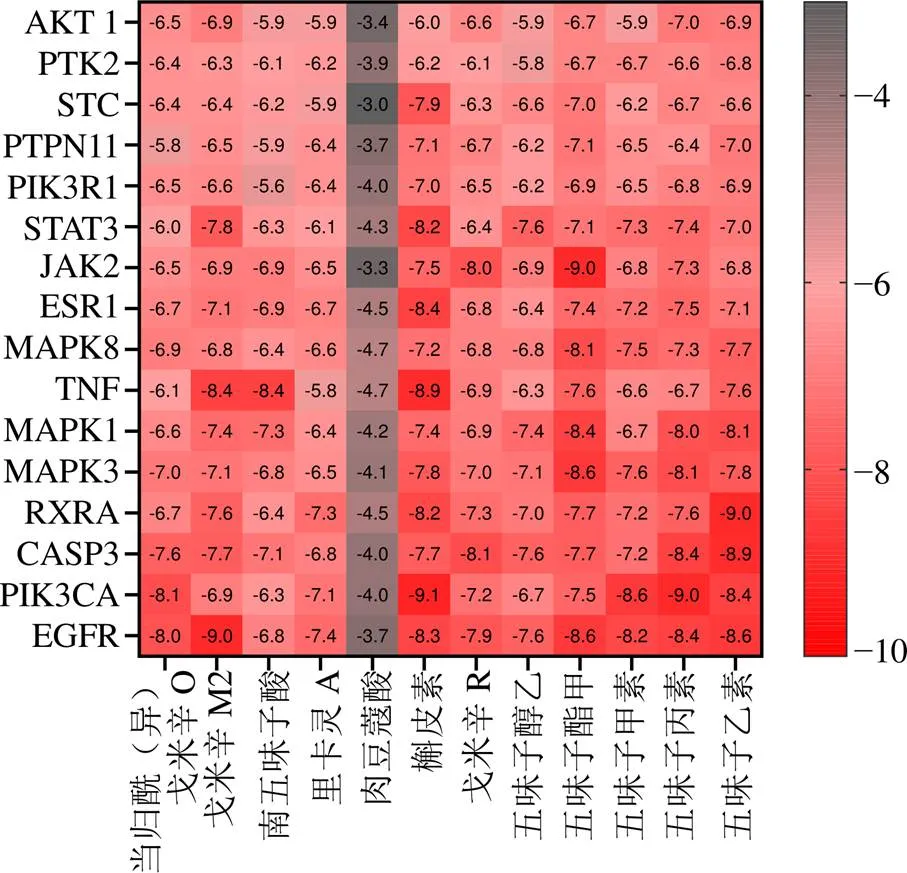
图7 分子对接分数的热图分析
3.4 五味子藤茎对乙醇诱导的人正常肝细胞L-02损伤的保护作用
不同浓度的乙醇作用L-02细胞后,随着时间的延长,细胞存活率逐渐降低,呈现时间和剂量相关性(图9-A)。而50、100 μg/mL的五味子藤茎乙醇提取物作用24 h可显著升高细胞存活率(<0.05,0.01),见图9-B。与空白对照组相比,模型组ALT和AST显著升高(<0.01),而100 μg/mL的五味子藤茎乙醇提取物作用24 h可显著降低乙醇引起的ALT和AST的升高,与模型组比较差异具有统计学意义(<0.01)。
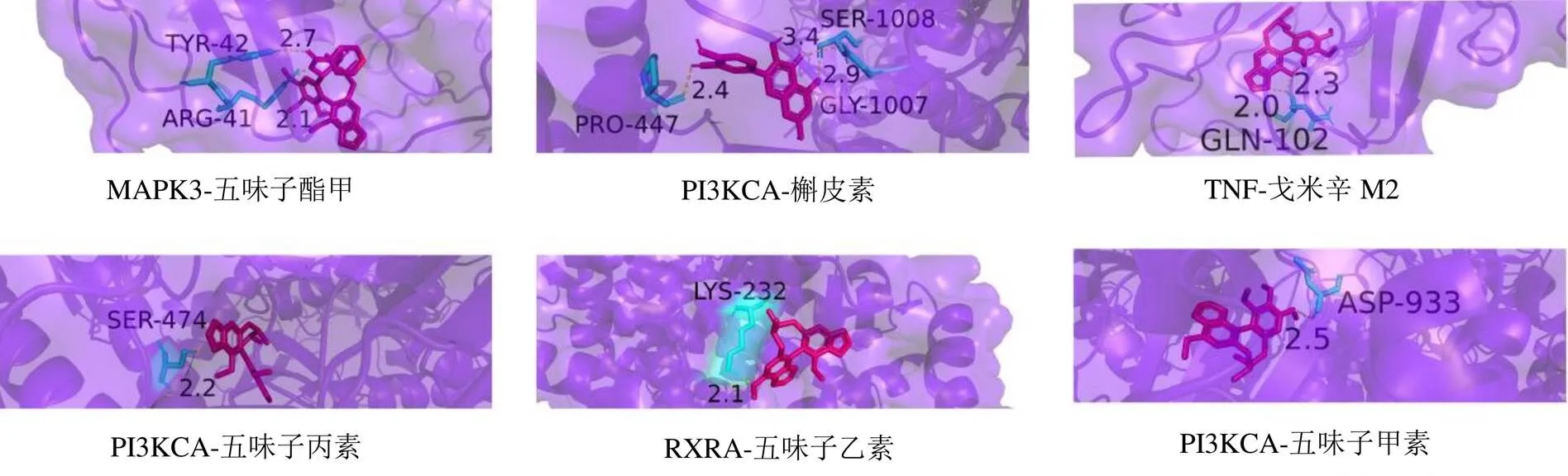
图8 部分活性成分与靶点分子对接模式
4 讨论
五味子种植过程中每年修剪掉大量的藤茎,这部分资源尚未被合理开发利用。本研究系统分析五味子藤茎的主要成分,并结合网络药理学和分子对接方法预测保肝药效物质和潜在的作用靶点及通路,为五味子藤茎的开发利用提供依据。研究表明,五味子藤茎提取物可显著降低小鼠血清中ALT、AST水平,对CCl4致肝损伤小鼠发挥保护作用[20]。本研究也证实五味子藤茎提取物对酒精致损伤的L-02细胞模型具有一定的保护作用,且可显著降低ALT、AST活性,说明其抗肝损伤作用是明确的。在此基础上,本实验采用UPLC-Q-TOF-MS/MS技术共从五味子藤茎乙醇提取物种中鉴定40个化学成分。根据OB值≥30%及类药五原则标准,最终筛选获得12种活性成分,其中有9个为木脂素类成分,表明木脂素可能是五味子藤茎防治肝病的主要药效物质。
近年来,网络药理学在中药及复方有效成分筛选、靶点及通路的预测方面得到了广泛应用,减少了研究的盲目性、提高了药物发现的效率[21-22]。分子对接技术则通过将成分与靶点蛋白相结合,以虚拟评价的方式验证网络药理学的预测结果[23]。本研究进一步采用网络药理学方法对筛选获得的五味子藤茎活性物质保肝作用的潜在靶点及通路进行了研究,结果发现上述12个活性成分主要作用于STAT3、EGFR、AKT1、TNF、PIK3CA、CASP3、MAPK8等16个核心靶点。分子对接结果发现,除肉豆蔻酸外,其余11种成分均与EGFR、PIK3CA、CASP3、MAPK3、TNF 5种核心靶点蛋白具有强烈的结合活性(结合能>−4 kJ/mol)。
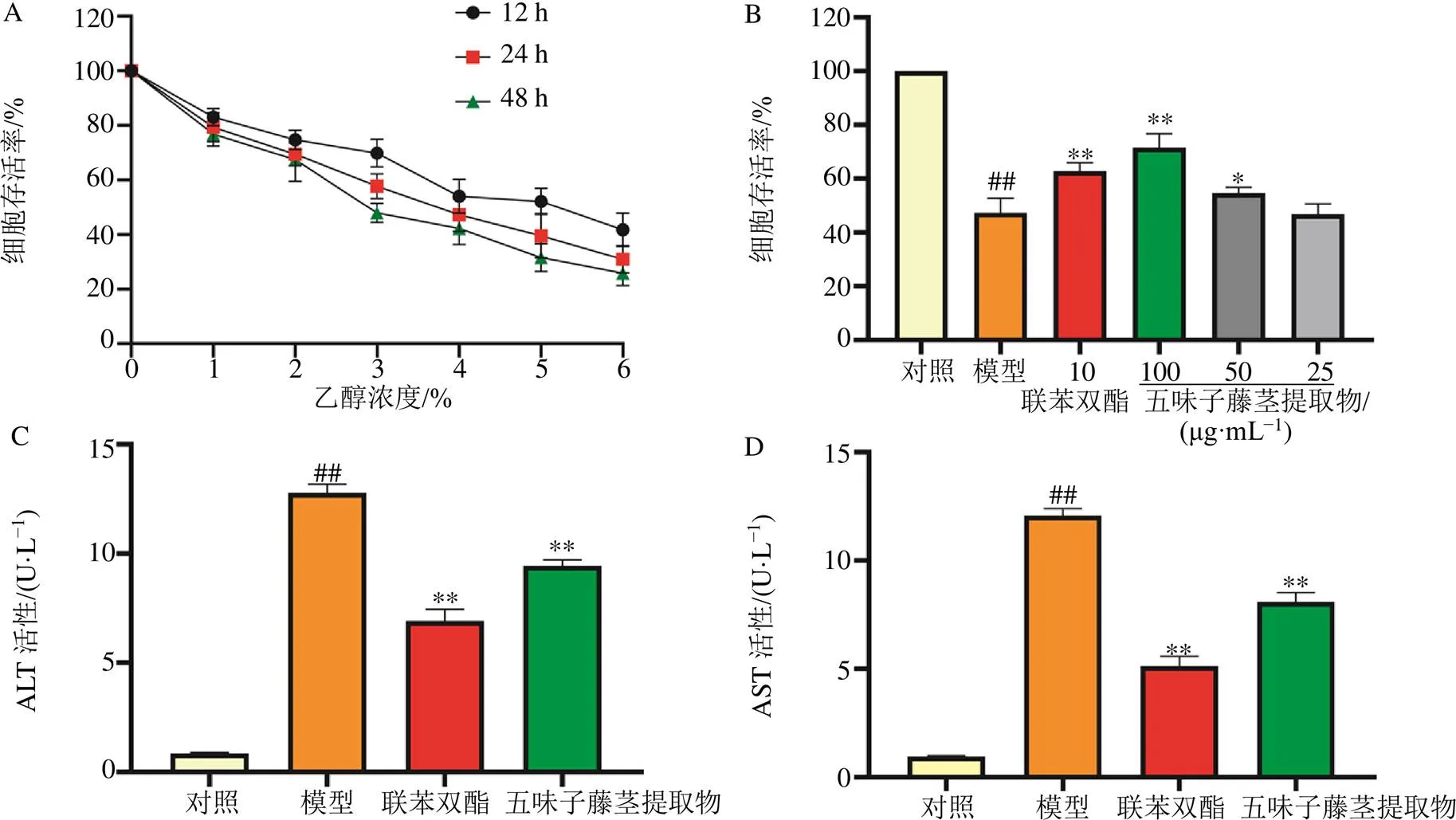
与对照组比较:##P<0.01;与模型组比较:*P<0.05 **P<0.01
通过“活性成分-靶基因-通路”网络分析,PI3K-Akt、VEGF、FoxO、HIF-1等信号通路是五味子藤茎活性成分保肝作用的主要通路。研究显示,PI3K-Akt信号通路与肝炎、肝损伤有关[24]。而五味子酯甲能通过抑制胶质细胞内MAPKs和PI3K/Akt通路参与介导的炎症反应[25-26]。VEGF信号通路和HIF-1信号通路参与肝纤维化过程[27]。五味子乙素则可通过下调VEGF信号通路血管新生因子VEGF-A、EGF和bFGF的表达,诱导肝癌细胞HCCLM3的凋亡[28]。FoxO信号通路中FoxO1通过增加脂联素受体2和微粒体甘油三酯转运蛋白的表达,从而抑制酒精性肝损伤的恶化,而五味子甲素对Akt/FoxO信号通路具有一定的影响[29-30]。此外,KEGG通路富集结果中显示,肝损伤涉及的通路还包括TNF、NF-κB、STAT3/Akt/MAPK等信号通路。研究表明,五味子甲素、五味子乙素、五味子丙素、五味子醇甲、五味子醇乙均可通过NF-κB信号通路抑制细胞色素P4502E1诱导的氧化应激,减轻肝损伤。五味子酯甲则通过抑制TAK1/MAPK和NF-κB信号通路相关蛋白表达改善肝纤维化[31]。此外,五味子醇乙主要通过调控STAT3/Akt/MAPK信号通路下调炎症因子白介素-6表达起到保肝作用[32]。
综上,本研究首次采用UPLC-Q-TOF-MS/MS结合网络药理学和分子对接技术明确了五味子藤茎保肝作用的药效物质基础、潜在作用靶点及通路,为合理利用五味子藤茎资源研发具有保肝作用的大健康产品提供了科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 江晓妮, 刘敏, 李强, 等. 肝硬化异常脾脏对肝脏病理生理功能的影响 [J]. 临床肝胆病杂志, 2018, 34(11): 2420-2422.
[2] Xiao J, Wang F, Wong N K,. Global liver disease burdens and research trends: Analysis from a Chinese perspective [J]., 2019, 71(1): 212-221.
[3] 熊溢, 张明军. 保肝护肝中药及其产品研发的现状与展望 [J]. 中兽医医药杂志, 2019, 38(5): 98-102.
[4] 中国药典[S]. 一部. 2020: 68.
[5] 薛静波, 陶艳艳, 刘成海. 扶正化瘀方体外给药方法及生物活性差异的探讨[J]. 世界中医药, 2020, 15(19): 2835-2842.
[6] Sha J Y, Lu J, Sun M H,. Systematic review and meta-analysis of Hugan Tablets in the treatment of drug-induced liver injury [J]., 2020, 6(2): 8-25.
[7] 李国成, 邱凯锋, 刘恩桂, 等. 北五味子藤茎的化学成分研究 [J]. 中药材, 2006, 29(10): 1045-1047.
[8] 丁传波, 刘群, 董岭, 等. 五味子藤茎中木脂素和多糖对小鼠急性肝损伤的保护作用 [J]. 华西药学杂志, 2014, 29(6): 648-650.
[9] 胡彦武, 刘凯, 闫梦彤, 等. 五味子藤茎提取物抗大鼠肝纤维化作用及机制探讨 [J]. 中国实验方剂学杂志, 2016, 22(17): 122-125.
[10] 刘艳, 陈张林, 吴丹丹, 等. 五味子藤茎中萜类和木脂素类成分的研究 [J]. 中成药, 2021, 43(6): 1484-1493.
[11] 牛明, 张斯琴, 张博, 等. 《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[12] Daina A, Michielin O, Zoete V. SwissADME: A free web tool to evaluate pharmacokinetics, drug-likeness and medicinal chemistry friendliness of small molecules [J]., 2017, 7: 42717.
[13] Marilyn S, Irina D, Justin A,GeneCards Version 3: the human gene integrator [J]., 2010, doi: 10.1093/database/baq020.
[14] Amberger J S, Hamosh A. Searching online Mendelian inheritance in man (OMIM): A knowledgebase of human genes and genetic phenotypes [J]., 2017, doi: 10.1002/cpbi.27.
[15] Kanehisa M, Furumichi M, Sato Y,. KEGG: integrating viruses and cellular organisms [J]., 2021, 49(D1): D545-D551.
[16] Szklarczyk D, Gable A L, Lyon D,. STRING v11: Protein-protein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets [J]., 2019, 47(D1): D607-D613.
[17] Huang D W, Sherman B T, Lempicki R A. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources [J]., 2009, 4(1): 44-57.
[18] Goodsell D S, Zardecki C, di Costanzo L,. RCSB Protein Data Bank: Enabling biomedical research and drug discovery [J]., 2020, 29(1): 52-65.
[19] Zhang Y Q, Sanner M F. AutoDock CrankPep: Combining folding and docking to predict protein-peptide complexes [J]., 2019, 35(24): 5121-5127.
[20] 胡彦武, 于俊林. 五味子藤茎提取物急性毒性试验及对小鼠试验性肝损伤的保护作用 [J]. 中国实验方剂学杂志, 2011, 17(15): 172-174.
[21] 邹翔, 张月, 汲晨锋, 等. 基于网络药理学的青龙衣抗肿瘤潜在分子机制探讨 [J]. 哈尔滨医科大学学报, 2019, 53(5): 459-464.
[22] 戚璐, 徐俊, 许杰, 等. 基于网络药理及分子对接探讨茵陈五苓散治疗原发性胆汁性胆管炎的作用机制 [J].世界中医药, 2021, 16(2): 206-214.
[23] 武建平, 李文兰, 曲中原, 等. 基于网络药理学探讨桦褐孔菌降血糖功效成分及作用机制 [J]. 食品工业科技, 2021, 42(22): 18-29.
[24] 牛艳邦, 王晓玲, 陈晨, 等. 二甲双胍抑制PI3K-AKT-mTOR信号通路对四氯化碳诱导的小鼠急性肝损伤的影响[J]. 中国生物制品学杂志, 2021, 34(9): 1062-1068.
[25] Li C W, Chen T K, Zhou H F,. Schisantherin A attenuates neuroinflammation in activated microglia: Role of Nrf2 activation through ERK phosphorylation [J]., 2018, 47(5): 1769-1784.
[26] 谭晖, 王吉昌, 董丹凤, 等. 五味子酯甲通过抑制CCAT1和PI3K-AKT信号通路抑制肺癌细胞的迁移和侵袭[J]. 世界中医药, 2021, 16(13): 1966-1971.
[27] Zou X, Tang X Y, Qu Z Y,. Targeting the PDGF/PDGFR signaling pathway for cancer therapy: A review [J]., 2022, 202: 539-557.
[28] 彭朝阳, 贾廷印, 李好朝, 等. 五味子乙素对肝癌细胞凋亡、侵袭及血管新生的调节作用 [J]. 中国免疫学杂志, 2019, 35(3): 287-291.
[29] 孙智, 周俊英. SIRT1-FoxO1-AdipoR2信号轴在酒精性脂肪性肝病中的作用机制 [J]. 中华肝脏病杂志, 2016, 24(11): 877-880.
[30] Yeon M, Choi H, Jun H S. Preventive effects of schisandrin A, a bioactive component of, on dexamethasone-induced muscle atrophy [J]., 2020, 12(5): E1255.
[31] Wang H L, Che J Y, Cui K,. Schisantherin A ameliorates liver fibrosis through TGF-β1mediated activation of TAK1/MAPK and NF-κB pathwaysand[J]., 2021, 88: 153609.
[32] Li X, Sun J H, Fan X M,. Schisandrol B promotes liver regeneration after partial hepatectomy in mice [J]., 2018, 818: 96-102.
Potential pharmacodynamic substances and mechanism ofrattan stems in liver protection based on UPLC-Q-TOF-MS/MS and network pharmacology
QU Zhong-yuan1, LUO Long-tan1, ZHANG Wen-jun1, HU Yang1, YANG Xiao-long1, BING Yi-fan1, WANG Qi-xuan1, LI Wen-lan1, 2, ZOU Xiang2, 3
1.Teaching and Research Department of Chinese Pharmacy, College of Pharmacy, Harbin University of Commerce, Harbin 150076, China 2. Pharmaceutical Engineering Technology Research Center, College of Pharmacy, Harbin University of Commerce, Harbin 150076, China 3. Harbin Yuzhou Rentai Pharmaceutical Engineering Research Center Co., Ltd., Harbin 150076, China
To analyze the main components ofrattan stems (SCRS) by ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry (UPLC-Q-TOF-MS/MS), and predict the hepatoprotective substances and potential targets and signaling pathways by network pharmacology and molecular docking.According to the fragmentation of secondary mass spectrometry and literature data, the chemical constituents of SCRS were analyzed and identified. The active components with OB ≥ 30% in accordance with the five principles of drugs were screened through the TCMSP database. The potential targets of active components of SCRS were checked in TCMSP database and predicted by SwissTargetPrediction online platform. The “hepatitis” and “liver injury” were selected as key words to screen disease targets with OMIM, GeneCards and KEGG databases. PPI network was constructed using String11.5 database and Cytoscape 3.7.2 software, and core targets were screened. DAVID 6.8 database was used for gene ontology (GO) anotation and KEGG pathway enrichment analysis. AutoDockTools 1.5.6 software was used to verify the molecular docking between the active components and the key targets of SCRS. Themodel of liver cell injury was established and the protective effect of SCRS extract on liver cell injury was investigated.A total of 40 main components were identified in SCRS, including lignans, flavonoids, organic acids and so on. 12 active ingredients were further screened, and 118 intersection targets of active ingredients and diseases were obtained. Sixteen core targets were obtained by network topology screening. Enrichment analysis showed that the main pathways involved in the hepatoprotective effect of SCRS included TNF, hepatitis C, hepatitis B and VEGF signaling pathways. The results of molecular docking showed that ingredients such as schisandrin A, schisandrin B, schisandrin C, schisantherin A, quercetin, gomixin M2 and gomixin R could interact with targets including EGFR, PIK3CA, TNF, Caspase-3 and other proteins with good binding affinity. SCRS could suppress the decrease of L-02 cell survival rate and inhibit ALT and AST activity induced by alcohol.SCRS shows a good hepatoprotective effect, and the main medicinal substance is lignans, which can exert hepatoprotective effect through multi-target and multi-pathway.
rattan stems; liver protection; active ingredients; network pharmacology; molecular docking; schisandrin A; schisandrin B; schisandrin C; schisantherin A; quercetin; gomixin M2; gomixin R
R284.1;R285
A
0253 - 2670(2022)08 - 2407 - 10
10.7501/j.issn.0253-2670.2022.08.018
2022-01-18
黑龙江省重点研发计划指导类项目(GZ20210110);黑龙江省博士后科研启动金资助项目(LBH-Q16133);哈尔滨商业大学青年创新人才支持计划项目(2020CX11);哈尔滨市科技攻关计划项目(2012DB3BS057)
曲中原(1980—),女,博士,教授,博士生导师,从事中药药效物质基础及中药炮制研究。
邹 翔(1978—),男,博士,研究员,博士生导师,Tel: (0451)84839434 E-mail: zou8663202@163.com
[责任编辑 王文倩]

