相位角与住院老年慢病患者肌少症的相关性分析
耿佳旭 魏雅楠 王晶桐
北京大学人民医院老年科,北京 100044
肌少症是与增龄相关的骨骼肌质量下降合并低肌肉力量和/或身体机能低下,与多种不良结局相关[1]。相位角(phase angle, PhA)是生物电阻抗分析(bioelectrical impedance analysis, BIA)来源的测量值,高PhA值是细胞膜完整性和细胞功能良好的标志[2-3]。低PhA与多种慢性疾病的不良预后有关[4-5]。国外部分研究[6-7]表明PhA是肌少症的预测指标,同时也有研究[8-9]表明PhA与肌少症无关。国内相关研究较少,PhA能否作为肌少症的预测因子尚存争议,本研究拟探讨PhA与肌少症及其各组成部分之间的关系,并探索预测肌少症的PhA临界值。
1 材料和方法
1.1 研究对象
收集2018年8月至2019年12月在我院老年科住院的慢性病患者235例。纳入标准:年龄≥ 60 岁,至少含有一种慢性疾病。排除标准:透析、心衰、严重水肿、激素使用、甲亢及甲减者;帕金森病、运动神经元病、脑卒中后遗症、严重认知功能障、下肢动脉硬化闭塞、重度骨关节炎、类风湿关节炎等影响躯体功能者;起搏器植入等生物电阻抗测量禁忌者。本研究经北京大学人民医院伦理审查委员会批准(批件号:2019PHB224-01)。
1.2 方法
1.2.1实验室检查指标:禁食8 h以上,晨起空腹抽血,收集白蛋白(Alb)、血红蛋白(Hb)、肌酐(Scr)、尿素氮(BUN)、估算肾小球滤过率(eGRF)、糖化血红蛋白(HbA1c)等指标。
1.2.2PhA检测:利用人体成分分析仪(In Body 770,Biospace 公司),测量四肢骨骼肌质量指数(appendicular skeletal muscle mass index, ASMI)及50 kHz频率的PhA值。
1.2.3握力测定:使用握力器(JamarPlus+,数字握力计,美国),测量优势手握力,测量3次,休息时间间隔为15 s,采用最大值进行分析。
1.2.4步速测定:在地面上进行2.44 m、6 m标记,记录相应距离时间并计算速度。
1.2.5躯体活动能力:使用简易躯体能力测试试验(SPPB)[10],通过步速、站立平衡和坐站测试评估躯体活动能力,分数范围为0~12分。
1.2.6肌少症诊断:根据AWGS2019诊断标准[11]:①四肢骨骼肌质量指数(ASMI):BIA 法测定男性<7.0 kg/m2,女性<5.7 kg/m2;②握力:男性<28 kg,女性<18 kg;③躯体活动能力:6 m步速<1 m/s,或简易躯体能力测试试验(SPPB)≤9,或5次坐站测试≥12 s。满足①且符合②或③其中一项者诊断肌少症。根据EWGSOP 2010诊断标准[12]:肌少症前期被定义为符合①但不符合②和③;严重肌少症被定义为同时满足①和②和③。
1.2.7营养风险指数(GNRI)[13]测定:GNRI = 1.489×血清白蛋白水平(g/L)+ 41.7×[实际体重(kg)/理想体重(kg)]。GNRI的风险等级分4级(正常:GNRI>98;低风险92≤GNRI≤98;中风险82≤GNRI<92;高风险<82)。本研究采用GNRI得分≤98分定义为有营养不良风险。
1.3 统计学处理
2 结果
2.1 研究人群特征
共纳入235名慢病患者,其中肌少症的患病率为22.6 %。肌少症组与非肌少症组患者性别、高血压比例、糖尿病比例、冠心病比例、慢性阻塞性肺疾病(COPD)、阻塞性睡眠呼吸暂停低通气综合征(OSAHS)、房颤、肌酐(Scr)、尿素氮(BUN)、血清白蛋白(Alb)、糖化血红蛋白(HbA1c)、收缩压、舒张压差异无统计学意义(P>0.05);肌少症组患者年龄、肿瘤比例、有营养不良风险比例明显高于非肌少症组,体质指数(BMI)、血红蛋白(Hb)、估算肾小球滤过率(eGFR)、相位角(PhA)、四肢骨骼肌质量指数(ASMI)、握力、步速明显低于非肌少症组,差异有统计学意义(P<0.05),见表1。将有统计学意义的指标纳入多因素Logistic回归分析,结果显示肌少症的主要影响因素为年龄、BMI、相位角,见表2。
2.2 相位角与肌少症及其组分之间的关系
多因素Logistic回归分析结果显示,调整年龄、性别、BMI、肿瘤史、Hb、eGFR、GNRI后,PhA分别与肌少症、低ASMI、低握力、低步速、低五次坐站测试表现、低SPPB独立相关,且随着PhA的降低,肌少症(OR=4.21, 95 %CI=1.60~11.05,P=0.004)、低ASMI(OR=5.40, 95 %CI=2.10~13.91,P<0.001)、低握力(OR=3.59, 95 %CI=1.83~7.03,P<0.001)、低步速(OR=2.62,95 %CI=1.38~5.00,P=0.003)、低五次坐站测试表现(OR=3.33, 95 %CI=1.70~6.54,P<0.001)、低SPPB(OR=4.11, 95 %CI=2.00~8.46,P<0.001)风险均升高(表3)。
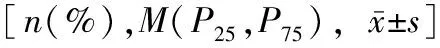
表1 肌少症组和非肌少症组患者特征比较Table 1 Comparison of characteristics between sarcopenia group and non-sarcopenia group[n(%),M(P25,P75),

表2 肌少症相关影响因素的多因素Logistic回归分析Table 2 Multivariate logistic regression analysis of risk factors of sarcopenia
2.3 PhA对肌少症的预测价值
ROC曲线分析结果表明,PhA预测肌少症的最佳截断值:男性4.35 °,ROC曲线下面积(AUC)=0.789(95 %CI=0.701~0.876),灵敏度67.0 %,特异性82.8 %;女性3.85 °,AUC=0.817(95 %CI=0.727~0.907),灵敏度72.6 %,特异性75 %,见图1。

表3 相位角与肌少症及其组份之间关系的多因素Logistic回归分析Table 3 Multivariate logistic regression analysis of the relationship between phase angle and sarcopenia and its components

图1 ROC曲线分析PhA诊断肌少症的最佳临界值Fig.1 ROC curve analysis of optimal threshold value for PhA diagnosis of sarcopenia
2.4 PhA与肌少症严重程度的关系
将所有患者分为正常组(n=173),肌少症前期组(n=9),肌少症组(n=16),严重肌少症组(n=37)。应用Jonckheere-Terpstra方法进行趋势性检验,可见随着肌少症程度的加重,PhA降低(P<0.001),见表4。

表4 肌少症的严重程度与相位角之间的关系
3 讨论
本研究肌少症的患病率为22.6 %,符合亚洲国家关于肌少症患病率的流行病学调查结果[11]。多因素Logistic回归分析显示相位角、BMI、年龄为肌少症发生的主要危险因素。
既往研究[14-15]表明,增龄与肌少症独立相关,与本研究结果一致。随着年龄的增长,肌纤维的大小和数量会减少[16],也会出现骨骼肌脂肪浸润[17],这些都与骨骼肌质量和力量成负相关。此外超声研究[18]证明,增龄会导致肌肉束缩短,羽状角变小(肌束与深层肌腱膜之间的夹角),从而引起肌肉力量下降。
本研究结果表明低BMI与肌少症相关,与部分研究结果一致[14-15,19],适度的BMI升高表明患者营养状况相对较好,蛋白质摄入量更高,是预防肌少症的保护因素。
本研究表明,调整了潜在混杂因素后,PhA仍与肌少症独立相关,与多数研究结论一致[7,20]。本研究PhA诊断肌少症的AUC男性为0.789,女性为0.817,在 0.7与0.9之间,属于中等准确[21]。预测肌少症的灵敏度和特异性:男性为67.0 %、82.8 %;女性为72.6 %、75 %,提示PhA可以较好地反映肌少症的情况,对肌少症的诊断具有一定的意义。但一项针对肾移植术后患者的研究表明,PhA与肌少症无关[8],部分原因可能为此特定人群长期服用免疫抑制剂及激素类药物且肾功能较差,从而造成细胞膜完整性受损及肌肉质量与功能的改变,且该研究样本量较小。
本研究提出诊断肌少症的PhA临界值为:男性4.35 °,女性3.85 °。我国吉林一项针对老年男性恶性肿瘤患者(n=445)的研究[20]显示,PhA诊断肌少症的临界值为4.25 °,与本研究中男性患者的PhA临界值相近。但国外类似研究诊断肌少症的PhA临界值却不尽相同,意大利一项针对PhA和肌少症的Meta分析包含了13项研究共7 668名国外受试者,统计结果表明PhA诊断肌少症的临界值范围波动在3.55 °~5.05 °[22],研究参与者的种族和性别差异可部分解释临界值的不同,同时各项研究的测量仪器不同及近年来肌少症诊断标准的变化也会造成PhA的临界值有所区别。Santana等[23]的研究表明,严重肌少症患者的PhA值较低,本研究结果也表明PhA与肌少症的严重程度相关,因此认为PhA可以作为肌少症严重程度的标志物,可用于肌少症患者的病情监测。
本研究结果显示低PhA与低握力(OR=3.59,P<0.001)、低步速(OR=2.62,P=0.003)、低五次坐站测试表现(OR=3.33,P<0.001)、低SPPB(OR=4.11,P<0.001)独立相关,表明PhA与肌少症的各组成部分密切相关,PhA在预测肌肉功能方面具有潜在临床价值。2018年欧洲肌少症共识中也提到PhA可以作为评估骨骼肌质量和功能的指标[24]。但PhA与肌肉功能相关性的机制还没有完全明确,可以解释的是PhA越低,细胞膜结构、细胞完整性和细胞功能越差,骨骼肌功能受损越严重。因此对于一些不便进行躯体功能评估的患者可以应用PhA进行肌少症诊断。此外,PhA检测方法简单、耗时短,因此适用于较大规模人群的筛查。
本研究的局限性:第一,本研究是回顾性的横断面研究且样本量有限,虽然结果表明PhA与肌少症及其各组成部分明显相关,但无法解释其因果关系,需要大规模前瞻性研究来阐明。第二,考虑到本研究是针对住院患者进行的,因此应谨慎解释本研究的结果。
综上所述,PhA与肌少症及其各组成部分相关,并且严重肌少症患者的PhA值更低。因此PhA可能是检测老年人肌肉质量、躯体功能的有效指标,可作为识别肌少症风险的老年医学工具。

