调神益气针法对睡眠剥夺大鼠ADMA/DDAH/NO途径及认知障碍的影响❋
张玉环, 巩 骞, 张慎芳, 王永泉, 王 君
(1.新泰市中医医院,山东 新泰 271200;2.山东省中医院, 济南 250000;3.东营市人民医院,山东 东营 257000)
睡眠剥夺可通过介导脑内多种神经递质引起感觉、精神活动及认知功能的复杂变化,严重影响患者的身心健康及生活质量。我国约80%的疾病与睡眠质量障碍有关[1,2]。目前关于睡眠剥夺的发病机制尚不完全明确,亦缺乏切实有效的治疗方法。针刺是一种简便效廉的绿色疗法,研究发现其可促进脑卒中、脑瘫等患者大脑发育,改善其适应性行为[3,4]。本研究推测针刺可能对睡眠剥夺后认知功能障碍有一定的改善作用。研究报道,认知障碍可能与海马炎症有关,但主要发病机制尚未阐明。非对称性二甲基精氨酸(asymmetric dimethylarginine,ADMA)是在人体细胞质中发生蛋白质修饰过程产生的代谢副产物,主要通过二甲基精氨酸二甲胺水解酶(dimethylarginine dimethylaminohydrolase,DDAH)降解,ADMA可竞争性抑制一氧化氮合酶(nitric oxide synthase,NOS)活性,减少一氧化氮(nitric oxide,NO)生成。NO具有广泛血管扩张作用,与动脉粥样硬化、血管痉挛、睡眠呼吸暂停低通气综合征患者认知功能障碍等多种生理病理过程密切相关[5,6]。本研究采用调神益气针法对睡眠剥夺大鼠进行针刺治疗,探究其作用效果及对ADMA/DDAH/NO途径的影响,为临床治疗提供实验参考。本研究符合动物3R原则,通过新泰市中医医院伦理委员会审查(伦审字编号20200079号)。
1 材料与方法
1.1 动物
清洁级SD大鼠48只,雄性,8周龄,体质量210~230 g,购自南京君科生物工程有限公司,实验动物许可证号SCXK(苏)2018-0012。饲养于新泰市中医医院实验动物房,自由饮水、采食,温度23~25 ℃,12 h/12 h光照,黑暗交替,适应性饲养1周。
1.2 主要试剂及仪器
逆转录试剂盒(货号K1928),杭州主诺生物技术有限公司;荧光定量PCR试剂盒(货号RR820A),日本TaKaRa公司;蛋白提取试剂盒(货号BB-0723),上海贝博生物科技有限公司;NO检测分析试剂盒(货号BC1475),北京索莱宝科技有限公司;ADMA检测试剂盒(货号ab145399)、一抗兔源anti-DDAH(货号ab180599)、anti-β-actin抗体(货号ab179467)、羊抗兔IgG二抗(货号ab205718),英国Abcam公司。
Morris水迷宫实验装置(型号BZ-XM101),上海吉量软件科技有限公司;八臂迷宫实验视频分析系统(型号JY-ZH-3000),北京金洋万达科技有限公司;实时荧光定量PCR仪(型号QuantStudio5),赛默飞世尔科技(中国)有限公司;紫外分光光度计(型号Evolution 220)、酶标仪(型号FC),美国Thermo Fisher公司;电泳仪(型号Mini-PROTEAN Tetra)、湿转槽湿式转膜仪(型号1703930)、凝胶成像系统(型号Gel Doc XR),美国Bio-Rad公司。
1.3 方法
1.3.1 模型建立及分组 采用改良小平台水环境法制备大鼠睡眠剥夺模型[7]。制作30 cm×30 cm×30 cm睡眠剥夺箱,中间放置直径7 cm、高8 cm圆形平台,平台周围注满水,水位低于平台1 cm,大鼠可在平台上自由饮水、采食,每天更换1次水。平台上的大鼠进入快速动眼睡眠阶段时,由于骨骼肌肌张力下降可导致触水惊醒,达到睡眠剥夺目的,进行72 h连续睡眠剥夺。成模大鼠随机分为模型组、假针刺组、针刺组,另取正常饲养无睡眠剥夺大鼠为对照组,每组12只。
1.3.2 针刺方法 造模结束后,针刺组进行调神益气针法针刺治疗。参照中国针灸学会实验针灸学会制定的《小动物针灸技法手册》[8],取大鼠“人中”“百会”“关元”“内关”(双侧)穴施针,“人中”穴雀啄泻法捻针30 s,“内关”穴提插泻法捻针30 s,“百会”穴捻转补法30 s,“关元”穴提插泻法捻针30 s,每天上午9∶00治疗1次,连续7 d。假针刺组选取双侧肋下各2个固定非穴位点,采用平补平泻捻转手法各20 s,对照组及模型组仅进行相同时间、相同程度的抓挠刺激,4组刺激时间及疗程均相同。
1.3.3 Morris水迷宫和八臂迷宫实验 治疗结束后,采用Morris水迷宫实验[9]和八臂迷宫实验[10]评估大鼠学习认知功能。
(1)Morris水迷宫实验。大鼠进行Morris水迷宫适应性训练,水迷宫为直径1.5 m、高50 cm的黑色水池,池内放有直径10 cm的可移动实心平台,隐藏于第一象限中间水下2 cm,水温19~21 ℃。将大鼠分别从各个象限面朝池壁放入水中,每天4次,每次120 s。连续训练4 d后进行定位航行试验,观察并记录120 s内大鼠找到平台的时间(即逃避潜伏期)。若大鼠120 s内找到平台,则记录其实际逃避潜伏期,若120 s内仍未找到平台,用导向杆将大鼠引导至平台,时间记为120 s,重复4次求平均值。
(2)八臂迷宫实验。实验前大鼠限制饮食2 d后置于迷宫中自由探索2 d,每天2次,每次10 min。不锈钢材质的八臂迷宫各臂末端装有自动投食器,八臂中2、4、6、8臂末端放入饵料,训练时使大鼠摄取4臂饵料10 min,实验时将大鼠置于迷宫区域,15 s打开各臂门,测试时间10 min,大鼠将4臂饵料吃完或10 min内到达4臂,但饵料没有吃完实验均结束。通过观察动物视频轨迹行为学分析系统,记录实验过程中大鼠进入有饵料臂并吃掉饵料的次数,即正确次数;大鼠重复进入吃过饵料臂的次数,即工作记忆错误次数;大鼠进入不放饵料臂的次数,即参考记忆错误次数;大鼠八臂迷宫探索完成时间,即完成总时间。
1.3.4 海马DDAH mRNA表达水平检测 完成上述试验后,腹腔麻醉处死大鼠,断头取脑,每组随机选取6只大鼠左半海马组织提取总RNA,反转录得到cDNA,采用实时荧光定量PCR扩增DDAH mRNA片段。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环,具体操作严格按照试剂盒说明书进行。引物由上海吉玛制药技术有限公司合成。DDAH上游引物序列:CTCTTGTGGCATCGGGT GAA,下游引物序列:GTGATCCAAGGAGACACGGC;内参GAPDH上游引物序列:ACCACCATGGAGAAG GCTGG,下游引物序列:CTCAGTGTAGCCCAGGA TGC。采用2-ΔΔCT法计算海马DDAH mRNA相对表达水平。
1.3.5 海马DDAH蛋白表达量检测 每组随机选取6只大鼠右半海马组织蛋白提取,BCA法测定浓度,取50 μg蛋白样品进行聚丙烯酰胺凝胶电泳、转膜、封闭,添加anti-DDAH(稀释比1∶1000)、anti-β-actin(稀释比1∶1000)抗体,4 ℃孵育过夜,添加羊抗兔IgG二抗(稀释比1∶5000)室温避光孵育1 h,增强化学法显影、拍照,并采用Image J软件分析各蛋白条带相对灰度值。

1.4 统计学方法
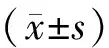
2 结果
2.1 各组大鼠Morris水迷宫实验结果
表1示,与对照组比较,模型组大鼠逃避潜伏期显著延长(P<0.05);与模型组比较,假针刺组大鼠逃避潜伏期差异无统计学意义(P>0.05),针刺组大鼠逃避潜伏期显著缩短(P<0.05);与假针刺组比较,针刺组大鼠逃避潜伏期显著缩短(P<0.05)。
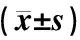
表1 各组大鼠Morris水迷宫实验结果比较
2.2 各组大鼠八臂迷宫实验结果比较
表2示,与对照组比较,模型组大鼠工作记忆错误次数、参考记忆错误次数显著增加,正确次数显著减少,完成总时间显著延长(P<0.05);与模型组比较,针刺组大鼠工作记忆错误次数、参考记忆错误次数显著减少,正确次数显著增加,完成总时间显著缩短(P<0.05);假针刺组与模型组大鼠上述指标比较差异无统计学意义(P>0.05);假针刺组与针刺组大鼠上述指标比较差异有统计学意义(P>0.05)。
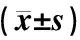
表2 各组大鼠八臂迷宫实验结果比较
2.3 各组大鼠海马DDAH mRNA表达水平比较
表3示,与对照组比较,模型组大鼠海马DDAH mRNA表达水平显著降低(P<0.05);与模型组比较,假针刺组大鼠海马DDAH mRNA表达水平差异无统计学意义(P>0.05),针刺组大鼠海马DDAH mRNA表达水平显著增加(P<0.05);与假针刺组比较,针刺组大鼠海马DDAH mRNA表达水平显著增加(P<0.05)。
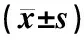
表3 各组大鼠海马DDAH mRNA表达水平比较
2.4 各组大鼠海马ADMA水平、DDAH蛋白表达量及NO含量比较
图1表4示,与对照组比较,模型组大鼠海马ADMA水平、DDAH蛋白表达量显著降低,NO含量显著增加(P<0.05);与模型组比较,针刺组大鼠海马ADMA水平、DDAH蛋白表达量显著增加,NO含量显著降低(P<0.05);假针刺组与模型组大鼠上述指标比较差异无统计学意义(P>0.05);假针刺组与针刺组大鼠上述指标比较,差异有统计学意义(P<0.05)。
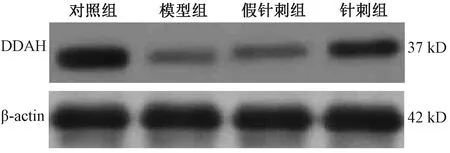
图1 各组大鼠海马二甲基精氨酸二甲胺水解酶(dimethylarginine dimethylaminohydrolase,DDAH)蛋白条带比较
表4 各组大鼠海马ADMA水平、DDAH蛋白表达量及NO含量比较
3 讨论
睡眠是机体维持正常生理功能的必要条件,睡眠障碍会影响机体多个系统的生理功能[11]。快速眼动睡眠与学习和记忆密切相关,快速眼动睡眠剥夺可损害学习和记忆能力[12-14],但其潜在机制目前尚不明确。小平台水环境法可剥夺大鼠全部快波睡眠,减少慢波睡眠及异相睡眠且简单可靠,是研究睡眠剥夺的常用方法[15]。本研究亦采用小平台水环境法对大鼠进行72 h睡眠剥夺,结果发现与对照组比较,模型组大鼠逃避潜伏期、完成八臂迷宫总时间显著延长,工作记忆错误次数、参考记忆错误次数显著增加,正确次数显著减少,提示模型制备成功,睡眠剥夺大鼠存在认知障碍。
所谓调神益气针法即以针刺治神益气,主穴选取人中、百会、关元及内关,可随症加减配穴。人中是调神之要穴,总督人身之阳,针刺之可调神益气。百会又名“三阳五会”是“阳脉之海”,针刺可益气通督,升提中气,益气健脑。内关穴为八脉交会穴之一,通阴维,具有益心气、调神智、活血通络之功效。关元穴可大补元阳,具有壮阳益气之功效,可治疗诸虚百损[16,17]。张玉等[18]研究报道,调和气血、补心益智针刺法可有效改善乳腺癌化疗相关认知障碍气血失调证患者认知功能损伤及情绪、失眠、疲乏等症状。刘欣等[19]研究报道,调神益气针法可有效缓解中风后疲劳,改善心境,增强患者积极主动性,改善其生存质量。本研究结果发现,与模型组比较,调神益气针法针刺治疗可显著缩短大鼠逃避潜伏期、完成八臂迷宫总时间,减少工作记忆错误次数、参考记忆错误次数,增加八臂迷宫测试正确次数,提示调神益气针法可有效改善睡眠剥夺大鼠认知障碍。
NO是血管活性调节物质,大脑和脊髓神经元在生理和病理条件下都能通过NOS产生NO,维持血管张力、神经递质功能和调节细胞防御功能等。但高水平NO是由小胶质细胞诱导产生,具有神经毒性,在神经退行性变及睡眠障碍中发挥作用[20,21]。刘行海等[22]研究报道,降低海马NO水平可显著改善2型糖尿病大鼠认知障碍。Gill等[23]研究报道,抑制小胶质细胞产生NO可减轻神经炎症及毒性作用。而ADMA是NOS内源性竞争抑制剂,影响NO合成。Xiao等[24]研究报道,抑制氧化应激作用能够减少ADMA表达,通过上调DDAH1、DDAH2、NO水平,调节ADMA/DDAH/NO途径治疗大鼠失眠。本研究结果发现,与对照组比较,模型组大鼠海马ADMA水平、DDAH mRNA及蛋白表达水平显著降低,NO含量显著增加,而调神益气针法针刺可增加睡眠剥夺大鼠海马ADMA水平、DDAH mRNA及蛋白表达水平,减少NO含量,与Xiao等[24]结果不完全一致,可能与NO测量时期及疾病异质性、发展阶段不同有关,提示调神益气针法针刺治疗减轻睡眠剥夺大鼠认知功能障碍,可能与调节ADMA/DDAH/NO途径有关。
综上所述,调神益气针法可减轻睡眠剥夺大鼠认知障碍,可能与调节ADMA/DDAH/NO途径有关。但关于其具体作用机制及是否涉及其他通路共同参与有待进一步探究。

