牦牛ATF4 基因组织表达与雌性生殖器官中定位分析
蒋旭东,邬建飞,刘 宇,胡双阁,马 瑶,龚三你,卢建远,字向东
(西南民族大学动物科学国家民委重点实验室,四川 成都 610041)
转录激活因子4(Activating transcription factor 4,ATF4)又称为环磷腺苷反应元素-黏蛋白,基因位于人的第22 号染色体的细胞发生带22q13.1 上,mRNA在多种组织中广泛表达[1].内质网(Endoplasmic retic-ulum,ER)作为蛋白质合成的主要场所,对蛋白质的翻译、修饰和折叠发挥重要作用. 当外源或内源刺激导致ER 发生应激时,机体启动未折叠蛋白反应以缓解ER 中积累的未折叠或错误折叠的蛋白造成的应激,而ATF4 作为一种对应激反应的基因在内质网应激(Endoplasmic reticulum stress,ERS)中表达量提高[1-2].当氨基酸缺失、氧化应激和氧缺失等应激因素也可使ATF4 的表达量升高.ATF4 作为PERK 信号通路下游关键的转录因子之一,ATF4 的激活能增加C/EBP 同源蛋白基因表达. ATF4 在转录水平调控蛋白质折叠、转运和降解,也能调控脂质合成,通过增大ER 体积,恢复和维持线粒体蛋白质稳态方式恢复ER稳态[3-4].目前,有些研究表明ATF4 在动物生殖调控中也发挥重要作用,在营养缺乏的应激条件下ATF4表达增高会抑制卵巢卵泡的激活[5],多囊卵巢综合症(PCOS)妇女卵泡颗粒细胞中ATF4 的表达量低于正常妇女;ATF4 基因敲除的动物卵丘卵母细胞复合体(COC)扩张、胞外间质(ECM)重构和孕酮合成相关的一些重要转录本下调,说明ATF4 的异常表达可能限制动物卵泡正常发育和排卵[6]. 未折叠蛋白反应(UPR)信号通路激活诱导的ATF4 等基因的表达对维持黄体功能和早期黄体退化起主导作用[7].山羊卵泡闭锁过程中ATF4 mRNA 的表达量显著增加[8].
牦牛(Bos grunniens)生活寒冷、低氧、高紫外线辐射的青藏高原,为青藏高原不可替代的重要畜种[9].但是,牦牛ATF4 基因方面的研究尚未见报道,因此,本研究是以成年母牦牛为研究对象,克隆ATF4 基因的整个CDS 区,分析和预测所编码蛋白质结构及功能,检测ATF4 基因母牦牛不同组织及主要生殖器官的表达特性.
1 材料和方法
1.1 样品采集
在四川省成都青白江区屠宰场采集5 头健康空怀母牦牛心脏、肝脏、脾脏、肺脏、子宫、卵巢、输卵管组织和5 头健康妊娠母牦牛(子宫角有胎儿)的子宫、卵巢和输卵管,分别放入冷冻管后放入液氮罐中保存,并送至实验室.
1.2 主要试剂及仪器
DNA Marker DL2000 购自 GenStAR 公司;琼脂糖和 Trizol Reagent 购自美国 Invitrogen 公司;cDNA 反转录试剂盒、2 × Taq PCR Master mix 和 PowerUpTMSYBRTMGreen 购自 Thermo Scientific 公司;克隆载体pMD19-T 和氨苄青霉素均购自宝生生物工程(大连)有限公司;ATF4 多克隆抗体(DF6008)购自Affinity公司;RNA 提取试剂盒购自北京天漠科技开发有限公司;胶回收试剂盒和E.coliDH5α 感受态细胞均购自成都擎科梓熙生物技术有限公司.
琼脂糖凝胶成像系统(CL1000)购自Invitrogen公司;PCR 仪(ETC811)购自苏州东盛兴业科学仪器有限公司;荧光定量PCR 仪(CFX96)购自美国 Bio Rad 公司;激光共聚焦显微镜(LSM880)购自ZEISS公司.
1.3 总RNA 的提取
采用Trizol 法对牦牛组织(心脏、肝脏、脾脏、肺、肾脏、子宫、卵巢和输卵管)进行总RNA 提取,利用分光光度计对RNA D260 nm/D280 nm 值和浓度进行检测,使用1.5%琼脂糖凝胶电泳对RNA 质量进行检测,根据反转录试剂盒说明书将RNA 反转录成cDNA,将其放入-20 ℃冰箱进行保存备用.
1.4 引物的设计及合成
在GenBank 中登录的黄牛(Bos taurus)的ATF4基因序列(NM_001034342.2),根据NCBI 中黄牛的GAPDH基因序列(NM_001034034.2),通过 Primer-Premier5 设计ATF4 基因的克隆引物以及定量引物和内参基因GAPDH荧光定量引物(表1),所有引物都由成都擎科梓熙生物技术有限公司合成.
1.5 牦牛ATF4 基因克隆与测序
牦牛卵巢组织cDNA 为模板,利用RT-PCR 技术克隆ATF4 基因.RT-PCR 反应体系为 25 μL:2 × Taq PCR MasterMix 12.5 μL,cDNA (200 ~500 μg/L)1 μL,上游和下游引物各1 μL(10 μmol/L),ddH2O 9.5 μL.RTPCR 反应程序:95 ℃预变性 2 min;95 ℃变性 30 s,退火 30 s(表1),72 ℃延伸1 min,共37 个循环;72 ℃延伸5 min;4 ℃保存.PCR 产物用1.5%琼脂糖凝胶电泳检测后,按照胶回收试剂盒说明书将胶回收并对其进行纯化处理,将纯化后的产物与pMD19 载体连接,随后转化到大肠杆菌DH5α 感受态细胞,其次再均匀涂到含Amp 抗生素的LB 板上,37 ℃培养箱培养过夜,挑白色的单菌落,接种于含Amp 抗生素的LB 液态培养基中摇床培养6 h,菌液进行PCR 鉴定[10],将阳性菌液交由成都擎科梓熙生物技术有限公司测序.
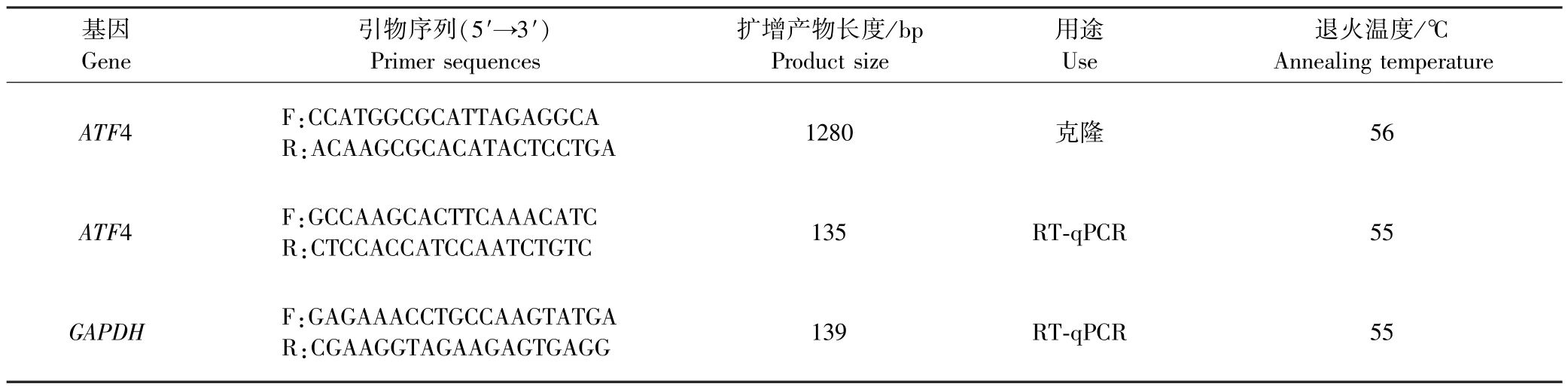
表1 PCR 和荧光定量PCR 引物序列Table 1 Primer sequences for PCR and real-time quantitative PCR (RT-qPCR)
1.6 牦牛ATF4 基因生物学信息分析
测序结果经过DNAMAN6.0 拼接及物种间氨基酸 序 列 比 对, 利 用 ORF Finder ( https:/ /www. ncbi. nlm. nih. gov/orffinder/)确定 CDS 区并翻译成氨基酸序列,采用MEGA7.0 软件构建系统进化树. 利 用 Blast ( https:/ /blast. ncbi. nlm. nih. gov/Blast. cgi/)对核苷酸和氨基酸序列进行比对,利用ExPASy-ProtParam ( https:/ /web. expasy. org/protparam/)分析蛋白质理化性质,采用SOPMA(https:/ /npsa-prabi. ibcp. fr/cgi-bin/npsa_automat. pl? page =npsa_sopma. html/)和SWISS-MODEL(https:/ /swissmodel. expasy. org/interactive/)对蛋白质二级及三级结构进行预测,利用TMHMM 和ExPASy-ProtScale(https:/ /web. expasy. org/protscale/)分析蛋白质的跨膜结构和亲/疏水性,采用 Signal P 5.0 Serve(http:/ /www. cbs. dtu. dk/services/Signal P/)和PSORTII(https:/ /psort. hgc. jp/form2. html/)分析信号肽和预测亚细胞定位,利用STRING(https:/ /string-db. org/)分析蛋白质相互作用,采用SMART(http:/ /smart. embiheidelberg. de)分析结构域.
1.7 实时荧光定量PCR
以母牦牛各个组织(心脏、肝脏、脾脏、肺、肾脏、卵巢、输卵管和子宫)以及妊娠期牦牛卵巢、输卵管和子宫的cDNA 为模板,采用RT-qPCR 测定ATF4 的表达量,每个样本3 个重复.TR-qPCR 反应体系为15 μL:cDNA1 μL, PowerUpTMSYBRTMGreen Master Mix 7.5 μL,上、下游引物各 0.5 μL,ddH2O 5.5 μL.反应条件:UDG 酶激活 50 ℃;95 ℃预变性 2 min;95 ℃变性15 s,55 ℃退火 15 s,40 个循环;最后读取溶解曲线.
1.8 免疫组化分析
利用免疫组化(immunohistochemistry,IHC)染色法检测ATF4 蛋白的表达. 将牦牛卵巢、子宫和输卵管组织从4%的多聚甲醛固定液中取出,制成石蜡切片.脱水后置0.88 mol/L H2O2中封闭,0.01 mol/L PBS(pH 7.4)冲洗3 次;5%胎牛血清封闭,滴加一抗(多克隆兔抗ATF4,BSA 100 倍稀释)4 ℃孵育过夜;PBS 冲洗3 次后滴加二抗(多聚化山羊抗兔HRP,武汉赛维尔)37 ℃孵育2 h;PBS 冲洗后加入DAB 显色,经过苏木精复染后,脱水、透明、封片,显微镜下观察,利用共聚焦显微镜,进行拍照.
1.9 统计分析
采用2-ΔΔct法对实时定量 PCR 得到3 个重复实验结果计算,利用Graphpad prism 8.02 软件绘制表达差异图,利用SPSS19.0 统计软件,对实验结果进行单因素方差分析和差异显著性,P>0.05 表示差异不显著,P<0.05 表示差异显著.
2 结果
2.1 牦牛ATF4 基因克隆
以卵巢的 cDNA 为模板,PCR 扩增后,产物经1.5%的琼脂糖凝胶电泳检测,获得了与预期目的产物大小相符的片段(图1),表明本试验成功的扩增了牦牛ATF4 基因.测序得到ATF4 基因长度为1 280 bp,其中CDS 长度为1 047 bp,共编码348 个氨基酸. 序列提交至NCBI,获得登录号:OL770369.
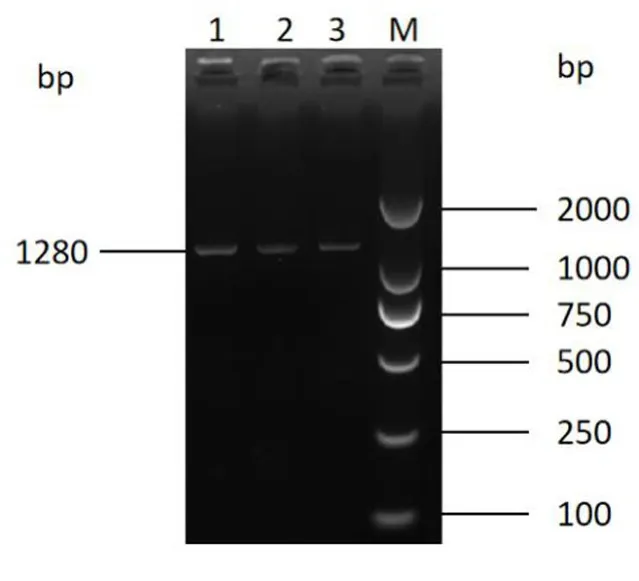
图1 牦牛ATF4 基因的PCR 扩增结果M:DL2000 DNA Maker;1、2 和 3:ATF4 引物 PCR 扩增产物Fig.1 PCR amplification result of yak ATF4 geneM:DL2000 DNA Maker;1、2 and 3:PCR amplification products of ATF4 primers
2.2 牦牛ATF4 基因核苷酸序列分析
利用DNAMAN 6.0 软件,将牦牛ATF4 基因测序结果中CDS 和黄牛ATF4 基因的CDS 做比对,发现了5 个碱基突变,导致4 个氨基酸发生改变(表2).牦牛与黄牛的ATF4 基因CDS 同源性为99.52%.

表2 牦牛与黄牛ATF4 基因编码区序列差异Table 2 Coding sequence difference of ATF4 gene between yak and cattle
2.3 ATF4 基因氨基酸序列同源性分析
使用 DNAMAN 6.0 软件对牦牛、黄牛(NM_001034342.2)、绵羊(NP_001135990.1)、猪(NP_001116550.1)、和人(CR456384.1)的 ATF4 蛋白氨基酸序列进行比对,结果显示牦牛与黄牛、绵羊、猪、和人的 ATF4 氨基酸序列对比度分别为97.45%、90.08%、83.85%和83.29%,说明ATF4 基因在进化过程中具有较高的保守性(图2).

图2 牦牛和其他物种间ATF4 的氨基酸序列比对黑色:同源性=100%;粉色:同源性>75%;蓝色:同源性>50%;白色:同源性<50%.Fig.2 Alignment of amino acid sequence of ATF4 between yak and other speciesBlack:Homology=100%;Pink:Homology >75%;Gray:Homology >50%;White:Homology <50%.
2.4 牦牛ATF4 蛋白理化性质分析
利用ExPASy-ProtParam 在线工具对牦牛的ATF4蛋白进行分析,发现其蛋白分子式为C1680H2657N439O552S13,分子质量为38 253.97;ATF4 蛋白的氨基酸由20 种组成(表 3),其中亮氨酸(Leu)、丝氨酸(Ser)、谷氨酸(Glu)和赖氨酸(Lys)所占比例较高,分别为 10.6%、10.3%、9.8% 和 9.8%;带正电荷的(Arg+Lys)氨基酸总数为 42,带负电荷的(Asp +Glu)的氨基酸总数为64,说明牦牛ATF4 蛋白带负电荷;理论等电点为4.72,表明ATF4 蛋白属于酸性蛋白;脂肪族系数为70.92;平均亲水系数为-0.639,不稳定系数为55.95,表明ATF4 蛋白属于亲水不稳定蛋白. 根据TMHMM2.0 在线工具分析,ATF4 蛋白跨膜螺旋中氨基酸的期望值0.000 21,所以ATF4 蛋白不是跨膜蛋白. 使用 PSORTII 在线工具分析,发现ATF4 蛋白主要存在于细胞核(78.3%),也存在于线粒体(8.7%)、细胞骨架(8.7%)和细胞质(4.3%).使用Signal P 5.0 预测,结果表明ATF4 蛋白不含信号肽.利用SMART 在线软件分析牦牛ATF4 蛋白的结构域,结果发现在其273 ~337 位氨基酸位置有1 个BRLZ 结构域,另外在 23 ~ 34 位、160 ~ 172 和 242 ~53 位氨基酸有3 个低密度区域.
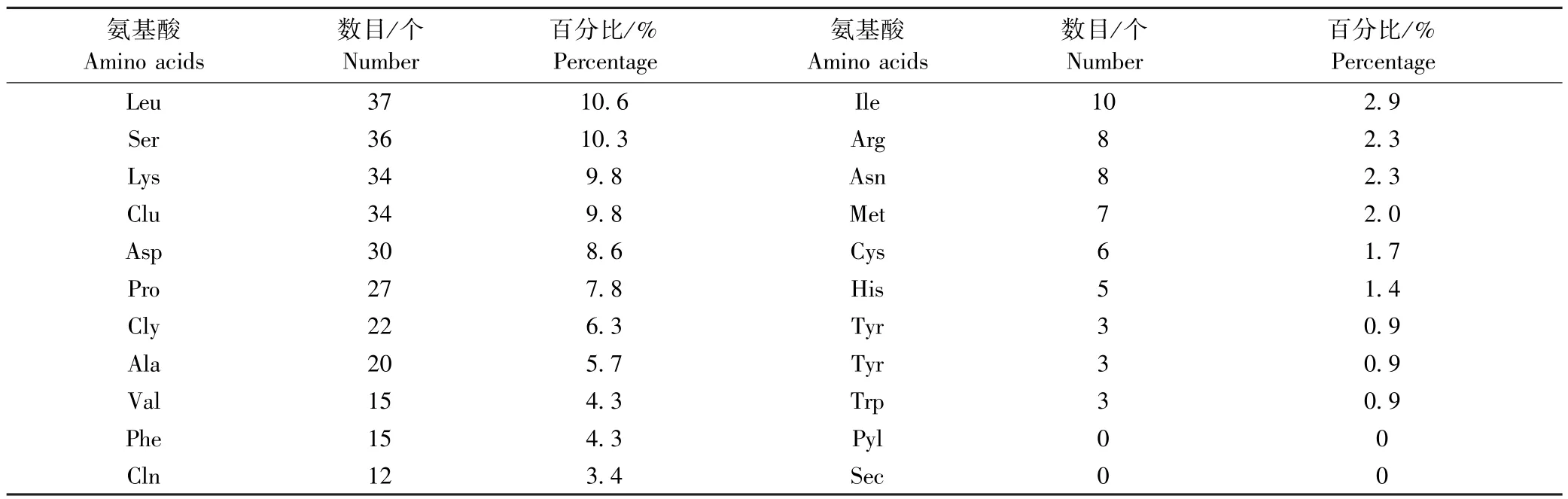
表3 牦牛ATF4 蛋白质氨基酸组成Table 3 The amino acids composition of yak ATF4 protein
2.5 ATF4 蛋白二、三级结构预测
利用SOPMA 在线工具对牦牛ATF4 蛋白二级结构进行预测,结果显示:α-螺旋占比为44.25%、延伸链占比为4.60%、β-转角占比为1.44%和无规则卷曲占比为49.71%(图3). 采用 SWISS-MODEL 在线工具对牦牛ATF4 蛋白三级结构进行预测,预测结果与二级结构预测结果基本一致.

图3 牦牛ATF4 蛋白二级结构预测h:α-螺旋;e:延伸链;t:β-转角;c:无规卷曲Fig.3 Secondary structure prediction of yak ATF4 proteinh:α-helix;e:Extended chain;t:β-turn;c:Random coil
2.6 蛋白相互作用分析
根据STRING11.5 在线工具分析,发现ATF4 蛋白与 DDIT3、PPP1R15A、CREBBP、EIF2AK3、EIF2S1、TRIB3、EP300、XBP1、ATF6 和 NFE2L2 等蛋白有相互作用(图4),他们之间的相关性系数分别是0.993、0.972、 0.946、 0.938、 0.938、 0.937、 0.929、 0.927、0.926 和0.925.
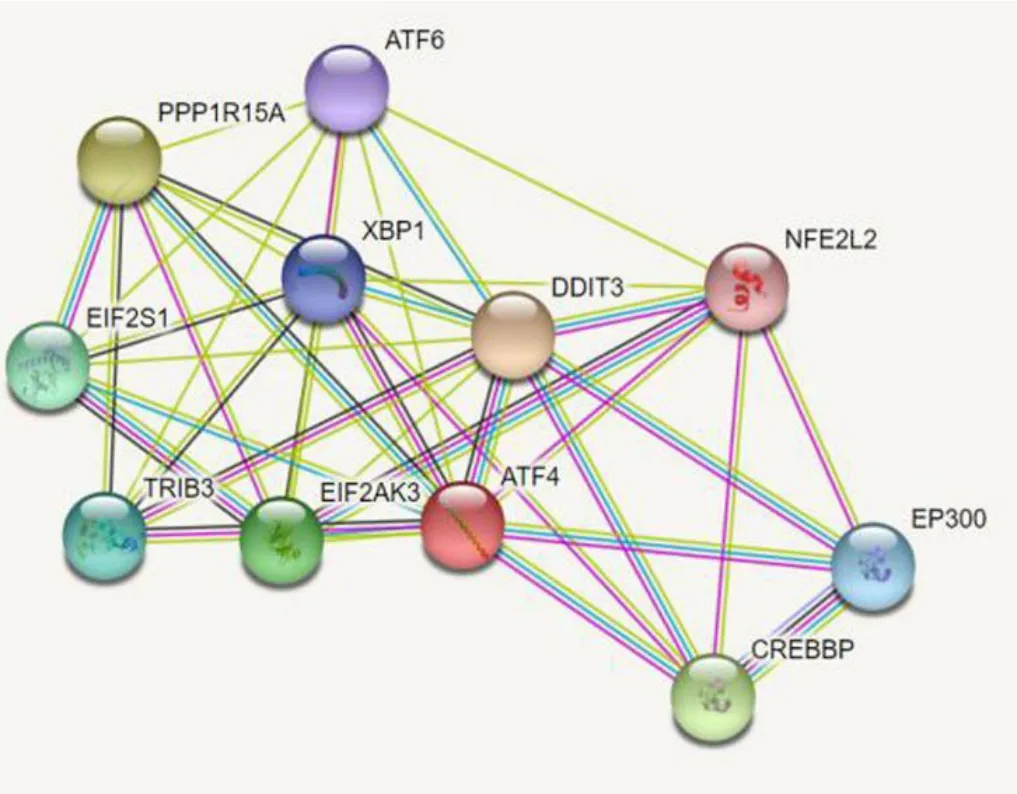
图4 ATF4 蛋白网络互作分析图Fig.4 ATF4 protein network interaction analysis
2.7 牦牛ATF4 基因系统进化树分析
从 NCBI 下载黄牛(NM_001034342.2)、猕猴(NM_001266632.2)、绵羊(NM_001142518.1)、人(NM_001675.4)、小鼠(NM_009716.3)、猪(NM_001123078.1)、大猩猩(XM_019018301.2)、羊驼(XM_006207100.3)和山羊(XM_018048794.1)9 个物种的ATF4 基因序列.利用Mega 7.0 构建基因进化树,发现牦牛与黄牛首先聚为一类,其次与绵羊聚为一类,进化比较保守,且符合物种进化规律(图5).
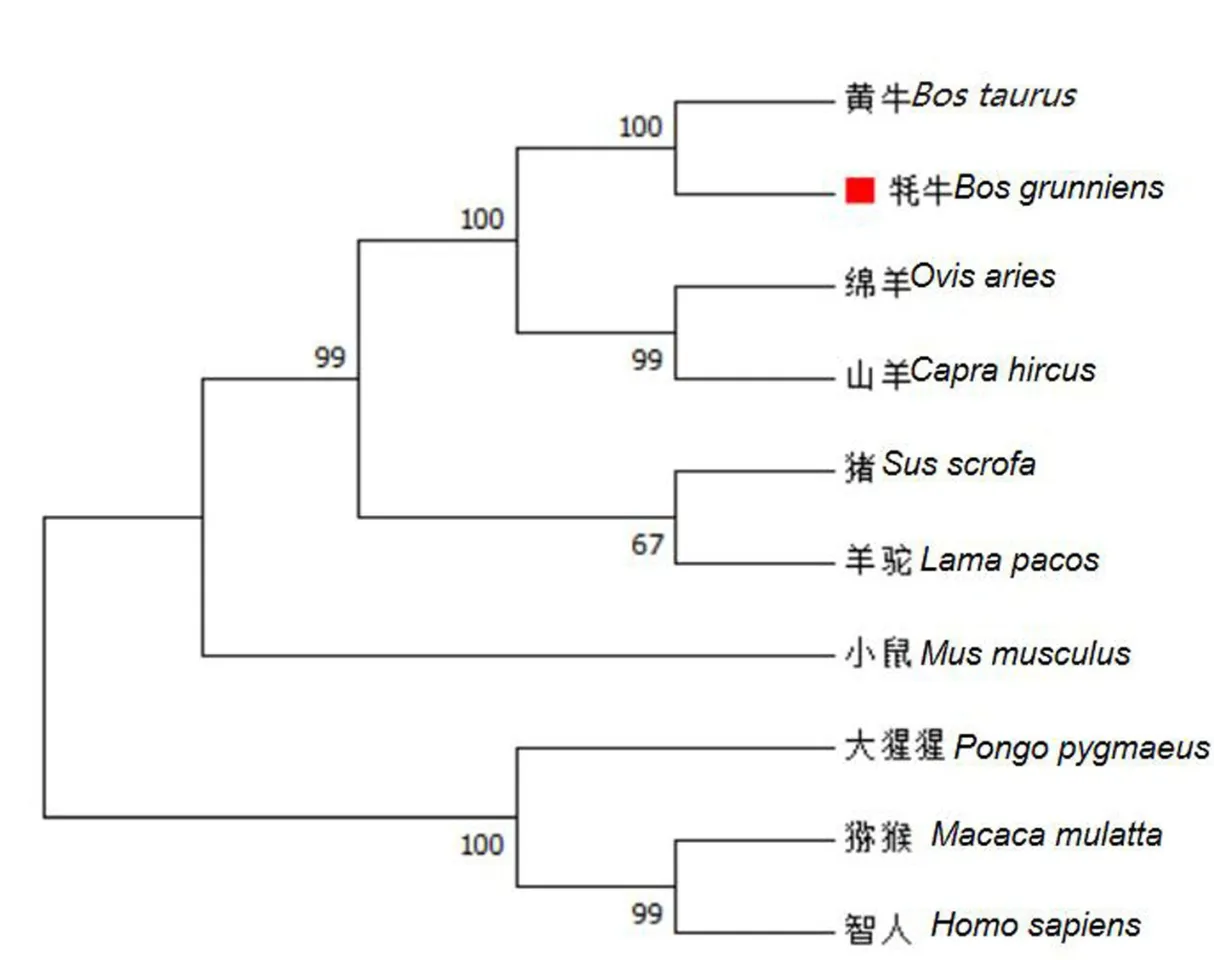
图5 ATF4 基因系统进化树Fig.5 Phylogenetic tree of ATF4 gene
2.8 牦牛ATF4 基因表达差异分析
以GDPDH为内参基因,利用RT-qPCR 技术检测空怀母牦牛心脏、肝脏、脾脏、肺脏、肺脏、卵巢、子宫和输卵管中ATF4 基因mRNA 的表达情况,结果见图6.以心脏中ATF4 基因的相对表达量为参考,结果显示,ATF4 基因在牦牛各个组织中广泛的表达,其中以子宫和卵巢的表达量最高,显著高于其它组织(P<0.05).
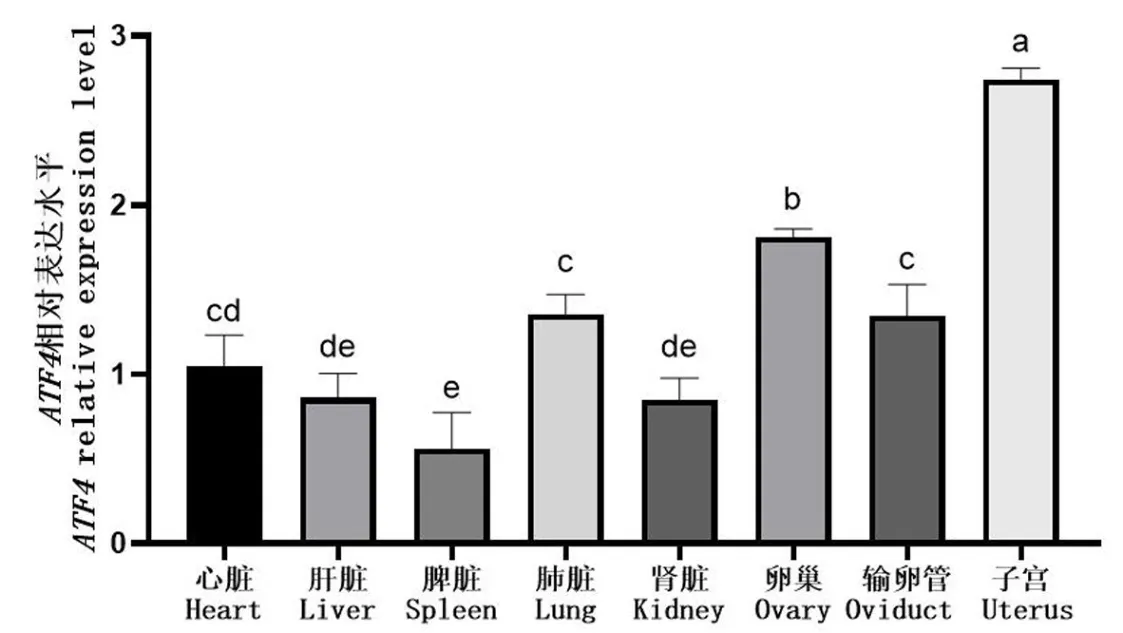
图6 ATF4 基因在空怀母牦牛不同组织的相对表达水平图中误差线表示标准差,不同小写字母表示差异显著(P <0.05),字母相同表示差异不显著.下同Fig.6 Expression level of ATF4 gene in different tissues of non-pregnant female yakThe error line in the figure refers to the standard deviation.The different lowercase letters indicate that the difference is significant (P <0.05).The same as below
以母牦牛空怀期输卵管ATF4 基因的相对表达量作为参照,利用RT-qPCR 检测牦牛空怀期与妊娠期的卵巢、子宫和输卵管3 个组织中ATF4 基因mRNA的表达水平.结果显示ATF4 在妊娠期卵巢(图7A)、输卵管(图7B)和子宫(图7C)的表达量显著高于空怀期(P<0.05).
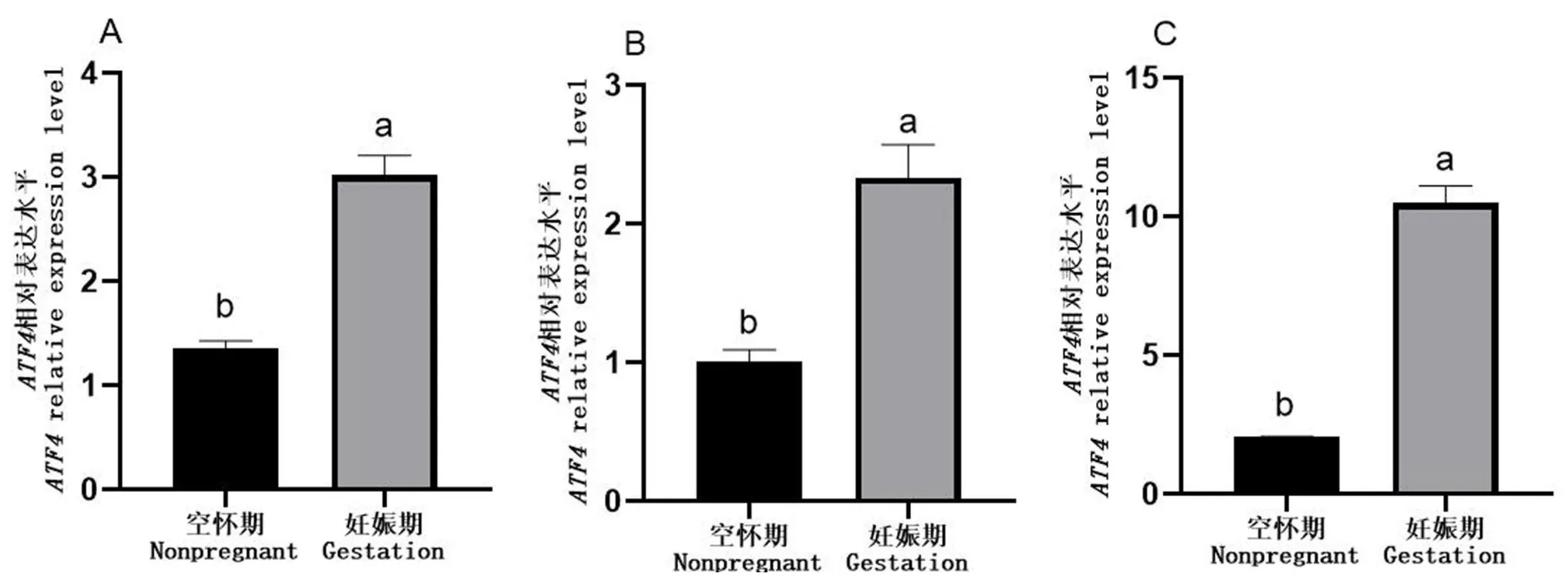
图7 ATF4 基因在牦牛生殖器官的相对表达水平A:卵巢;B:输卵管;C:子宫Fig.7 Relative expression level of ATF4 gene in reproductive organs of yakA:Ovary;B:Oviduct;C:Uterus
2.9 母牦牛生殖器官中的ATF4 的定位及表达
IHC 分析结果显示,ATF4 蛋白在母牦牛不同生殖器官组织切片中均有阳性表达,主要在卵巢和子宫表达,其中,卵泡颗粒层和卵泡液(图8A),输卵管黏膜上皮细胞(图8D),子宫内膜和子宫基质细胞表达量较高(图8E).

图8 ATF4 蛋白在母牦牛生殖器官中的定位A、C、E:ATF4 组;B、D、F:阴性对照 .A、B:卵巢;C、D:输卵管;E、F:子宫 .a:颗粒细胞;b:基底膜;d:卵泡液;e:黏膜上皮;f:子宫内膜;g:腺上皮;h:基质细胞Fig.8 Location of ATF4 protein in reproductive organs of female yakA、C、E:ATF4 group;B、D、F:Negative control.A、B:Ovary;C、D:Oviduct;E、F:Uterus.a:Granulosa cells;b:Basement membrane;d:Follicular fluid;e:Mucosl epithelium;f:Endometrium;g:Glandular epithelium;h:Stromal cells
3 讨论
ATF4 是一种典型具有亮氨酸拉链作为二聚体的转录因子之一,通过与靶基因启动子区域的C/EBPATF 反应元件结合激活转录,是应激反应的主调控因子和发育调控因子[1,11].ATF4 mRNA 在多种组织中广泛表达,会影响着一系列的生长发育及生理活动[1].熊燊源[12]研究发现ATF4 过表达可以抑制绵羊的子宫内膜基质细胞的蜕膜化进程,在干扰ATF4 中能促进妊娠期绵羊子宫内膜基质细胞的蜕膜化进程,ATF4 在体外受精胚胎中也有着重要的作用.ATF4 在人滋养层细胞中广泛表达,在自然流产组绒毛膜绒毛组织中ATF4 mRNA 和蛋白水平明显低于人为终止妊娠,这可能是在正常的妊娠早期,胚胎和滋养层绒毛暴露在缺氧环境中,PERK-eIF2a-ATF4CHOP 通路被触发,导致 CHOP 上调,进而导致ERS;而适度表达ATF4 可抑制细胞凋亡,促进细胞增殖,滋养细胞增殖在胎盘形成和妊娠维持中起着重要作用.这保证了体内平衡和滋养细胞的分化,并有助于胚胎的生长和发育;相反,在自然流产过程中ATF4 的表达降低,抑制细胞凋亡的能力有所下降,从而影响细胞的正常增殖,进而绒毛细胞的生长受到抑制,最终导致流产[13].这些研究都说明了ATF4 基因在繁殖性能方面有着重要的作用.
ATF4 基因功能的研究在牦牛上尚未报道,为了探究牦牛ATF4 基因与繁殖相关性以及与黄牛的ATF4 基因的差异,本研究利用牦牛的卵巢cDNA 成功克隆出来ATF4 基因的CDS 全长1 047 bp 序列,编码348 个氨基酸,生物信息学分析发现其分子质量为38 253.97,含有42 个磷酸化位点,平均亲水系数为-0.639,推测该蛋白属于亲水性蛋白,不稳定系数为55.95,属于不稳定蛋白,ATF4 蛋白主要存在于细胞核,这与前人在其它物种的研究相同[1].利用SMART在线软件分析牦牛ATF4 蛋白的结构域,发现在其273 ~337 位氨基酸位置有 1 个 BRLZ 结构域,BRLZ是启动子中与ERS 反应元件(ERSE)基序结合的特异位点[14]. 本研究发现,牦牛ATF4 基因的编码区与黄牛相比较有5 个碱基突变位点,其中4 个导致氨基酸改变,这种差异能否影响到牦牛ATF4 蛋白的功能,进而影响到牦牛的繁殖性能需要进一步的研究.氨基酸序列的同源性比对结果牦牛ATF4 与各物种间的同源性比较高,说明ATF4 进化比较保守,且符合物种进化规律.
通过蛋白质互作网络图显示,ATF4 蛋白与DDIT3、PPP1R15A、TRIB3、EP300 和 5XBP1 等蛋白有相互作用.DNA 损伤诱导转录本3(DDIT3)在ERS 反应中的多功能转录因子,在多种细胞应激反应中发挥重要作用,并在ERS 反应中诱导细胞周期阻滞和凋亡,和ATF4 协同促进天冬酰胺合成酶(ASNS)合成.DDIT3 基因在牦牛卵巢和子宫中表达较高,可能在维持牦牛卵巢机能和妊娠机能以及卵泡发育成熟中起到重要的调控作用[10].蛋白磷酸酶1 调节亚单位15A(PPP1R15A)招募丝氨酸/苏氨酸蛋白磷酸酶PP1 去磷酸化翻译起始因子eIF-2A/EIF2S1,从而逆转由应激诱导激酶启动的蛋白质合成关闭,促进细胞从应激中恢复.PPP1R15A 的选择性抑制原则上可以改善广泛的蛋白质错误折叠疾病[15]. 假性蛋白激酶3(TRIB3)是一种以肝脏中心的表达模式的细胞应激诱导基因,它与应激反应调节和代谢控制有关,可以与ATF4 结合并抑制其转录激活活性. ATF4 和 C/EBP 同源蛋白(CHOP)可以与TRB3 启动子中特定的位点结合,激活TRB3 基因转录,调节ERS 相关的细胞凋亡等[16]. E1A 结合蛋白p300(Ep300)介导表皮生长因子受体(EGFR)的赖氨酸巴豆酰基化修饰(Kcr)修饰,上调卵丘细胞(CCs)的EGFR 及p-EGFR的表达,激活 EGFR 通路促进卵母细胞的体外成熟[17].沉默X 盒结合蛋白1(XBP1)在ERS 期间,通过调节未折叠蛋白反应(UPR)发挥转录因子的作用.胚胎发育期间心脏肌生成和肝脏生成以及分泌组织(如外分泌胰腺和唾液腺)的发育所需,XBP1 缺失会导致小鼠,肝脏发育不全和心肌细胞坏死,以及胚胎致死和乳腺发育不良[18]. 从蛋白质互作网的结果分析来看,与ATF4 蛋白存在相互作用的蛋白主要参与ERS,而ERS 与卵泡发育、卵泡生长、排卵和早期胚胎附及发育有关,进而推测ATF4 基因与繁殖相关性状具有很强的关联性.
RT-PCR 结果显示,ATF4 在牦牛各组织中广泛表达,这与人[19]、猪[20]和绵羊[21]中发现ATF4 在组织中普遍表达基本一致,说明ATF4 具有广泛的生物学功能.ATF4 在牦牛子宫表达量最高,其次在卵巢中,脾脏表达最低,这与绵羊的结果相近[22]. 在妇女生理期,孕酮促进子宫内膜上调ERS,通过激活PERK/elF2α/ATF4/CHOP 信号通路促进子宫内膜凋亡,维持子宫内膜在生理期的周期性变化[23]. 在IHC 结果显示,ATF4 蛋白在牦牛子宫上表量较高,且主要分布在子宫内膜上和子宫基质细胞,也证明ATF4 参与到子宫的生理功能.环氧化酶-2(COX2)和前列腺素E2(PGE2)是评价排卵功能的标志,而ATF4 可以结合到COX2 启动子上,进而衍生的PGE2 在调节排卵中起着关键作用[24-25].有研究证明人绒毛膜促性腺激素(hCG)可以激活颗粒细胞(hGC)中的PI3K/AKT 信号通路,进而刺激ATF4 的表达,增加的ATF4 转录本直接与COX2 的启动子结合,增强了COX2 的转录和PGE2 的合成,从而促进COC 的扩张和排卵[6]. 本实验研究中,发现ATF4 在牦牛卵巢上表达量较高,在IHC 结果显示ATF4 蛋白主要分布在卵泡的颗粒细胞层上,说明ATF4 可能在牦牛促进卵丘卵母细胞的扩张和排卵.
本实验还发现,牦牛妊娠期ATF4 基因在卵巢、输卵管和子宫比空怀期表达量都有显著增加,其中子宫表达量和增长量都是最高的,这与在绵羊的研究结果一致[18]. 一些研究表明ATF4 诱导卵巢颗粒细胞损伤,抑制卵巢卵泡活化[14,23],而本试验发现妊娠期卵巢中ATF4 的相对表达量显著空怀期,这说明妊娠刺激卵巢中ATF4 的高表达诱导颗粒细胞损失,进而抑制妊娠期卵泡的发育.
4 结论
本研究克隆得到牦牛ATF4 基因CDS 区全长1 047 bp,编码348 个氨基酸.ATF4 基因在牦牛各组织中广泛表达,在卵巢、子宫和输卵管中表达量高,且妊娠期显著高于空怀期. ATF4 蛋白主要定位在卵巢的卵泡颗粒层和卵泡液,输卵管上皮细胞和子宫内膜和子宫基质细胞.提示ATF4 基因可能在牦牛繁殖调控机能中发挥着重要的调节作用.

