水稻紫色颖壳突变体的转录组分析
胡昌泉 林觅 颜静宛 林智敏



摘 要:鉴定水稻花青素新基因及揭示其代谢机制,用于水稻新品种选育,是创制功能性水稻的手段之一。为探讨水稻紫色颖壳形成对花青素积累代谢途径的作用,以从水稻籼稻转化体组织培养中筛选获得的1个紫色颖壳杂合突变体(PiX)为材料,采用Illumina HiSeqTM 6000高通量转录组学(RNA-Seq)技术对其自交获得的突变型、正常型及野生型进行转录组测序研究。结果表明:突变型(ME)与野生型(F8)相比上調基因5108个、下调基因4288个,自交分离正常表型(PD)与野生型(F8)相比上调基因4653个、下调基因4397个,自交分离正常表型(PD)与突变型(ME)相比上调基因2078个、下调基因2829。GO功能富集分析表明水解酶活性类基因差异表达变化显著;KEGG Pathway分析结果表明,与野生型相比,在类黄酮生物合成途径中,突变型中与类黄酮合成相关色素基因数量多,且主要受编码查尔酮异构酶OsCHI影响。该研究结果可为研究水稻花色苷积累的分子机制提供参考。
关键词:水稻;紫壳;花青素;转录组
中图分类号:S 511 文献标志码:A 文章编号:0253-2301(2022)02-0020-06
DOI: 10.13651/j.cnki.fjnykj.2022.02.004
Transcriptome Analysis of A Rice Glume Purple Mutant
HU Chang-quan, LIN Mi, YAN Jing-wan, LIN Zhi-min*
(Institute of Biotechnology, FujianAcademy of Agricultural Sciences, Fuzhou, Fujian 350003, China)
Abstracts: There is a way to create functional rice by identifying new rice anthocyanin genes and revealing their metabolic mechanism for the breeding of new rice varieties. In order to explore the effect of purple glume formation on anthocyanin accumulation and metabolism pathway in rice, a purple glume hybrid mutant (PiX) was screened from the tissue culture of Indica rice transformants, and the mutant,normal and wild-type transcripts obtained through its selfing was sequenced by Illumina hiseqtm 6000 high throughput transcriptome (RNA SEQ) technology. The results showed compared with wild-type (F8), mutant (ME) has 5108 up-regulated genes and 4288 down regulated genes,self segregation normal phenotype (PD) has 4653 up-regulated genes and 4397 down regulated genes,and self segregation normal phenotype (PD) has 2078 up-regulated genes and 2829 down regulated genes compared with mutant (ME). The Go function enrichment analysis showed that the differential expression of hydrolase activity genes changed significantly. The KEGG pathway analysis revealed that compared with the wild-type, the mutant had more pigment genes related to flavonoid synthesis in the flavonoid biosynthesis pathway, and those genes were mainly affected by the encoding chalcone isomerase OsCHI. The results can provide a reference for studying the molecular mechanism of anthocyanin accumulation in rice.
Key words: Rice; Purple glume; Anthocyanin; Transcriptome
水稻是世界上主要的粮食作物之一,与小麦、玉米和土豆等三大作物被全球一半的人口消费[1]。花青素(anthocyanin)是植物重要的次级代谢产物之一,花色苷作为水稻重要的生物活性物质,已成为当前功能性稻米开发研究的热点之一。研究人员在水稻植株的不同部位发现花青素,特别是在水稻颖壳中也发现花青素,这导致了诱人的颜色[2]。Ghasemzadeh等研究发现水稻中可能含有大量抗氧化化合物,如花青素是其中一种,花青素主要分布在果皮为黑色(紫色)和红色的色素水稻品种中[3]。花青素是一种水溶性植物色素,在叶子、水果、谷物和花朵上均有分布[4]。花青素对植物具有多种生物功能,它在植物中的作用主要是在生理代谢过程中保护自由基,尤其是在植物生物或非生物胁迫下生长,花青素可以减轻细胞损伤[5],并维持正常的光合活性[6]。此外,作为一种植物营养素,花青素具有很强的抗氧化和抗突变活性,对人类健康很重要[7]。许多结构基因编码各种酶,它们具有催化植物中花青素和原花青素(PAs)的生物合成,同时,合成的花青素被运输到液泡和其他地方通过各种修饰进行存储[8]。结构基因包括早期生物合成基因(EBG)和晚期生物合成基因(LBG)2个关键基因组[9]。其中EBG包括查尔酮合酶(CHS)、查尔酮异构酶(CHI)、黄烷酮3-羟化酶(F3H)、类黄酮-3′-羟化酶(F3′H)和类黄酮-3′-羟化酶(F3′5′H),参与黄酮醇和黄酮类化合物的生物合成;LBG包含二氢黄酮醇4-还原酶白细胞花青素还原酶花青素合成酶(ANS)、花青素还原酶(ANR)和糖基转移酶[10]。水稻中与花青素调控相关研究主要集中于MYB和bHLH转录因子[11]。水稻6号染色体上的R2R3MYB转录因子OsC1克隆发现其与玉米关键花青素生物合成基因C1是同源基因,而且主要引起水稻叶鞘花青素积累[12]。OsRb是水稻中一种bHLH基因[12]。研究表明,Rd参与了水稻果皮原花青素的生物合成[13]。此外,通过EMS诱变,从籼稻中分离获得1个水稻紫叶突变体(pl),与野生型相比,花色素苷生物合成基因OsPAL、OsCHS、OsANS和OsMYB55在pl植物中表现出上调[14]。本研究从水稻籼稻转化体组织培养中筛选获得1个紫色颖壳突变体(PiX),采用高通量转录组学(RNA-Seq)测序分析,以增加对水稻紫色颖壳形成对花青素积累代谢途径的认识,为后续开展花青素功能的研究提供一定的理论基础。
1 材料与方法
1.1 试验材料
以籼稻恢复系明恢86为转化受体中获得1份组织培养颖壳紫色特异表达突变体,命名为PiX。通过突变体自交和野生型种植,获得2个分离群体:自交分离无表型的水稻幼穗(PD);自交分离紫色颖壳表型的水稻幼穗(ME)。野生型水稻幼穗(F8)。所有水稻材料种植在福州寿山转基因基地温室内,取未灌浆水稻穗颖壳用于转录组学分析,液氮取样后贮存于-80℃下备用。
1.2 试验方法
1.2.1 植物总RNA提取 水稻颖壳通过液氮研磨后,利用RNAprep Pure植物总RNA提取试剂盒(目录号:DP432)提取总RNA,具体操作见说明手册。
1.2.2 转录组学分析 委托北京诺禾致源生物科技有限公司完成质控、建库及Illumina HiSeqTM 6000测序,每个材料设3个重复。
(1)差异基因聚类分析:将所有比较组的差异基因取并集之后作为差异基因集。试验分为3组,对差异基因集进行聚类分析,将表达模式相近的基因聚在一起。同时,采用主流的层次聚类对基因的FPKM值进行聚类分析,对行(row)进行均一化处理(Z-score)。热图中表达模式相近的基因或样本会被聚集在一起,每个方格中的颜色反映的不是基因表达值,而是表达数据的行进行均一化处理后得到的数值(一般在-2到2之间),所以热图中的颜色只能横向比较(同一基因在不同样本中的表达情况),不能纵向比较(同一样本不同基因的表达情况)。
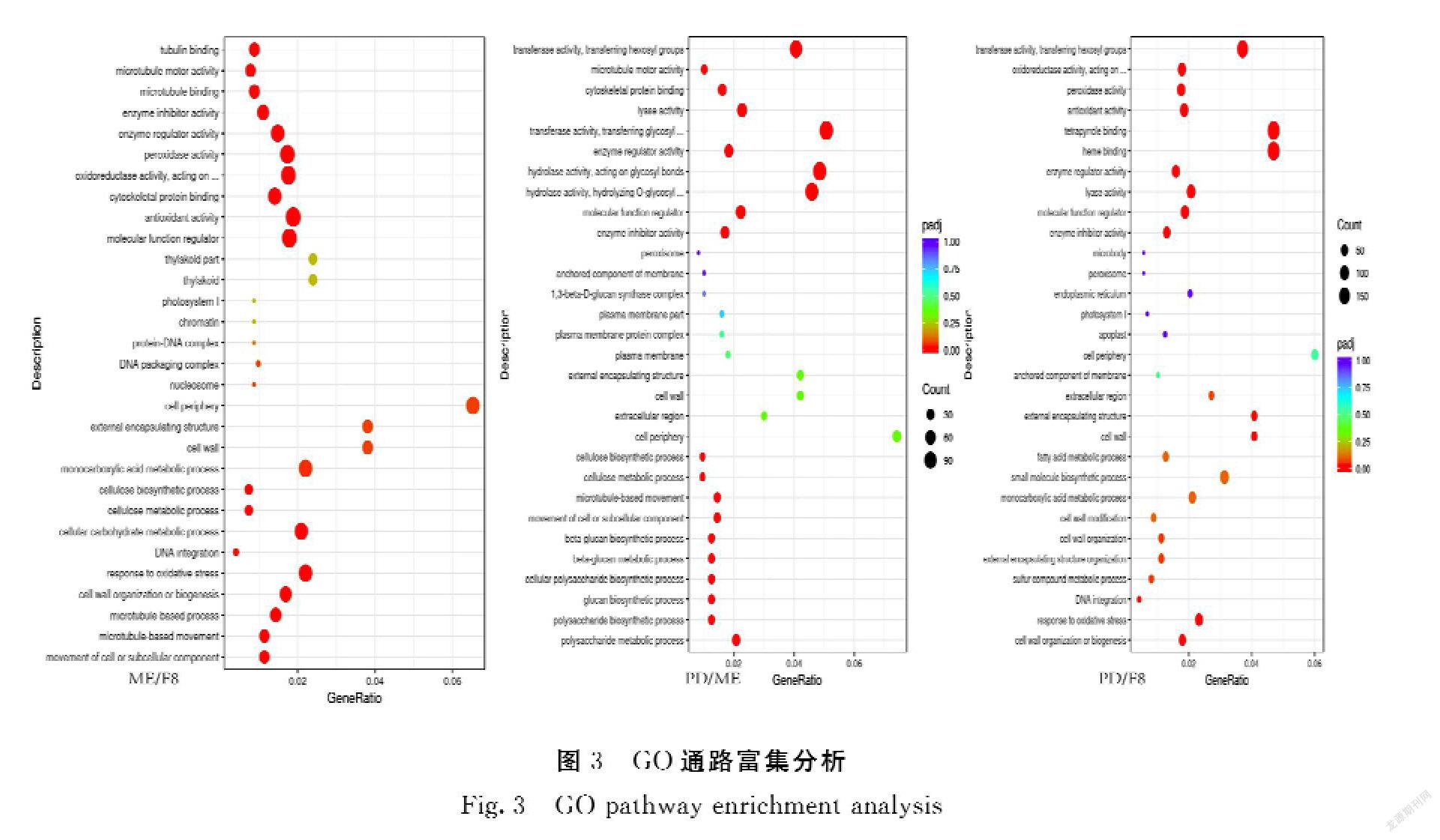
(2)GO注释及KEGG富集分析:GO富集分析是通过选取最显著的30个Term绘制散点图进行展示,若不足30个,则绘制所有Term。横坐标为注释到GO Term上的差异基因数与差异基因总数的比值,纵坐标为GO Term,点的大小代表注释到GO Term上的基因数,颜色从红到紫代表富集的显著性大小,并且筛选|log2FC|>1的差异基因进行GO功能注释。KEGG富集分析是整合基因组、化学和系统功能信息的综合性数据库,其通路富集以padj小于0.05作为显著性富集的阈值。
2 结果与分析
2.1 突变体PiX表型分析
试验结果表明,突变体PiX表型主要表现为水稻种子颖壳为紫色,其余性状均为正常(图1A,图1B),同时穗型变小,穗粒数变少,且有效种子变少(图1D),导致产量减少。此外,试验结果表明,突变体PiX种子的萌发率下降明显;通过自交后代分析表明,该突变体为杂合型,其后代有2个表型:突变型与正常型(图1B,图1C)。
2.1 转录组学测序分析
2.1.1 差異基因聚类分析 采用主流的层次聚类对基因的FPKM值进行聚类分析,对行(row)进行均一化处理(Z-score)。若FC(flod change,差异倍数)≥2或≤-2,且FDR(false discovery rate,错误发现率)<0.01,则认为该基因在样品部存在显著的表达差异。绘制DEGs表达模式聚类图,对水稻颖壳、自交分离正常颜色和野生型正常颜色3组不同叶片的差异表达基因进行对比分析。从图2可见,3个样本的重复样品间的差异基因测序结果相对一致,而且3个样品间的差异基因存在明显不同。其中MEvsF8中上调基因5108个、下调基因4288个,PDvsF8中上调基因4653个、下调基因4397个,PDvsME中上调基因2078个、下调基因2829。
2.1.2 差异表达基因的GO通路分析 从图3可知,水解酶活性、转移酶活性类基因差异变化大(PD/ME);转移酶活性、氧化还原酶、过氧化物酶、抗氧化剂类基因差异变化大(ME/F8);过氧化物酶、抗氧化剂类基因差异变化大(PD/F8)。因此,水解酶活性类基因可能影响颖壳紫色形成花青素积累的主因。
2.1.3 差异表达基因的KEGG通路分析 采用clusterProfile软件对差异基因集进行KEGG通路富集分析。由于突变体表型是穗颖壳突变为紫色,所以在KEGG通路中重点关注类黄酮生物合成(Flavonoid biosynthesis)中的差异基因(图4、图5)。研究结果(图4)表明,从PD/ME中分析明显差异基因主要是:Os12g0240900(柚皮素7-O-甲基转移酶)、Os10g0317900(cytochrome P450)、Os03g0819600(金黄色颖壳和节间,OsCHI);ME/F8中分析明显差异基因主要是:Os12g0240900(柚皮素7-O-甲基转移酶),Os10g0317900 (cytochrome P450)、Os03g0819600(金黄色颖壳和节间,OsCHI)、Os11g0116300(chalcone-flavonone isomerase);PD/F8中分析明显差异基因主要是:Os11g0116300(chalcone-flavonone isomerase)、Os09g0422000(transferase family protein)。因此,推测Os03g0819600可能是影响紫色颖壳的一个关键基因。
3 结论与讨论
在水稻中,一些光诱导表达基因OsCHS1、OsCHI和OsF3′H是受调控蛋白调控与色素的沉着有关[15]。 先前研究表明OsCHS1和OsCHI[16]是同源序列,OsDFR和OsANS1[17]是水稻花青素中具功能特征的结构基因。当前类黄酮途径突变体研究主要集中在花和种子,例如种子颜色突变体有拟南芥、玉米、水稻及小麦[18]。在过去几年随着水稻基因组测序后颖壳种皮着色开始研究,其外壳包括外稃和内稃与真双子叶植物的萼片相对应[19]。黄金颖壳(gh2)和褐沟抑制剂(ibf)2个基因已经在水稻颖壳和其他物种中开展相关研究[20]。研究表明OsCHI在类黄酮中的重要作用,其新陈代谢可能会影响稻壳的颜色[21]。樱花素是一种存在于水稻中的类黄酮抗真菌植保素,主要编码柚皮素7-O-甲基转移酶(NOMT)的OsNOMT;NOMT是生产库脲酸的关键酶[22]。此外,水稻中类黄酮特异性途径基因的表达调控似乎独立于玉米中的花青素途径基因,研究通过RNA-Seq分析确定紫色果皮水稻基因型,来比较类黄酮生物合成途径相关基因的差异表达,结果表明水稻黄酮合酶Ⅱ(CYP93G1)插入突变体缺乏tricin,将改变木质素组成,提高生物量消化率[23]。
本研究從水稻籼稻转化体组织培养中筛选获得1个紫色颖壳杂合突变体(PiX),利用高通量测序分析表明,紫色颖壳形成对颖壳内水解酶活性影响较大,其次主要是影响颖壳内类黄酮生物合成的基因发生变化,主要集中在柚皮素7-O-甲基转移酶、细胞色素P450、金黄色颖壳控制基因(OsCHI)、查尔酮异构酶和一些转移酶家族蛋白,其中与PiX突变表型影响关系较大的主要是金黄色颖壳控制基因(OsCHI)。
参考文献:
[1]FAIRHURST T,DOBERMANN A.Rice in the Global Food Supply[J].Better Crops International,2002,16:3-6.
[2]HAN S J,RYU S N,KANG S.A new 2-arylbenzofuran with antioxidant activity from the black colored rice (Oryza sativa L.) bran[J].Chemical & pharmaceutical bulletin,2004,52(11):1365-1366.
[3]GHASEMZADEH A,KARBALAII M T,JAAFAR H Z E,et al.Phytochemical constituents,antioxidant activity,and antiproliferative properties of black,red,and brown rice bran[J].Chemistry Central Journal,2018,12(1):17.
[4]HOU Z,QIN P,ZHANG Y,et al.Identification of anthocyanins isolated from black rice (Oryza sativa L.) and their degradation kinetics[J].Food Research International,2013, 50(2):691-697.
[5]SUPAPOHN Y,CHANAKAN P.The potential of high-anthocyanin purple rice as a Functional ingredient in human health[J].Antioxidants (Basel),2021,10(6):833.
[6]ZHANG S,ZHANG A,WU X,et al.Transcriptome analysis revealed expression of genes related to anthocyanin biosynthesis in eggplant (Solanum melongena L.) under high-temperature stress[J].BMC Plant Biology,2019,19(1):387.
[7]LI D T,WANG P P,LUO Y H,et al.Health benefits of anthocyanins and molecular mechanisms: update from recent decade[J].Critical Reviews in Food Science and Nutrition,2017,57(8):1729-1741.
[8]GOMEZ C,CONEJERO G,TORREGROSA L,et al.In vivo grapevine anthocyanin transport involves vesicle-mediated trafficking and the contribution of anthoMATE transporters and GST[J].The Plant Journal,2011,67(6):960-970.
[9]YANG X H,WANG J R,XIA X Z,et al.OsTTG1,a WD40 repeat gene,regulates anthocyanin biosynthesis in rice[J].The Plant Journal,2021,107(1):198-214.
[10]XU W J,GRAIN D,SOPHIE B,et al.Complexity and robustness of the flavonoid transcriptional regulatory network revealed by comprehensive analyses of MYB-bHLH-WDR complexes and their targets in Arabidopsis seed[J].New Phytologist,2014,202(1):132-144.
[11]CHIN H S,WU Y P,HOUR A L,et al.Genetic and evolutionary analysis of purple leaf sheath in rice[J].Rice,2016,9(1):8-22.
[12]ZHENG J,WU H,ZHU H B,et al.Determining factors,regulation system,and domestication of anthocyanin biosynthesis in rice leaves[J].New Phytologist,2019,223(2):705-721.
[13]FURUKAWA T,MAEKAWA M,OKI T,et al.The Rc and Rd genes are involved in proanthocyanidin synthesis in rice pericarp[J].The Plant journal,2007,49(1):91-102.
[14]AKHTER D,QIN R,NATH U K,et al.A rice gene,OsPL,encoding a MYB family transcription factor confers anthocyanin synthesis,heat stress response and hormonal signaling[J].Gene,2019,699:62-72.
[15]SHIH C H,CHU H,TANG L K,et al.Functional characterization of key structural genes in rice flavonoid biosynthesis[J].Planta,2008,228(6):1043-1054.
[16]DRUKA A,KUDRNA D,RPSTOKS N,et al.Chalcone synthase gene from rice (Oryza sativa) and barley (Hordeum vulgare): physical,genetic and mutation mapping[J].Gene,2003,302(1-2):171-178.
[17]REDDY A M,REDDY V S,SCHEZER B E,et al.Novel transgenic rice overexpressing anthocyanidin synthaseaccumulates a mixture of Xavonoids leading to an increased antioxidant potential[J].Metabolic Engineering,2007,9(1):95-111.
[18]GROTEWOLD E.The genetics and biochemistry of floral pigments[J].Annual Review of Plant Biology,2006,57(1):761-780.
[19]SWEENEY M T,THOMSON M J,PFEIL B E,et al.Caught red-handed: Rc encodes a basic helix-loop-helix protein conditioning red pericarp in rice[J].Plant Cell,2006,18(2):283-294.
[20]CUI J J,FAN S Z,SHAO T,et al.Characterization and fine mapping of the ibfmutant in rice[J].Journal of Integrative Plant Biology,2007,49(5):678-685.
[21]HONG L L,QIAN Q,TANG D,et al.A mutation in the rice chalcone isomerase gene causes the golden hull and internode 1 phenotype[J].Planta,2012,236(1):141-151.
[22]SATOSHI O,KOJI M,KEIICHIROU N,et al.OsMYC2,an essential factor for JA-inductive sakuranetin production in rice,interacts with MYC2-like proteins that enhance its transactivation ability[J].Scientific Reports,2017,7:40175.
[23]LAM PY,TOBIMATSU Y,TAKEDA Y,et al.Disrupting flavone synthase Ⅱ alters lignin and improves biomass digestibility[J].Plant Physiology,2017,174(2):972-985.
(責任编辑:林玲娜)

