基于铁调素调控铁代谢相关蛋白探讨脑泰方干预氧糖剥夺损伤的神经元保护机制
王建君 余清平 郭丹 廖君 彭骅
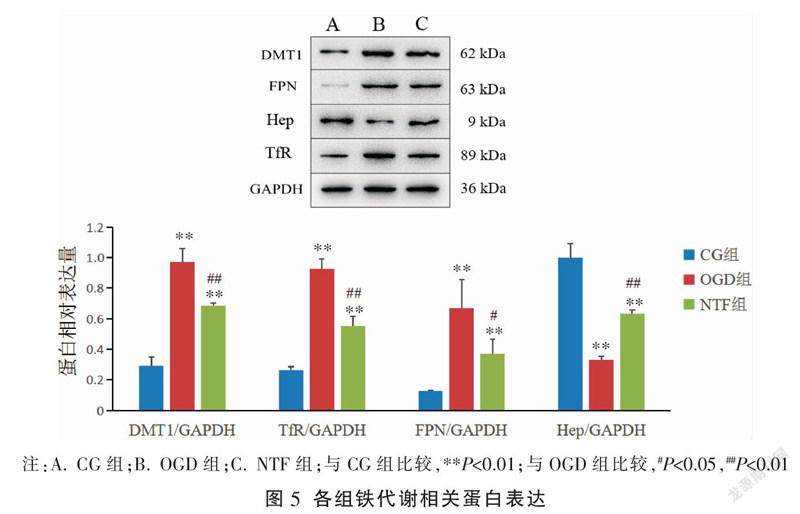
〔摘要〕 目的 觀察大鼠原代神经元氧糖剥夺损伤后,脑泰方通过调节二价金属离子转运体1(divalent metal transporter 1,DMT1)、转铁蛋白受体(transferrin receptor, TfR)、铁调素(hepcidin, Hep)及膜铁转运蛋白(ferroportin, FPN)表达变化,探讨脑泰方对氧糖剥夺损伤神经元保护机制。方法 将原代培养大鼠神经元随机分为对照(CG)组、氧糖剥夺模型(OGD)组、脑泰方干预氧糖剥夺模型(NTF)组。MTT法检测各组神经元细胞存活率;荧光探针检测各组神经元细胞内二价铁离子(Fe)、活性氧(reactive oxygen species, ROS)浓度;Western blot法检测各组神经元细胞Hep、DMT1、TfR、FPN蛋白表达。结果 与CG组比较,OGD组、NTF组神经元细胞存活率均明显降低(P<0.01);与OGD组比较,NTF组神经元细胞存活率明显升高(P<0.01)。与CG组比较,OGD组、NTF组神经元细胞内Fe、ROS浓度均明显升高(P<0.01);与OGD组比较,NTF组神经元细胞内Fe、ROS浓度均显著降低(P<0.01)。与CG组比较,OGD组、NTF组神经元细胞Hep表达均明显降低(P<0.01),DMT1、TfR、FPN表达均明显升高(P<0.01);与OGD组比较,NTF组神经元细胞Hep表达明显升高(P<0.01),DMT1、TfR、FPN表达均明显降低(P<0.01,P<0.05)。结论 脑泰方通过促进神经元细胞Hep的表达,抑制神经元细胞DMT1、TfR、FPN表达,减少氧糖剥夺损伤后神经元细胞内Fe及ROS聚积,起到保护神经元,减轻氧糖剥夺损伤的作用。
〔关键词〕 脑泰方;脑缺血;铁调素;二价金属离子转运体1;转铁蛋白受体;膜铁转运蛋白;氧糖剥夺;神经元
〔中图分类号〕R255.2 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.04.005
Mechanism of Naotaifang intervention on oxygen-glucose deprivation injury of neurons based on hepcidin regulating iron metabolism related proteins
WANG Jianjun YU Qingping GUO Dan LIAO Jun PENG Hua
(1. Medical School of Hunan University of Chinese Medicine, Changsha, Hunan 410208, China;
2. Changsha Health Vocational College, Changsha, Hunan 410100, China)
〔Abstract〕 Objective To explore the protective mechanism of Naotaifang on neurons by observing the expression changes of divalent metal transporter 1 (DMT1), transferrin receptor (TfR), hecpidin (Hep) and membrane iron transporter ferroportin (FPN) after oxygen-glucose deprivation injury in primary neuronal. Methods The rat neurons were maturely cultured and then randomly divided into the control (CG) group, the oxygen-glucose deprivation model (OGD) group and Naotaifang interventing the oxygen-glucose deprivation (NTF) group. Cell viability was measured by MTT assay in each group. The intracellular concentration
of ferrous iron (Fe) and reactive oxygen species (ROS) in neurons of each group were detected by fluorescent probe. The expression of Hep, DMT1, TfR, FPN were analyzed by Western blot. Results Compared with the CG group, the survival rate of neurons in OGD group and NTF group was significantly lower (P<0.01); compared with OGD group, the survival rate of neurons in NTF group was significantly higher (P<0.01). Compared with CG group, the concentrations of Fe and ROS in neurons of OGD group and NTF group were significantly increased (P<0.01); compared with OGD group, the concentrations of Feand ROS in neurons of NTF group were significantly decreased (P<0.01). Compared with CG group, the expression levels of Hep in neurons of OGD group and NTF group were significantly decreased (P<0.01), while the expression levels of DMT1, TfR and FPN were significantly increased (P<0.01); compared with OGD group, the expression of Hep in neurons of NTF group was significantly increased (P<0.01), while the expression levels of DMT1, TfR and FPN were significantly decreased (P<0.01, P<0.05). Conclusion Naotaifang can protect neurons and reduce damage of oxygen-glucose deprivation injury by increasing the expression of Hep, inhibiting the expression of DMT1,TfR and FPN, reducing the accumulation of Fe and ROS in neurons after oxygen-glucose deprivation injury.
〔Keywords〕 Naotaifang; cerebral ischemia; hepcidin; divalent metal transporter 1; transferrin receptor; ferroportin; oxygen-glucose deprivation; neuron
缺血性脑卒中是人类三大死因之一,具有高发病率、高致残率、高死亡率的特点,严重危害人类健康,加重社会负担[1]。缺血性脑卒中损伤病理机制主要包括神经炎症、氧化应激、兴奋性氨基酸毒性、钙离子超载等[2]。近年来研究发现铁代谢包括细胞内外二价铁离子(Fe)摄取、储存与外排,而铁代谢紊乱是脑缺血损伤的重要病理机制[3]。铁是人体必需的微量元素,参与线粒体呼吸链的电子传递、神经纤维髓鞘及神经递质合成,对维持大脑正常生理功能起着至关重要的作用[4-5]。Fe也是一种催化剂,在缺氧状况下,能显著增加活性氧(reactive oxygen species, ROS)的浓度,导致脂质过氧化和氧化应激,最终引发线粒体功能紊乱、神经元坏死[6-7]。因此,维持铁稳态是保证神经元正常新陈代谢的重要因素。铁调素(hepcidin, Hep)是肝细胞分泌产生的肽类物质,由25个氨基酸长链组成,是机体内铁代谢的关键调节分子[8-9]。Hep与膜铁转运蛋白(ferroportin,FPN)结合,诱导其内化、降解,抑制细胞内铁的释放,通过负反馈调节,Hep-FPN轴可维持全身铁稳态[10]。研究发现,Hep也可通过抑制神经元铁代谢相关蛋白二价金属离子转运体1(divalent metal transporter 1, DMT1)、转铁蛋白受体(transferrin receptor, TfR)的表达,减少铁聚积[11]。探索缺血性脑卒中后铁代谢失调的病理机制,及通过干预Hep调节铁稳态研究,可提供脑缺血损伤防治的潜在治疗靶点。缺血性脑卒中属于中医学“中风”范畴,中医药防治缺血性脑卒中多采用“益气活血,祛瘀通络”的治则[12-13]。脑泰方是本课题组多年应用于临床治疗缺血性脑卒中的有效方剂,具有益气活血,祛瘀通络的功效[14]。前期研究发现,脑泰方可通过干预脂质代谢抑制铁死亡,改善脑缺血后神经元损伤[15-16]。因此,开展脑缺血后Hep调节神经元铁代谢机制研究,为脑泰方临床应用提供重要实验依据,为中医药防治缺血性脑卒中机制的研究拓宽新的方向。
1 材料
1.1 细胞及分组
大鼠原代神经元细胞用加B27的Neurobasal基础培养基,在37 ℃含5% CO的细胞培养箱中培养,将神经元细胞随机分为对照(CG)组、氧糖剥夺模型(OGD)组、脑泰方干预氧糖剥夺模型(NTF)组。
1.2 实验动物
SPF级SD大鼠3只,体质量250~280 g,8周龄,16~18 d孕鼠1只,1 d新生鼠10只,由湖南斯莱克景达實验动物有限公司提供,合格证号:SYXK(湘)2019-0009。实验伦理审批号:LL20207160002,符合SPF级实验动物标准。饲养于湖南中医药大学SPF级实验动物中心,实验前适应性饲养1周。
1.3 药物、主要试剂和仪器
脑泰方组成:黄芪40 g,地龙15 g,僵蚕15 g,川芎10 g,中药饮片均购自湖南中医药大学第一附属医院(批号分别为CK21070602、2021031902、HH21051802、TH21063004)。
DMEM/F12培养基、FBS、青链霉素、胰酶、胎牛血清均购自美国Hyclone公司(批号分别为SH30023、SH30070、SV30010、SH30042、SH30070);PBS(南京生兴生物技术有限公司,批号:SN331);Neurobasal培养基、B27、Glutamine均购自美国Gibco公司(批号分别为21103049、17504044、25030081);DMSO、Protease inhibitor cocktail均购自美国Sigma公司(批号分别为C6295、P8340);MTT、HRP抗小鼠抗体、HRP抗兔抗体、BCA蛋白浓度测定试剂盒均购自上海碧云天生物技术有限公司(批号分别为C0009S、A0216、A0208、P0010);ROS试剂盒(南京建成生物工程研究所有限公司,批号:E004-1-1);30%聚丙烯酰胺、Tris-base、过硫酸铵、甘氨酸、SDS、Tween-20、蛋白marker、脱脂奶粉均购自北京Solarbio科技有限公司(批号分别为A1010、T8060、A1030、G8200、S8010、T8220、PR1910、D8340);PVDF膜(美国Millipore公司,批号:ISEQ00010);ECL发光液(上海天能科技有限公司,批号:180-5001);甲醇、盐酸均购自南京化学试剂股份有限公司(批号分别为C0690110281、C0680110228);TEMED(美国Alladin公司,批号:T105496);DMT1(美国Proteintech公司,批号:20507-1-AP);TfR、FPN、Hep均购自美国Abcam公司(批号分别为ab269513、ab235166、ab30760);GAPDH(美国Abbkine公司,批号:A01020)。
CO培养箱、酶标仪均购自美国Thermo Fisher Scientific公司(型号分别为3131、Multiskan 51119000)、MetalloFluor FeRhonox-1 Fe(Ⅱ)活细胞成像探针(日本Goryo Chemical公司,型号:GC901);荧光显微镜(日本Nikon仪器有限公司,型号:Ts2R);离心机(常州金坛区西城新瑞仪器厂,型号:80-2)。
2 方法
2.1 原代神经元培养[17]
打开水浴,预热培养液,消毒操作区,灭菌解剖器械。在每个60 mm的培养基中加入4 mL DMEM/F12培养基,1个100 mm的培养皿中加入15 mL DMEM/F12培养基,一个15 mL离心管中加入13 mL DMEM/F12培养基(均放置在冰上)。处死16~18 d孕鼠,然后取出胎鼠脑,并将取出来的脑放到1个装有培养基的60 mm皿中,在解剖镜下去除脑膜,把干净的大脑皮质放在1个60 mm皿中,使用灭菌的眼科剪将组织剪15 min。加入5 mL 0.125%胰酶,震荡混匀,放入37 ℃水浴中15 min(每3~4 min轻轻上下颠倒离心管,使消化均匀)。加入DMEM/F12培养基中和胰酶作用,过细胞筛,1000 r/min,离心半径33.6 cm,离心5 min。移除上清液,加入5 mL
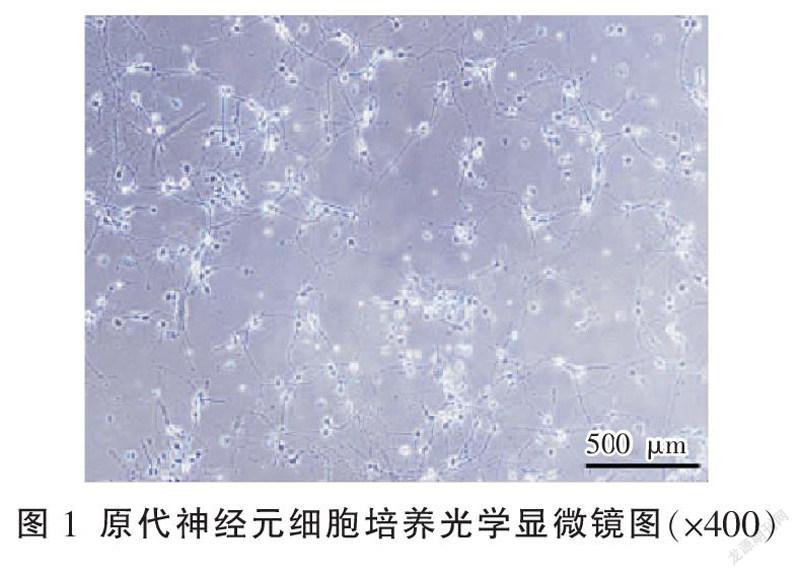
DMEM/F12培養基,清洗两次。吹打10~15次,静置片刻收集上清液,小心取出细胞悬液,移至15 mL离心管中,收集细胞悬液到15 mL离心管,1000 r/min,离心半径33.6 cm,离心5 min。细胞计数之后,种植到6孔板和24孔板中。4 h后去除培养基加入维持培养基(含Neurobasal培养基、B27、Glutamine及PBS),每隔3 d半量换液。大鼠原代神经元细胞培养光学显微镜结果显示:可见高度分化的神经元细胞,细胞核大而圆,细胞质内含尼氏小体,细胞突起丰富。见图1。
2.2 含药血清的制备
将中药放入水中浸泡2 h,煮沸后微火煎煮30 min,过滤留汤汁,药渣加3倍量的水再煎煮20 min,将汤汁混合后在水浴锅中浓缩至生药量5 g/mL,置于4 ℃冰箱中保存备用。通过HPLC和HRMS分别对脑泰方含药血清中的3个代表性化合物和4个有效成分进行了验证,主要化合物为盐酸川芎嗪2.07 μg/mL、阿魏酸286.96 μg/mL、毛蕊异黄酮葡萄糖苷176.23 μg/mL[18]。取3只成年雄性SD大鼠适应性饲养1周后制备脑泰方含药血清,按体表面积换算,2倍剂量灌胃给予大鼠(生药量28.8 g/kg)[19],每天1次,连续7 d,于末次给药后1 h无菌条件下行颈总动脉取血,分离血清,0.22 μm过滤灭菌后置于-80 ℃冰箱留存备用。
2.3 氧糖剥夺模型造模方法[20]
原代神经元细胞培养成熟后,一部分接种在96孔板中,每孔3×10个,另一部分接种在3.5 cm玻璃底培养皿中,每孔1×10个。根据分组将培养基去除,加入opti-MEM培养基,放入含1% O的培养箱中4 h后,除去opti-MEM培养基,更换为基础培养基,NTF组在缺氧后加入10%的含药血清,共同放入常氧培养箱中培养24 h。
2.4 MTT法检测神经元细胞存活率
在96孔板内加入MTT,再培养3 h,去除孔内液体,每孔加入150 μL DMSO,摇晃均匀,用酶标仪在570 nm波长测定光密度(optical density, OD)值,计算公式为:神经元细胞存活率=(OGD或NTF组OD值-空白孔平均OD值)/(CG组OD值-空白孔平均OD值)×100%,实验中空白孔OD值分别为0.045、0.046、0.046、0.051、0.049、0.047,求出平均值后分析结果。
2.5 各组神经元细胞内Fe浓度测定
使用FeRhoNoxTM-1评估神经元细胞内Fe浓度。FeRhoNoxTM-1是一种可激活的荧光探针,通过橙色(红色)荧光特异性检测不稳定的Fe2+离子在神经元细胞内的浓度。将3.5 cm玻璃底培养皿中的培养基去除,加入预冷的PBS轻轻洗涤2次,随后加入5 μmol/L Fe检测试剂混匀后,放入37 ℃含5%CO2的培养箱中培养60 min。去除培养基,加入预冷的PBS洗3次,在荧光显微镜下拍照,使用Image J软件进行扫描,计算公式为:平均荧光OD值=该区域荧光OD值总和/该区域面积,得出数据后分析结果。
2.6 各组神经元细胞内ROS浓度测定
用DCFH-DA探针测定细胞浓度。将3.5 cm玻璃底培养皿中的培养基去除,加入预冷的PBS轻轻洗涤2次,加入基础培养基1 mL,再加入1 μL ROS试剂,放入37 ℃含5%CO的培养箱中培养60 min。去除培养基,加入预冷的PBS洗3次,在荧光显微镜下拍照,用Image J软件分析检测荧光OD值,计算公式为:平均荧光OD值=该区域荧光OD值总和/该区域面积,得出数据后分析结论。
2.7 Western blot测定神经元细胞铁代谢相关蛋白的表达
提取30 mg细胞组织,提取总蛋白,用BCA法测定总蛋白量,确定最终上样量为30 μg,取出上样样品至0.5 mL离心管中,加入5倍浓度的SDS并稀释至1倍浓度,于沸水中煮5 min使蛋白变性。电泳,转膜,5%脱脂奶粉TBST溶液封闭,将一抗用含1% BSA的TBST溶液稀释(稀释比例为TfR 1∶1000、DMT1 1∶1000、FPN 1∶2000、Hep 1∶1000、GAPDH 1∶5000),于4 ℃孵育过夜,将二抗用TBST按照1∶5000稀释,室温下孵育2 h后,TBST在室温下脱色摇床上洗3次,每次10 min,用Tanon
5200化学发光成像仪下拍照,得出数据,进行数据分析。
2.8 统计学方法
采用SPSS 22.0统计学软件进行数据分析。计量资料以“x±s”表示,均服从正态分布且各组间方差齐,采用单因素方差分析。以P<0.05为差异有统计学意义。
3 结果
3.1 各组神经元细胞存活率比较
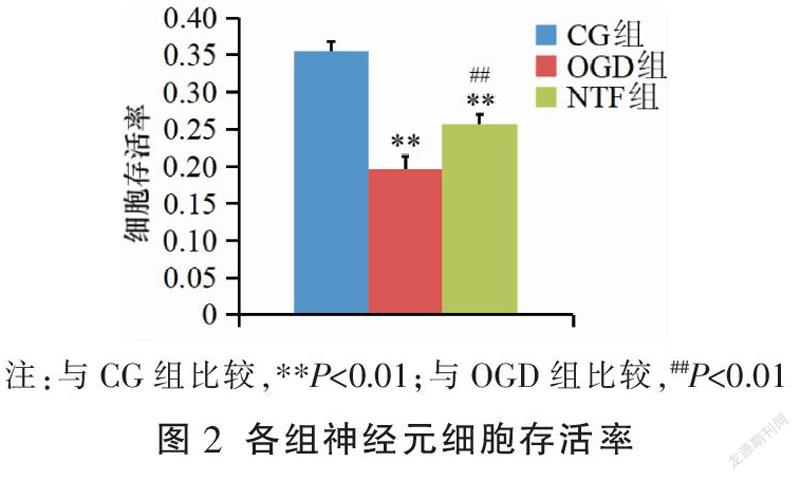
与CG组比较,OGD组、NTF组神经元细胞存活率均明显降低(P<0.01);与OGD组比较,NTF组神经元细胞存活率明显升高(P<0.01)。见图2。
3.2 各组神经元细胞内Fe浓度比较
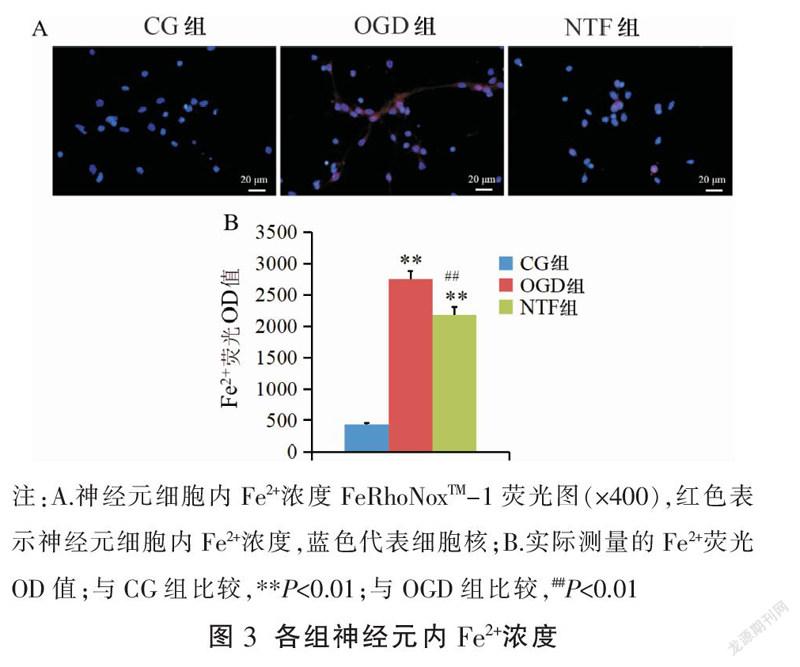
与CG组比较,OGD组、NTF组神经元细胞内Fe2+浓度均明显升高(P<0.01);与OGD组比较,NTF组神经元细胞内Fe浓度明显降低(P<0.01)。见图3。
3.3 各组神经元细胞内ROS浓度比较
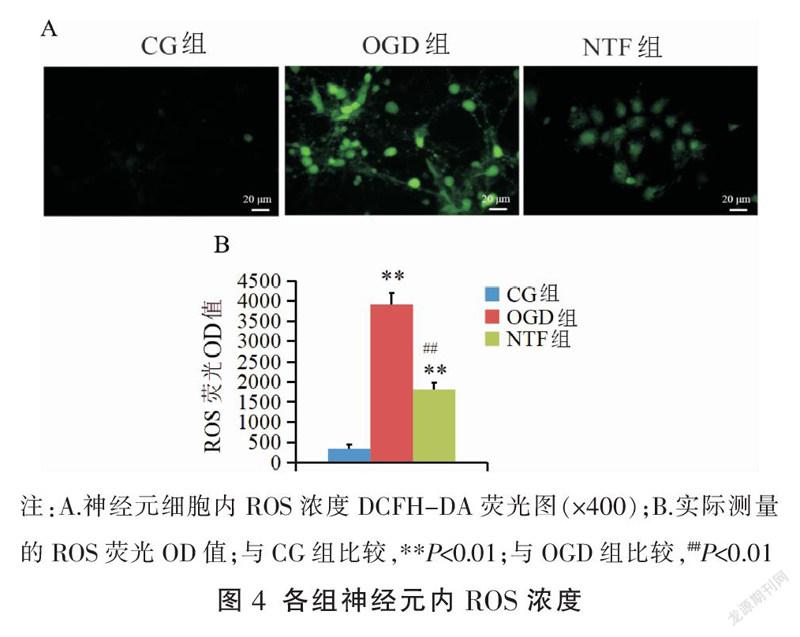
与CG组比较,OGD组、NTF组神经元细胞内ROS浓度均明显升高(P<0.01);与OGD组比较,NTF组細胞内ROS浓度明显降低(P<0.01)。见图4。
3.4 各组神经元细胞铁代谢相关蛋白比较
与CG组比较,OGD组神经元细胞Hep表达明显降低(P<0.01),DMT1、TfR、FPN表达均明显升高(P<0.01);与OGD组比较,NTF组Hep表达明显升高(P<0.01),DMT1、TfR、FPN表达均明显降低(P<0.05,P<0.01)。见图5。
4 讨论
Fe2+是人体内不可或缺的微量元素之一,参与呼吸链电子传递、神经纤维髓鞘及神经递质的合成[21]。在细胞质和溶酶体、线粒体等细胞器中存在不稳定铁池,过量游离铁通过芬顿反应生成大量ROS,造成细胞坏死、凋亡[22-23]。近年来研究表明,铁超载及氧化应激诱导线粒体损伤也是脑缺血损伤的病理机制之一[24-25]。观察大脑中动脉闭塞大鼠模型术后及脑梗死患者,发现Fe摄入增多,加重缺血区氧化应激、兴奋性毒性及炎症反应,脑梗死体积明显增加[26-27]。高铁饮食小鼠在脑原位血栓栓塞后,缺血再灌注损伤较假手术组严重[28-29]。而减少铁聚集,维持神经元Fe稳态可减少ROS产生,缓解脑缺血及继发性损伤[3]。因此,抑制脑缺血后神经元内铁聚集,减少ROS的生成,对脑缺血损伤的治疗及预后具有重要意义。
关于细胞内外Fe转运,本课题组提出了如下工作模式,即“两个中心,3个体系,网络调控”:以Hep及胞浆铁调节蛋白的调节为中心,细胞内铁的摄取、储存与外排是通过铁转运输入蛋白、胞内铁储存蛋白、铁转运输出蛋白3个体系完成;3个体系通过复杂的信号途径对铁进出细胞进行网络调控[30]。
Hep是调节铁稳态的关键蛋白,调控铁的吸收、储存和释放,由肝细胞分泌产生,其生物活性主要由25个氨基酸多肽决定[31]。Hep与FPN结合,内化、降解FPN,Hep-FPN轴通过负反馈调节维持铁稳态[10]。另有研究发现,Hep可通过蛋白酶内化、降解细胞膜的DMT1,从而抑制铁吸收,减少细胞铁聚积[32]。Hep作用机制与细胞类型有关,巨噬细胞中的Hep结合和降解FPN,而肠上皮细胞中的Hecpidin通过抑制DMT1调节铁代谢[33]。Hep及铁相关转运蛋白(DMT1、TfR、FPN)均广泛分布于大脑各区域[34]。阿尔茨海默病中Hep通过负反馈调节FPN导致铁聚集神经元损伤[35]。研究发现Hep能显著抑制神经元及星形胶质细胞中DMT1、TfR、FPN的表达[36];铁调节“旁路模式”中,Hep抑制DMT1、TfR表达,游离Fe通过血脑屏障表达的FPN输出,从而缓解铁沉积[37]。因此,脑缺血后Hep调节神经元铁相关转运蛋白DMT1、TfR、FPN作用机制值得探讨。
中医学认为,中风的病理性质多属“本虚标实”,气血虚衰为本,风、火、痰、气、瘀为标,故中医药治疗多遵循“活血祛瘀、祛风通络”的治则,标本兼治[13]。脑泰方由中药黄芪、川芎、地龙、僵蚕4味药组成,黄芪为君药,其力专,周行全身,大补脾胃元气,气旺则血活,血活则瘀除,以治其本;地龙性寒、味咸,具有息风通络之功效;僵蚕味辛、咸,性平,两者合用共奏通经活络、祛风化痰之功效,均为臣药;川芎活血行气,气行则血行,为“血中之气药”,具有引药上行之功效,是为佐药,4味药配合共奏益气活血、祛瘀通络、标本兼治之效[38]。前期研究发现,脑泰方通过调节大鼠神经元铁相关转运蛋白(TfR、FPN等)的表达,抑制铁的细胞内转运,促进铁外排,起到保护神经元的作用[39-40]。本实验通过原代培养神经元,氧糖剥夺损伤后Fe2+聚集、ROS生成明显增多(P<0.01),神经元细胞存活率明显降低(P<0.01);脑泰方干预可明显减少Fe聚集、减少ROS生成(P<0.01),明显升高神经元细胞存活率(P<0.01)。氧糖剥夺后Hep表达明显降低(P<0.01),同时DMT1、TfR、FPN表达均明显升高(P<0.01);脑泰方干预后Hep表达明显升高(P<0.01),DMT1、TfR、FPN表达均明显减少(P<0.01,P<0.05)。由此,推测神经元缺氧缺糖培养后,脑泰方通过促进Hep生成,降解铁相关输入蛋白DMT1、TfR,从而抑制铁聚集,减少ROS生成,起到保护神经元的作用。
参考文献
[1] 何天鹏.脑缺血-再灌注损伤后炎症反应及其保护机制的研究[D].兰州:甘肃中医药大学,2020.
[2] 郎丰山,黄云霞,薛 云,等.脑缺血再灌注损伤病理生理机制研究进展[J].食品与药品,2018,20(4):312-316.
[3] 廖 君,王建君,余清平,等.益气活血脑泰方干预脑缺血后铁代谢相关机制研究[J].世界中医药,2021,16(22):3331-3336.
[4] 罗 宁,吴海辉,葛金文.神经胶质细胞在脑铁代谢中的作用[J].医学综述,2021,27(13):2516-2522.
[5] BASTIAN T W, RAO R, TRAN P V, et al. The effects of early-life iron deficiency on brain energy metabolism[J]. Neuroscience Insights, 2020, 15: 2633105520935104.
[6] 段昭远,吴明莉,罗 萌,等.脊髓损伤后神经元铁死亡:谷胱甘肽过氧化物酶4的调控[J].中国组织工程研究,2022,26(12):1956-1962.
[7] 卜忠奇. Steap4促进脑缺血再灌注损伤中神经元铁死亡的机制研究[D].沈阳:中国医科大学,2021.
[8] AGARWAL A K, YEE J. Hepcidin[J]. Advances in Chronic Kidney Disease, 2019, 26(4): 298-305.
[9] SANEELA S, IQBAL R, RAZA A, et al. Hepcidin: A key regulator of iron[J]. the Journal of the Pakistan Medical Association, 2019, 69(8): 1170-1175.
[10] 吴海辉,葛金文.铁调素在缺血性脑卒中后铁稳态失衡中的调控作用[J].医学综述,2021,27(18):3581-3586,3591.
[11] LAN B, GE J W, CHENG S W, et al. Extract of Naotaifang, a compound Chinese herbal medicine, protects neuron ferroptosis induced by acute cerebral ischemia in rats[J]. Journal of Integrative Medicine, 2020, 18(4): 344-350.
[12] 崔保星,郭新玲.補阳还五汤在治疗气虚血瘀型中风中的效果观察[J].航空航天医学杂志,2021,32(6):652-653.
[13] 李晓琼,林荣清,杨璧璘,等.中医药治疗缺血性中风研究新进展[J].辽宁中医药大学学报,2019,21(11):145-147.
[14] 贺运河,郝晓元,葛金文.脑泰方治疗气虚血瘀证脑梗塞临床研究[J].中国中医急症,2001,10(6):319-320,334.
[15] 贺 超,廖 君,兰 斌,等.脑泰方对脑梗死后铁死亡-脂质代谢通路蛋白表达的影响[J].中华中医药杂志,2020,35(11):5491-5494.
[16] 曾劲松,李 弘,廖 君,等.脑泰方对脑出血急性期大鼠神经细胞过氧化损伤的干预作用及机制研究[J].湖南中医药大学学报,2020,40(7):817-822.
[17] 杨利强,徐伟杰,关 欣. miR-132在氧糖剥夺诱导原代皮质神经元缺血损伤中的作用[J].中风与神经疾病杂志,2020,37(8):676-679.
[18] YANG T, CHEN X Y, MEI Z G, et al. An integrated analysis of network pharmacology and experimental validation to reveal the mechanism of Chinese medicine formula Naotaifang in treating cerebral ischemia-reperfusion injury[J]. Drug Design, Development and Therapy, 2021, 15: 3783-3808.
[19] LIAO J, XIA X, WANG G Z, et al. Naotaifang extract treatment results in increased ferroportin expression in the Hippocampus of rats subjected to cerebral ischemia[J]. Molecular Medicine Reports, 2015, 11(6): 4047-4052.
[20] 何伟亮,田小超,崔丽丽,等.大脑皮质神经元细胞的原代培养模型建立及鉴定[J].脑与神经疾病杂志,2020,28(7):407-409.
[21] GEORGIEFF M K. Iron assessment to protect the developing brain[J]. The American Journal of Clinical Nutrition, 2017, 106(supplement 6): 1588S-1593S.
[22] NAKAMURA T, NAGURO I, ICHIJO H. Iron homeostasis and iron-regulated ROS in cell death, senescence and human diseases[J]. Biochimica et Biophysica Acta General Subjects, 2019, 1863(9): 1398-1409.
[23] 袁艳波,马志胜.地黄饮子联合去铁胺对脑出血患者氧化应激的影响研究[J].心理月刊,2019,14(1):143-144.
[24] 易 欣,刘 畅,周 易,等.铁死亡与缺血再灌注损伤关系的研究进展[J].广西医学,2021,43(7):858-862.
[25] 蒋如如,李 欣,哈小琴.铁死亡与脑损伤的关系[J].中风与神经疾病杂志,2019,36(6):574-576.
[26] 库亚萍,张 丽,李 冰,等.川蛭通络胶囊通过抑制神经炎症和氧化应激治疗小鼠脑缺血再灌注损伤[J/OL].中国中药杂志:1-7(2021-11-20)[2022-03-10].DOI:10.19540/j.cnki.cjcmm.20211117.706.
[27] 朱昌华,庄克川.血府逐瘀汤对急性脑梗死患者氧化应激反应及炎症反应的影响[J].光明中医,2021,36(12):2012-2014.
[28] GARC?魱A-Y?魪BENES I, SOBRADO M, MORAGA A, et al. Iron overload, measured as serum ferritin, increases brain damage induced by focal ischemia and early reperfusion[J]. Neurochemistry International, 2012, 61(8): 1364-1369.
[29] DEGREGORIO-ROCASOLANO N, MARTí-SISTAC O, PONCE J, et al. Iron-loaded transferrin (Tf) is detrimental whereas iron-free Tf confers protection against brain ischemia by modifying blood Tf saturation and subsequent neuronal damage[J]. Redox Biology, 2018, 15: 143-158.
[30] 廖 君,葛金文.鐵跨膜转运蛋白与脑神经疾病的相关性研究进展[J].湖南中医药大学学报,2011,31(11):76-78,81.
[31] 孙 玙,何杏玲,杨水泉.血清铁调素水平在脑梗死首发患者中的表达及临床意义[J].中国当代医药,2020,27(21):64-66.
[32] MENA N P, ESPARZA A, TAPIA V, et al. Hepcidin inhibits apical iron uptake in intestinal cells[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2008, 294(1): G192-G198.
[33] LIM D, KIM K S, JEONG J H, et al. The hepcidin-ferroportin axis controls the iron content of Salmonella-containing vacuoles in macrophages[J]. Nature Communications, 2018, 9(1): 2091.
[34] ZECHEL S, HUBER-WITTMER K, VON BOHLEN UND HALBACH O. Distribution of the iron-regulating protein hepcidin in the murine central nervous system[J]. Journal of Neuroscience Research, 2006, 84(4): 790-800.
[35] CHAUDHARY S, ASHOK A, MCDONALD D, et al. Upregulation of local hepcidin contributes to iron accumulation in Alzheimer's disease brains[J]. Journal of Alzheimer's Disease, 2021, 82(4): 1487-1497.
[36] 陈兵兵.脑铁调素对膜铁转运蛋白1、二价金属离子转运蛋白1、铜蓝蛋白及其mRNA的调控[D].太原:山西医科大学,2007.
[37] ZHOU Y F, ZHANG C, YANG G, et al. Hepcidin protects neuron from hemin-mediated injury by reducing iron[J]. Frontiers in Physiology, 2017, 8: 332.
[38] 曾劲松,喻坚柏,廖 君,等.脑泰方对脑出血大鼠脑组织铁沉积致神经细胞过氧化损伤的影响[J].中国中医药信息杂志,2020,27(4):46-51.
[39] 曾劲松,喻坚柏,刘 检,等.脑泰方对血红蛋白诱导的大鼠皮质神经元损伤的保护作用及机制[J].北京中医药大学学报,2019,42(10):825-832.
[40] 曾劲松,喻坚柏,刘 检,等.脑泰方对血红蛋白诱导的大鼠皮质神经元铁超载及过氧化损伤的多靶点干预作用[J].中国中西医结合杂志,2020,40(6):708-714.

