高氯酸介质中的电化学行为
于 婷,张 虎
中国原子能科学研究院 放射化学研究所,北京 102413




1 实验部分
1.1 试剂与仪器
w=70%~72%高氯酸,分析纯,国药集团;Re2O7(纯度≥99%)、K3Fe(CN)6(纯度≥99.5%)、NaCl(纯度99.8%),麦克林公司。
GB204分析天平,精度10-4g,梅特勒公司;CHI-760E电化学工作站,上海辰华仪器有限公司。
1.2 实验方法
定量称取Re2O7固体溶解于高氯酸溶液中配成高铼酸溶液(Re2O7+H2O→2HReO4)。
采用CHI-760E电化学工作站进行电化学测试。电化学实验均在室温下进行,每次实验前首先进行电极预处理:取0.3 μm的氧化铝抛光粉于麂皮上,滴加少量去离子水进行抛光,再在超纯水中超声清洗干净。
实验均采用三电极系统:工作电极为纯度≥99.95%的铂片电极(5 mm×5 mm)或纯度为99.999%的金盘电极(φ=3 mm),对电极为铂网电极,参比电极为饱和甘汞电极(SCE)。实验测量的电位值均为相对于参比电极。
循环伏安测试:由于Re在酸性介质中的稳定氧化态为Re(Ⅶ)和Re(Ⅳ),而Re(Ⅴ,Ⅵ)是它的不稳定氧化态,为了能够在实验过程中观察到Re的中间价态,实验前对溶液进行多次循环扫描(扫描范围-0.20~+1.40 V)的预处理,待循环伏安曲线上出现中间价态Re的峰电流时,进行单次循环伏安扫描测试并记录数据。
2 结果与讨论
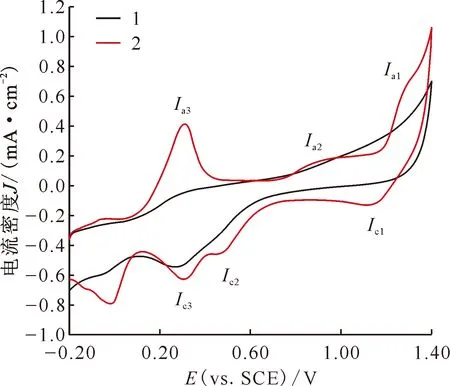
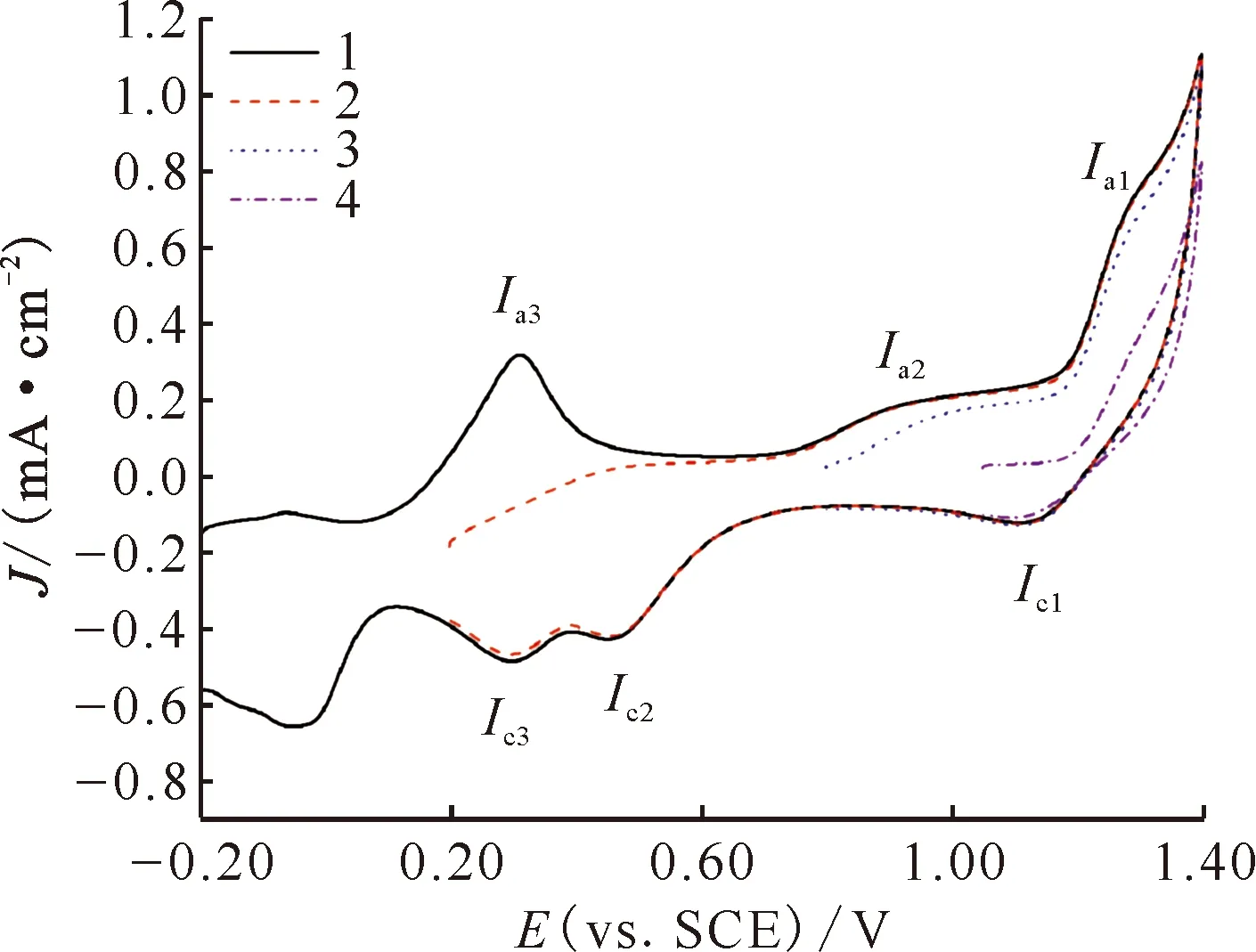
起始电位-0.20 V,扫描范围-0.20~+1.40 V,扫描速率0.10 V/s1——未经过预处理,2——经过预处理图 HClO4在Pt电极上的循环伏安曲线 Fig.1 Cyclic voltammograms of 4.0 mmol/L mol/L HClO4 on Pt electrode

溶液,扫描速率0.10 V/s,工作电极Pt片电极起始电位,V:1——-0.20,2——+0.20,3——+0.80,4——+1.05图2 不同起始电位下的循环伏安曲线Fig.2 Cyclic voltammograms of different initial potential

改变不同的扫描速率得到图3所示的CV曲线,其中Ic2和Ia2的电化学参数列于表1,Ic1和Ia1的电化学参数列于表2。正向扫描过程中,由表1数据可知,随着扫描速率增大,氧化峰电势Ea2逐渐增大,表明氧化电流峰Ia2具有不可逆特征,由峰电势与半峰电势差值的绝对值∣Ea2-Ea2/2∣=47.7/αn(mV),计算得到αn=0.55,其中α是传递系数,对于大多数体系,α值在0.3~0.7之间,在没有确切测量时通常可近似为0.5[12],故计算得到转移电子数n为1.1,因此,推测电流峰Ia2处发生的反应为Re(Ⅳ)-e-→Re(Ⅴ)。对于氧化电流峰Ia1,随着扫描速率由0.02 V/s增大至0.12 V/s,Ia1与v1/2呈线性关系,由表2可知,氧化峰电势Ea1保持(1.291±0.004) V不变,其峰电势与半峰电势之差|Ea1-Ea1/2|的平均值为58 mV,接近可逆波的电势差值∣Ea1-Ea1/2∣=56.5/n(mV)。因此,Ia1峰具有可逆波的特征,故对应的反应为Re(Ⅵ)氧化为Re(Ⅶ)。
在负向扫描时,由表2数据可见,还原电流峰Ic1同样具有可逆反应特征,其∣Ec1-Ec1/2∣=77 mV,计算得到转移电子数n为0.73,故Ic1峰可能为Re(Ⅶ)还原至Re(Ⅵ)[9]。对于Ic2峰,根据不可逆反应特征,计算得到转移电子数n为0.70,因此,发生的反应为Re(Ⅵ)还原至Re(Ⅴ)。

溶液;起始电位-0.20 V,扫描范围-0.20~+1.40 V,工作电极Pt片电极图3 不同扫描速率下的循环伏安曲线Fig.3 Cyclic voltammograms of different scan rates
表溶液在Pt电极上的Ic2、Ia2循环伏安参数Table 1 Data for Ic2, Ia2 cyclic voltammetry of 4.0 mmol/L mol/L HClO4 solution on Pt electrode

表溶液在Pt电极上的Ic1、Ia1循环伏安参数Table 2 Data for Ic1, Ia1 cyclic voltammetry of 4.0 mmol/L mol/L HClO4 solution on Pt electrode

工作电极Pt片电极(a)——+1.40 V→-0.20 V,(b)——-0.20 V→+1.40 V 图的差分脉冲伏安曲线Fig.4 Different pulse voltammetry curves of 4.0 mmol/L mol/L HClO4
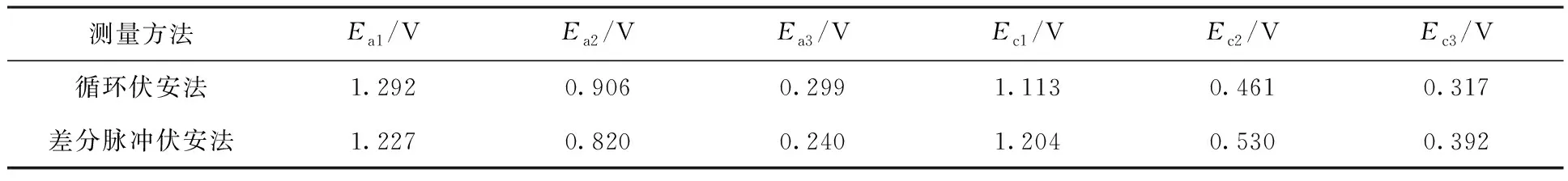
表3 循环伏安法与差分脉冲伏安法峰电位值的对比Table 3 Comparison of peak potential for cyclic voltammetry and differential pulse voltammetry

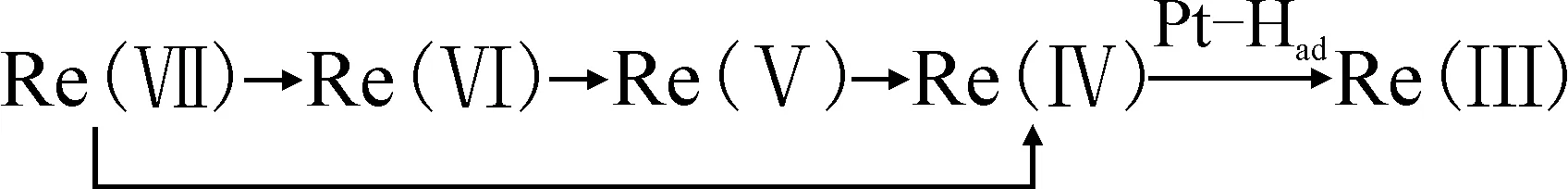

起始电位-0.20 V,扫描范围-0.20 ~+1.40 V,扫描速率0.10 V/s1——未经过预处理,2——经过预处理图 HClO4溶液在Au电极上的循环伏安曲线Fig.5 Cyclic voltammograms of 4.0 mmol/L in 0.50 mol/L HClO4 on Au electrode

溶液,阴极电流6 μA,工作电极Au电极图6 计时电位曲线Fig.6 Chronopotentiometric curves

Re(Ⅶ)→Re(Ⅵ)→Re(Ⅴ)→Re(Ⅳ)→Re(Ⅲ)→Re(0)
3 结 论


