TBAB水合物和冰粉吸附CO2的表征分析
陈玉凤,胡榕华,李 强
(梧州学院 化学工程与资源再利用学院,广西 梧州 543002)
二氧化碳(CO2)的大量排放已带来严重的环境问题,随着我国“双碳”目标的提出以及碳交易制度的实行,对CO2进行捕集和资源化利用将成为未来研究的热点。CO2捕集技术主要包括膜分离法、氨净化法、碳酸盐吸收法等。近年来,水合物法捕集CO2作为一种极具应用潜力的新型分离技术,其具有吸附材料价格低廉、合成条件相对温和以及控制条件单一等优点,成为碳捕集与封存技术领域的研究热点[1-2]。然而,这一技术走向大规模工业化应用,还需要从增大水合物对混合气体的选择吸收性、提高水合物的形成速率以及改善水合物的赋存条件3个方面进行突破。水合物的晶体结构和客体分子的分子尺寸对水合物的稳定性具有重要影响,因此,选用尺寸合适的客体分子来提高水合物的相平衡温度也成为水合物法捕集CO2的研究热点之一[3-4]。
半笼型水合物是一种以季铵盐类化合物作为客体分子和以水分子为主体结构的晶体,在相对温和的高压低温环境下对混合气体中的CO2具有较好的吸附性能[5-7]。四丁基溴化铵(TBAB)是一种常用于合成半笼型水合物的客体分子。研究表明,半笼型水合物在低于3 MPa的环境中能够从N2/CO2或H2/CO2的混合气体中分离出体积分数为80%~90%的CO2,是一种高效的水合物法CO2捕集材料[8-11]。以往的研究通常采用季铵盐溶液作为CO2捕集材料,通过在溶液中形成TBAB水合物的过程来捕集CO2,这种方法需要消耗总能量的12%~15%用于结晶相变过程[12],同时气-液-固三相体系也使得水合物法分离CO2的装置复杂化,难以建立起对混合气体中CO2的连续捕集装置。半笼型水合物晶体在常压下可以保持稳定,并且能够通过改变环境压力来控制TBAB水合物对气体的吸附和释放。因此,直接利用制备好的半笼型水合物晶体来捕集CO2不仅可以降低相变所带来的能量损失,同时也可以减少反应体系中反应物的相态数量,有利于水合物法捕集CO2技术的应用与发展。
TBAB是最常用的用于合成半笼型水合物的客体分子之一,具有较低的毒性和较好的可降解性,其形成的水合物具有多种晶体结构,其中TBAB·38H2O水合物是最常见的晶体,能够在常压和温度不高于286.00 K的条件下稳定存在。TBAB·38H2O水合物通常在低浓度TBAB溶液中形成,属于正交晶系Pmma。每个晶胞中包含6个512笼,4个51262笼,4个51263笼和两个作为客体分子的TBA+阳离子。其中,每个TBA+阳离子被由两个51262笼和两个51263笼组成的大笼包裹,剩余的6个512小笼则通过水分子和氢键构成的五元环相互连接并可以用来捕集气体分子,如图1所示[13]。典型的CO2水合物(sI型)属于立方晶系(Pm3n)。每个晶胞中包含两个512笼和6个51262笼,其笼形结构需要CO2作为客体分子加以稳定,因此具有较高储气密度[14]。但是,由于sI型水合物中两种笼形结构均可以捕集气体分子,其对CO2的选择吸收性低于TBAB·38H2O水合物;此外,不同于半笼型水合物,CO2水合物无法在常压下保持稳定,采用典型的sI型水合物捕集CO2需要面临繁复的相变过程。因此,相比于TBAB半笼型水合物,典型CO2水合物在CO2捕集方面的应用潜力较弱[15]。
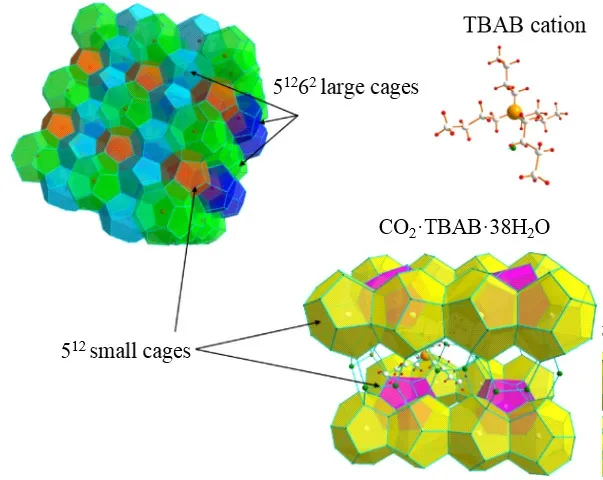
图1 TBAB·38H2O水合物和sI型CO2水合物的晶体结构示意[13]Fig. 1 Crystal structural diagrams of sI and TBAB·38H2O hydrates[13]
为了验证半笼型水合物能以固体形态直接在一定压力环境中吸附CO2,同时测量TBAB·38H2O水合物吸附CO2的动力学特性,本实验在常压下制备出 TBAB·38H2O水合物,并在278.00 K、2 MPa的CO2环境下采用原位拉曼测量TBAB·38H2O水合物吸附CO2的动力学过程。为了区别TBAB·38H2O水合物与典型气体水合物吸附CO2的拉曼光谱变化特征,实验同时对比测量了冰粉(Ih型冰)在271.70 K、2 MPa条件下形成CO2水合物的原位拉曼光谱变化过程。本研究结果可为开发基于固态流化技术的新型水合物法CO2捕集技术,建立半笼型水合物捕集CO2的动力学模型提供理论基础。
1 实验部分
1.1 实验材料及试剂
实验采用纯度为99.0%的TBAB作为水合物的合成材料,由东京化成株式会社提供。制备水合物和冰粉的水由实验室自制,其电阻率约为18.0 mΩ/cm。
1.2 TBAB水合物和冰粉的制备
TBAB·38H2O水合物晶体制备过程为:在晶体培养皿中配制质量分数为10%的TBAB溶液,然后放置在277.20 K的低温室中用于培养TBAB·38H2O水合物。TBAB·38H2O水合物晶体通常呈六角柱状,放射状生长[16]。当水合物晶体生成之后将其从母液中取出,并放置在滤纸上干燥。最后,将干燥后的水合物晶体在液氮环境中充分研磨并在液氮中保存。
冰粉则通过将纯水直接滴入液氮中冷却结冰后充分研磨获得。
1.3 TBAB水合物和冰粉分析与表征
1.3.1 TBAB水合物的水合数测定
实验采用离子色谱(883 Basic IC plus, Metrohm)测定了TBAB水合物样品的水合数,步骤如下:首先从液氮中取出约1 g TBAB水合物粉末进行准确称量并在室温下溶解、稀释;随后提取少量稀释后的溶液注入离子色谱中测定稀释后溶液中Br-的浓度;最后,根据水合物样品质量和稀释所用水的质量计算出TBAB水合物样品的水合数。结果显示,本实验所制得的TBAB·38H2O水合物的水合数为38.04 ± 0.19。
1.3.2 TBAB水合物和冰粉的分解热测定
实验采用差示扫描量热仪(DSC 6000,PerkinElmer)分析测定了TBAB水合物和冰粉的分解热。具体步骤如下:首先取出约0.02 g样品并准确称量,然后将其迅速转移至差示扫描量热仪中进行测量,升温速率设定为1.5 K/min,最后根据样品质量和分解热曲线计算出样品的溶解点和分解热,结果如图2所示。由图2可以看出,冰粉和TBAB·38H2O水合物的溶解温度分别为(273.06 ± 0.08) K和(282.96 ± 0.13) K,分解热分别为(318 ± 3.7) J/g和(217 ± 2.5) J/g,与文献[17-18]中结果一致。
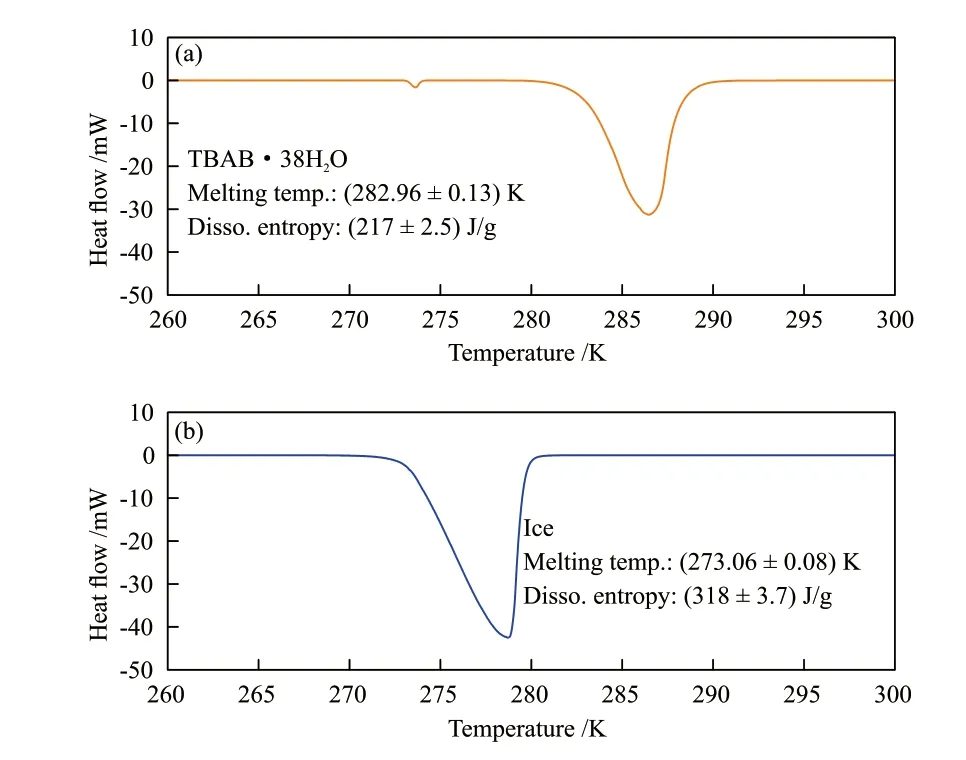
图2 TBAB·38H2O水合物(a)和Ih型冰(b)的DSC分解热曲线Fig. 2 DSC decomposition heat curves of TBAB·38H2O hydrate (a) and Ih ice (b)
1.3.3 TBAB水合物和冰粉吸附CO2的原位拉曼表征
实验采用共聚焦拉曼光谱仪(LabRAM HR,Horiba)和自行设计的原位拉曼测试平台对TBAB·38H2O水合物和冰粉吸附CO2过程进行了原位拉曼表征分析。
(1)TBAB·38H2O水合物吸附CO2的表征。首先将原位拉曼反应釜预冷至278.00 K,然后从液氮中取出少量水合物样品放入原位拉曼反应釜的载物台上,利用拉曼光谱仪所配备的显微镜寻找到合适的测点后,向反应釜内快速注入CO2至2 MPa;在水合物吸附CO2的过程中,使原位拉曼反应釜内的温度和压力保持恒定,拉曼光谱仪在水合物样品表面的测点也始终保持固定,且每5 min测量一次。
(2)冰粉吸附CO2形成水合物的表征。先将原位拉曼反应釜预冷至271.70 K,然后按照与TBAB·38H2O水合物吸附CO2的测量过程相同的步骤完成测量。
1.3.4 TBAB水合物和冰粉吸附CO2的PXRD表征
实验通过粉末X射线衍射仪(X’pert PRO MPD,PANalytical B.V.)对TBAB水合物和冰粉吸附CO2前后的水合物样品粉末以及冰粉的晶体结构改变进行进一步测量。首先将常压下制备的TBAB·38H2O水合物粉末、冰粉以及原位拉曼测量后获得的水合物和冰粉样品分别在液氮环境中充分研磨,再分别置于预冷至233.00 K的粉末X射线衍射仪中的低温载物台上进行样品的PXRD测量。
2 结果与讨论
2.1 TBAB水合物和冰粉的原位拉曼表征
TBAB·38H2O水合物在278.00 K、2 MPa和冰粉在271.70 K、2 MPa条件下吸附CO2的原位拉曼谱图如图3所示。由于受到费米共振的影响,CO2分子在拉曼谱图上呈现出2处比较明显的特征峰[19]。图3(a)中,位于1284 cm-1和1387 cm-1处的拉曼峰为CO2分子在气相中的特征峰,位于1274 cm-1和1380 cm-1处的拉曼峰为CO2分子位于TBAB水合物相中的特征峰,而位于1284 cm-1和1387 cm-1处的拉曼峰为CO2分子在sI型水合物相中的特征峰[20]。TBAB·38H2O水合物由于仅依靠512小笼结构来捕集CO2分子,而sI型水合物中的512笼和51262笼均可以俘获CO2分子,因此CO2分子在两种晶体结构中的特征峰存在位移上的改变。在TBAB水合物中,除了CO2分子的上述特征峰,其余位于1100~1500 cm-1谱带的拉曼峰均为TBAB阳离子中的C—C键伸缩振动和C—H键弯曲振动形成的拉曼峰[21]。图3(b)中,位于2200~3800 cm-1谱带的拉曼峰反映了水合物和冰粉中水分子的O—H键的伸缩振动峰以及TBA+阳离子中C—H键的伸缩振动峰[22]。可以看到,CO2被吸附前后TBAB·38H2O水合物的特征峰均没有发生显著改变,表明TBAB·38H2O水合物晶体结构在吸附CO2前后保持了较好的稳定性;而冰粉吸附CO2的过程经历了从冰到sI型水合物的晶体结构转变,位于3100~3200 cm-1谱带的水分子振动峰在吸附CO2后出现了明显的上升。
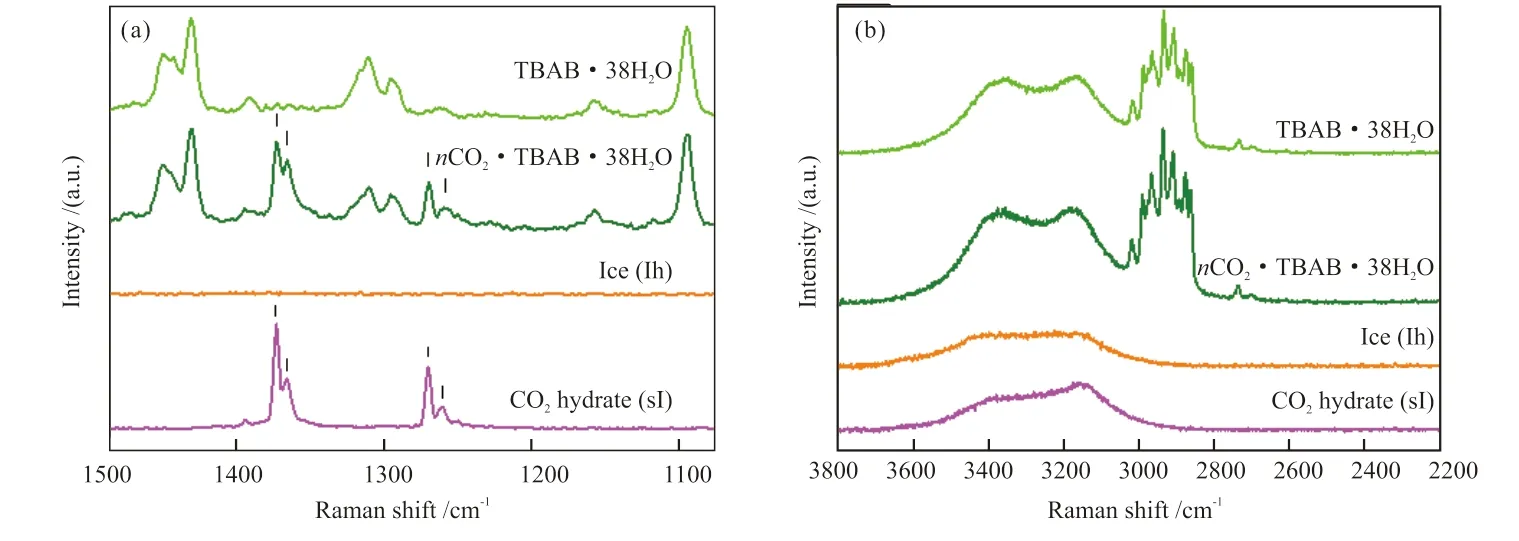
图3 TBAB·38H2O水合物和 Ih型冰吸附CO2前后的拉曼谱图:1100~1500 cm-1谱带(a);2200~3800 cm-1谱带(b)Fig. 3 Raman spectra of TBAB·38H2O hydrate and Ih ice before and after CO2 adsorption: 1100 cm-1 to 1500 cm-1 band (a);2200 cm-1 to 3800 cm-1 band (b)
图4为TBAB·38H2O水 合 物 在278.00 K、2 MPa和冰粉在271.70 K、2 MPa条件下吸附CO2过程的原位拉曼谱图。在TBAB·38H2O水合物吸附CO2的过程中,CO2位于1280 cm-1处的特征峰峰强度沿指数衰减曲线增长,如图4(a)所示。同时,TBAB阳离子的拉曼峰均没有发生显著改变,表明TBAB·38H2O水合物能够在晶体形成以后再吸附CO2分子,且吸附过程中不会引起晶体结构的显著改变,与图3中得到的结论相一致。因此,可以认为TBAB·38H2O水合物在吸附过程完成后转变成了nCO2·TBAB·38H2O水合物。
冰粉吸附CO2的过程是一个相变过程,实质为sI型气体水合物的生长过程,不同于TBAB·38H2O水合物通过已经构建好的水合物晶体来实现对CO2分子的吸附。从图4(b)中可以看出,sI型水合物中CO2的特征峰的峰强度也随时间沿指数衰减曲线增长。这表明sI型水合物晶体中CO2的特征峰峰强度是一个逐渐增长的过程,其中的水合物笼并非随着晶胞的形成而一次性填满。然而需要指出的是sI型水合物的水分子主体结构无法离开客体分子而独立存在。因此,结合本实验sI型水合物中CO2的特征峰峰强度逐渐上升这一实验结果,可以推断出CO2水合物形成初期,其晶体结构中存在着一定数量的空笼,而这些空笼需要在后期的吸附过程中被气相中的自由CO2分子逐渐填满。SCHICKS等[23]在研究sI型甲烷水合物形成过程中发现,在甲烷水合物形成初期,甲烷分子在512笼中的特征峰首先出现,随后在51262笼中的特征峰才会出现快速增长。结合这一现象和本实验的研究结果可以推断,sI型水合物在形成初期通过部分已经被客体分子所占据的稳定的笼形结构组成了晶胞,然后进一步吸附气相中的客体分子来逐渐达到稳定状态。
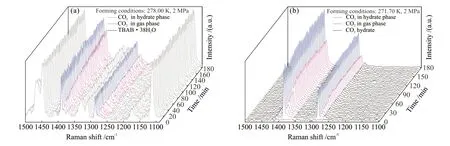
图4 TBAB·38H2O水合物(a)和Ih型冰(b)吸附CO2过程的原位拉曼谱图Fig. 4 In situ Raman spectra of CO2 adsorption by TBAB·38H2O hydrate (a) and Ih ice (b)
尽管在原位拉曼表征测试中,CO2在水合物中的特征峰峰强度与CO2在水合物相中的特征峰峰强度成正比,但是由于测点环境的改变使得不同实验中所获得的绝对峰强度没有较好的可比性。为了进一步定量描述吸附过程中CO2在水合物相中的特征峰峰强度变化,本实验选取水分子在2200~3800 cm-1谱带的O—H键伸缩振动峰的峰强度作为参考,比较了TBAB·38H2O水合物和sI型水合物中CO2分别位于1380 cm-1和1382 cm-1处的特征峰的峰强度增长过程,如图5所示。从图5可以看出,CO2峰相对峰强度的增长过程呈现出两个阶段——快速吸附阶段和缓慢吸附阶段。在快速吸附阶段,CO2的特征峰在两种水合物相中的相对峰强度均呈线性增长;在缓慢吸附阶段,CO2的特征峰在两种水合物相中的相对峰强度增长极为缓慢,基本保持稳定。通过理论计算可知,1体积CO2水合物可以容纳约178标准体积的CO2气体,而1体积TBAB·38H2O水合物可以容纳70标准体积的CO2,即sI型水合物的储气密度约为TBAB水合物的2.5倍,因此CO2在sI型水合物中达到第二阶段时的相对峰强度要明显高于TBAB水合物。可以认为,相对峰强度在快速吸附阶段的增长速率和所消耗的时间是衡量水合物吸附CO2能力的指标。图5中sI型CO2水合物中CO2相对峰强度在快速吸附阶段的增长速率与TBAB水合物中CO2相对峰强度的增长速率基本一致,但是,TBAB水合物中CO2相对峰强度达到稳定所需要的时间为20 min,不到 sI型CO2水合物中CO2相对峰强度达到稳定所需时间的一半。这说明TBAB·38H2O水合物相比于sI型CO2水合物能够更快达到饱和。
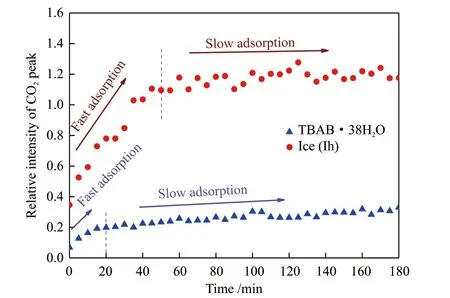
图5 TBAB水合物和Ih型冰吸附CO2过程中CO2相对峰强度的增长Fig. 5 Growth of relative intensity of CO2 peak in TBAB·38H2O hydrate and Ih ice
2.2 TBAB水合物和冰粉的PXRD表征
晶体结构变化是TBAB·38H2O水合物和冰粉在吸附CO2前后最主要的变化特征,因此本实验采用PXRD表征方法测量了两种材料在吸附CO2前后的谱图改变,结果如图6所示。图6(a)中,TBAB·38H2O水合物在吸附CO2后形成了nCO2·TBAB·38H2O水合物,晶体结构的空间群由Pmma转变为Imma,位于2θ= 7.02° 和2θ= 8.39°的衍射峰所代表的(020)和(200)晶面峰强度也发生了改变,与文献[24]结果一致。图6(b)中,冰粉中的水分子与气相中的CO2分子形成了CO2水合物,晶体结构的空间群由P63mmc转变为Pm3n。

图6 吸附CO2前后TBAB·38H2O水合物(a)和Ih型冰(b)的PXRD谱图Fig. 6 PXRD patterns of TBAB·38H2O hydrate (a) and Ih ice (b) before and after CO2 adsorption
结合上述原位拉曼和PXRD结果可看出,TBAB·38H2O水合物吸附CO2过程并没有发生显著的晶体结构转变,而冰粉与高压CO2形成了sI型水合物,该过程如反应式(1)和(2)所示。
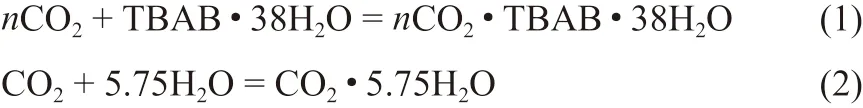
对比TBAB·38H2O水合物和冰粉吸附CO2的动力学过程可知,两种晶体均能以固态形式完成CO2的吸附过程,冰粉通过水分子与CO2分子形成sI型水合物的方式进行吸附,并且需要在冰点以下完成,而TBAB·38H2O水合物能够在晶体结构不发生显著改变的情况下完成对CO2的吸附,同时吸附过程可以在冰点以上完成。因此TBAB·38H2O水合物吸附CO2的过程因相变所消耗的能量更少,运行条件也更加温和。
3 结论
为了验证半笼型水合物能够以固体形态直接吸附CO2,同时测量TBAB·38H2O水合物吸附CO2的动力学特性,实验采用原位拉曼光谱对TBAB·38H2O水合物在278.00 K、2 MPa条件下吸附CO2的过程进行了研究,并与冰粉在271.70 K、2 MPa条件下吸附CO2的过程进行了对比,得到主要结论如下:
(1)TBAB·38H2O水合物和sI型水合物中CO2的增长均可以分成快速吸附和缓慢吸附两个阶段,TBAB·38H2O水合物快速吸附CO2阶段所需的时间更短,能够更快达到吸附饱和。
(2)TBAB·38H2O水合物在吸附CO2后形成了nCO2·TBAB·38H2O水合物,晶体结构的空间群由Pmma转变为Imma;冰粉中的水分子与气相中的CO2分子形成了CO2水合物,晶体结构的空间群由P63mmc转变为Pm3n。
(3)TBAB·38H2O水合物和冰粉均能以固态形式完成对CO2的吸附过程,其中TBAB·38H2O水合物吸附CO2过程并没有发生显著的晶体结构转变,而冰粉与高压CO2形成了sI型水合物;TBAB·38H2O水合物吸附CO2的过程因相变所消耗的能量更少,运行条件也更加温和。
本研究成果验证了TBAB水合物直接吸附CO2的可行性,可为开发基于固态流化技术的新型水合物法CO2捕集技术以及建立半笼型水合物捕集CO2的动力学模型提供理论基础。

