小麦脱植基相关基因在春性小麦叶片叶绿素降解过程中的作用分析
赵 锴 晋秀娟 孙丽丽 闫荣岳 卢 娟 郭 峰 Md Ashraful Islam 史雨刚 孙黛珍
(山西农业大学农学院,030801,山西晋中)
衰老是作物生长发育的必然过程,受多种基因的协同调控[1]。叶片是作物进行一系列化学反应的重要器官,叶片衰老最明显的标志是颜色由绿变黄,特点是叶绿素的大量降解。叶片衰老是在叶片发育的后期,由植物内部多基因控制的一系列有序的衰败过程。小麦叶片衰老伴随着叶绿素降解和籽粒灌浆2个过程,叶片早衰会导致产量的极大损失[2]。因此研究叶绿素降解过程中与脱植基反应相关的基因可为选育高产小麦品种提供理论基础。
高等植物体内的叶绿素包括叶绿素 a(chlorophyll a,Chl a)和叶绿素b(chlorophyll b,Chl b),它们的化学结构高度相似,只是吡咯环II上的附加基团存在差异,Chl a附加基团是甲基(−CH3),Chl b是醛基(−CHO)。自从Hendry等[3]阐明叶绿素降解是一种生化过程之后,人们对叶绿素降解途径的研究就没有停下过脚步。研究[4-6]表明,叶绿素的降解早期发生在叶绿体中,Chl b能在叶绿素b还原酶(chlorophyll b reductase,CBR)的作用下还原生成Chl a。而叶绿素的降解是从Chl a开始的,首先Chl a去镁离子去植基生成脱镁叶绿酸a(pheophorbide a,Pheide a),然后Pheide a在脱镁叶绿酸a氧化酶(pheophorbide a oxygenase,PAO)作用下打开卟啉环转变为红色叶绿素代谢产物(red chlorophyll catabolite,RCC),经红色叶绿素代谢产物还原酶(red chlorophyll catabolite reduetase,RCCR)催化反应转化成初级荧光叶绿素代谢物(primer fluorescent chlcatabolite,pFCC),之后,将其从叶绿体中导出,经过几次修饰运输至液泡中,经过酸性液泡非酶异构催化转化为它们各自的非荧光叶绿素代谢产物(non fluorescent chlorophyll catabolites,NCCs)。
Chl a在生成Pheide a的过程中存在2条不同的途径[7-8]:一条途径是Chl a在叶绿素酶(chlorophyllase,CLH)的作用下,先脱去植基形成脱植基叶绿素a(Chlide a)和叶绿醇,然后Chlide a由一个脱镁螯合物(metal cheating substance,MCS)通过非酶促过程去除Mg2+形成Pheide a,并保持卟啉大环结构;另一条途径是Chl a先在MCS作用下去除Mg2+生成脱镁叶绿素a(Phein a),再在脱镁叶绿素水解酶(pheophytin pheophorbide hydrolase,PPH)的作用下脱去植基,生成Pheide a。在这2条途径中,CLH和 PPH与叶绿素降解过程中的脱植基反应密切相关。研究表明,CLH在西葫芦和烟草[9]等作物叶绿素降解过程的脱植基反应中起主要作用,而PPH在拟南芥[8]、水稻[10]和番茄[11]等作物叶绿素降解过程中的脱植基反应中起主要作用。小麦叶片衰老过程中叶绿素降解究竟是哪条途径,即哪个脱植基相关酶起主要作用,至今并无报道。基于此,本试验以10个春性小麦品种为材料,对小麦花后叶片衰老过程中相对叶绿素含量(SPAD)、功能绿叶面积(green leaf area duration,GLAD)和叶绿素荧光参数[ETR、Fv/Fm、Y(Ⅱ)、qP]的变化以及脱植基反应相关基因(TaCLH和TaPPH)的表达进行相关性分析,初步了解TaCLH和TaPPH在不同春性小麦叶片脱植基降解过程中的作用,为解析小麦叶片叶绿素的降解机制提供参考。
1 材料与方法
1.1 试验材料
供试的10个普通春性小麦(Triticum aestivumL.)品种由山西农业大学小麦育种课题组提供。包括晋麦2148、宁春13号、内麦19号、博爱7023、生选3号、川麦22、绵阳15号、新春8号、宁春4号、青春5号。
1.2 试验设计
2020年10月8日将试验材料种植于山西农业大学农学院申奉试验基地。试验地土壤20cm土层含有机质 19.54g/kg、速效钾 92.77mg/kg、有效磷4.45mg/kg、碱解氮 41.65mg/kg。采用随机区组设计,3次重复,行长2m,行距0.2m,每个品种种植2行,每行点播40粒。11月29日浇越冬水后,用地膜覆盖,翌年2月份揭膜,其他田间管理同一般大田生产。
1.3 测定项目与方法
2021年5月上旬开始统计开花期,各小麦品种每个重复选择开花一致、长势均匀的30株进行挂牌标记。
1.3.1 GLAD 通过目测将小麦GLAD分为10个等级(0~9)[12],叶片全黄记为0,叶片全绿记为9,0~9间数值表示叶片由绿变黄的程度,于花后7d开始记录挂牌小麦主茎旗叶的GLAD等级,每隔3d记录1次。
1.3.2 SPAD 采用美能达公司生产的叶绿素测定仪(SPAD-502,Minolta,日本)于花后7d开始分别测定挂牌小麦主茎旗叶SPAD值,每隔3d测定1次,测定时避开叶脉,每片叶子测定叶片的上、中、下3个部位,取平均值。
1.3.3 衰老特征参数 利用测定的小麦旗叶衰老过程中SPAD和GLAD数据拟合Gompertz曲线,获得小麦旗叶SPAD和GLAD的变化曲线。通过对Gompertz曲线求一阶和二阶导数得出小麦衰老过程中的特征参数,包括最大衰老速率(MRS)、达到最大衰老速率的时间(TMRS)、衰老起始时间(Ts)和衰老终止时间(T0)。
1.3.4 叶绿素荧光参数 使用便携式叶绿素荧光仪(MINI-PAM-Ⅱ,Walz,德国)于花后7d开始对挂牌小麦主茎进行测量,每隔3d测定1次。叶绿素荧光参数包括光合电子传递速率(ETR)、PSII最大光化学量子产量(Fv/Fm)、PSII实际光化学量子产量[Y(Ⅱ)]和光化学猝灭系数(qP)。
1.3.5 基因表达分析 在田间测定之后,取相应小麦旗叶立即放入液氮中带回实验室,置于-80℃超低温冰箱中保存备用。使用天根生化科技(北京)有限公司RNA提取试剂盒进行小麦总RNA提取,使用宝日医生物技术(北京)有限公司RNA反转录试剂盒进行小麦cDNA分离,使用荧光定量试剂盒进行小麦基因表达的测定。
1.4 数据处理
采用Microsoft Excel 2016进行数据整理、分析与制图,用SAS软件进行衰老特征参数的计算,用SPSS 23软件进行方差分析和相关性分析。
2 结果与分析
2.1 不同品种春性小麦花后旗叶 SPAD及 GLAD值的动态变化
从图1a可以看出,随着花后籽粒灌浆过程的进行,参试的10个小麦材料旗叶SPAD值呈先平缓下降后快速下降的趋势,快速下降的转折点出现在花后19~22d。花后各时期小麦品种川麦22旗叶SPAD值均明显高于其他品种。从图1b可以看出,随着花后籽粒灌浆的进行,参试的10个小麦材料旗叶GLAD值整体上在7~19d平缓下降,19d之后呈现快速下降趋势。
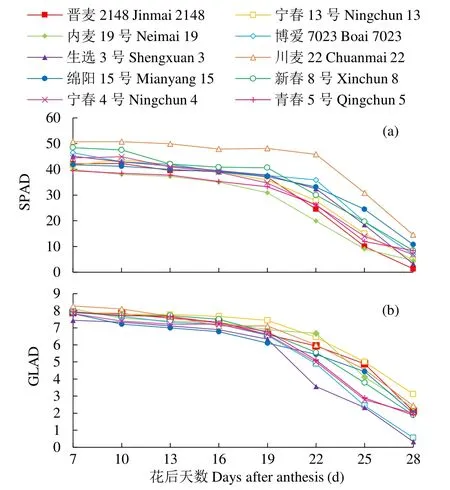
图1 不同品种春性小麦花后主茎旗叶SPAD和GLAD值的动态变化Fig. 1 Dynamic changes of SPAD and GLAD values of flag leaves on main stem of different spring wheat varieties after anthesis
2.2 基于SPAD和GLAD值的不同品种春性小麦叶片衰老特征与聚类分析
从表1可以看出,参试品种的衰老特征参数存在差异。基于SPAD值,博爱7023、生选3号、川麦22和绵阳15号衰老起始时间晚,MRS高,具有较短的衰老持续时间,衰老快。内麦19号、新春8号、宁春4号和青春5号衰老起始早,但MRS小,即衰老缓慢,衰老持续时间长,衰老终止晚。基于GLAD值的10个春性小麦品种的MRS和Ts没有显著差异,衰老缓慢,衰老持续时间长,导致衰老终止晚。
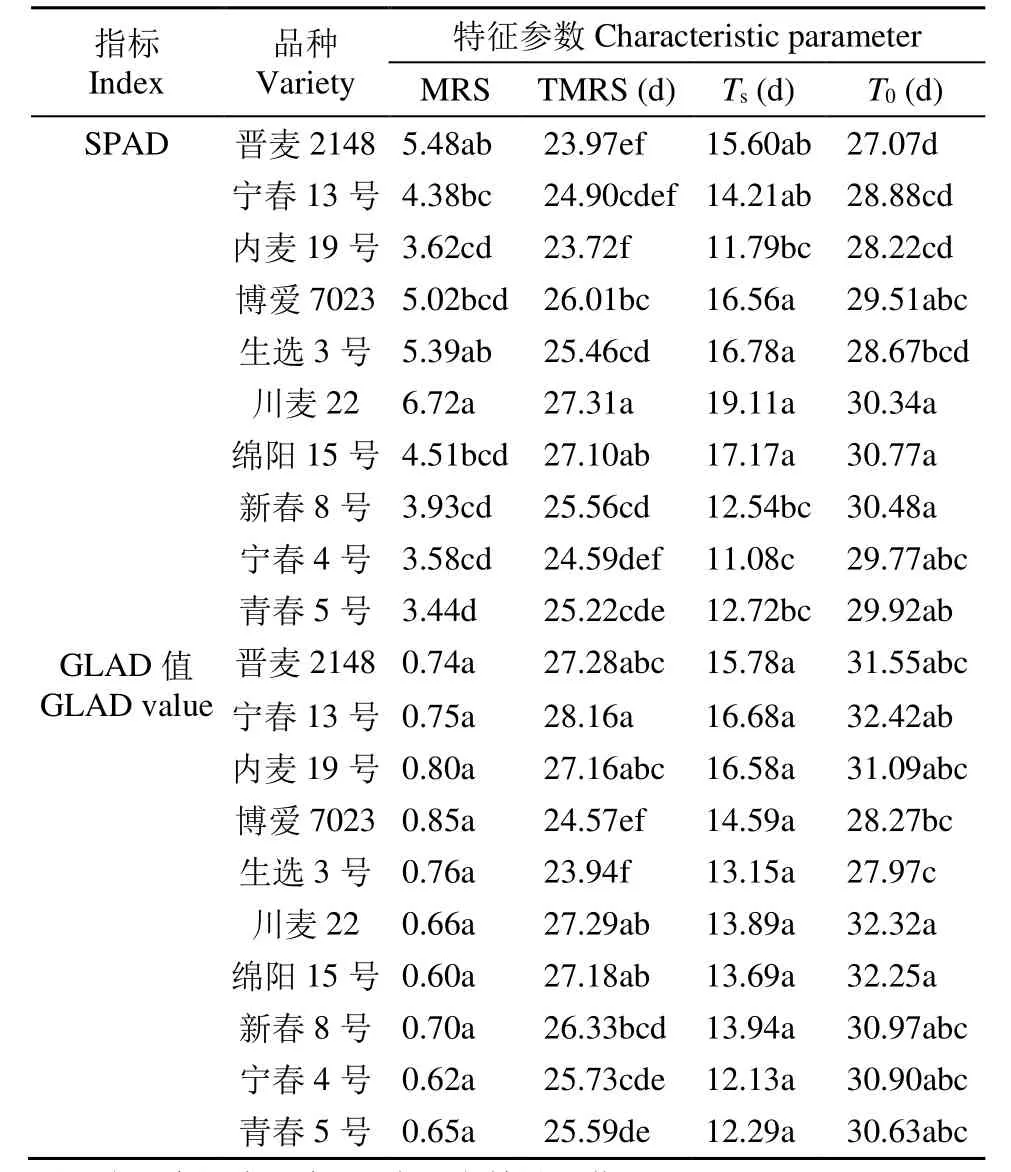
表1 不同品种春性小麦花后基于SPAD及GLAD值的衰老特征参数Table 1 Aging characteristic parameters based on SPAD and GLAD values in different spring wheats after anthesis
基于花后SPAD值的衰老特征参数对参试的10个小麦材料进行系统聚类(图2),参试的10个小麦材料可分为 3类,类群Ⅰ包括晋麦 2148、博爱7023、生选3号、绵阳15号和川麦22这5个品种,类群Ⅱ包括内麦19号、新春8号、青春5号和宁春4号这4个品种,类群Ⅲ包括宁春13号。

图2 不同品种春性小麦基于SPAD值的系统聚类图Fig.2 The systematic clustering diagram of different spring wheat based on SPAD values
从表2可以看出,基于SPAD值,类群Ⅱ与类群Ⅰ、Ⅲ相比,虽然衰老起始早,但由于最大衰老速率较小,使得衰老终止较晚,其持绿期较长。类群Ⅰ与类群Ⅱ、Ⅲ相比,虽然衰老起始时间晚,但是衰老最大速率大,使得衰老终止早,持绿期较短。因此,我们把类群Ⅰ归为非持绿性品种,类群Ⅱ归为持绿性品种,类群Ⅲ为中间类型。
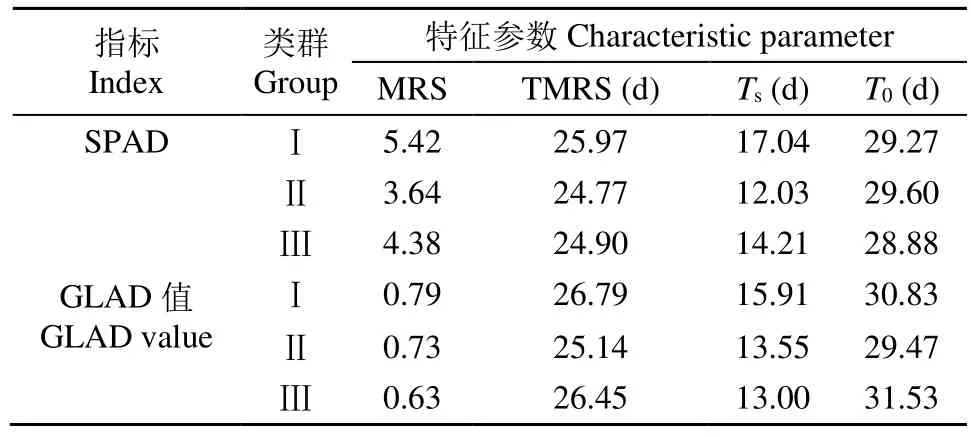
表2 3类小麦基于SPAD和GLAD值的衰老特征参数Table 2 Aging characteristic parameters based on SPAD and GLAD values in three groups of wheat
基于花后 GLAD值的衰老特征参数对参试的10个小麦材料进行系统聚类(图3),参试的10个小麦材料可分为3个类群,类群Ⅰ包括晋麦2148、宁春13号、内麦19号和博爱7023这4个品种,类群Ⅱ包括生选3号和新春8号这2个品种,类群Ⅲ包括川麦22、绵阳15号、宁春4号和青春5号这4个品种。从表2可以看出,基于GLAD值,类群Ⅲ与类群Ⅰ、Ⅱ相比,虽然衰老起始早但由于最大衰老速率较小,使得衰老终止较晚,其持绿期较长。类群Ⅰ与类群Ⅱ和Ⅲ相比,虽然衰老起始时间晚但是衰老最大速率大,衰老终止早持绿期较短。因此,我们把类群Ⅰ归为非持绿性品种,类群Ⅱ为中间类型,类群Ⅲ归为持绿性品种。
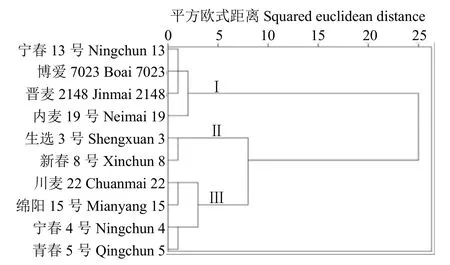
图3 不同品种春性小麦基于GLAD值的系统聚类图Fig.3 The systematic clustering diagram of different spring wheat based on GLAD values
2.3 不同品种春性小麦花后旗叶叶绿素荧光参数的动态变化
随着灌浆过程的进行,10个春性小麦品种旗叶荧光参数整体呈现出前期平缓波动后期急剧下降的趋势,后期下降的速度存在品种间差异(图4)。
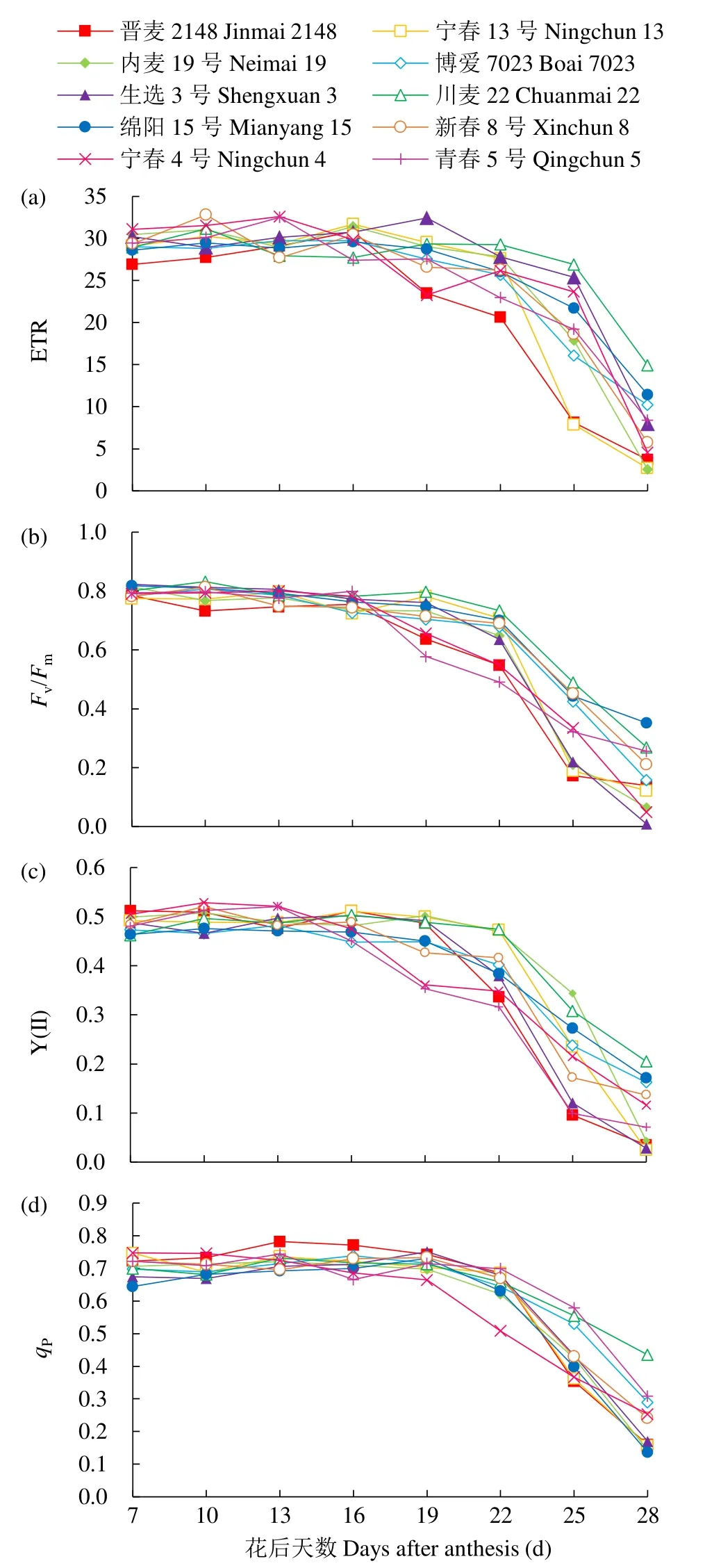
图4 不同品种春性小麦花后主茎旗叶荧光参数动态变化Fig.4 Dynamic changes of chlorophyll fluorescence parameters of flag leaves on main stem of different spring wheat varieties after anthesis
无论是基于GLAD还是SPAD值,青春5号和宁春4号都属于持绿型品种,晋麦2148和博爱7023都属于非持绿型品种,通过比较(图5)发现,在小麦花后25d时,持绿型小麦品种的ETR、Fv/Fm和qP均高于非持绿型品种,在小麦花后28d时,持绿型小麦品种的Fv/Fm和qP均高于非持绿型品种。
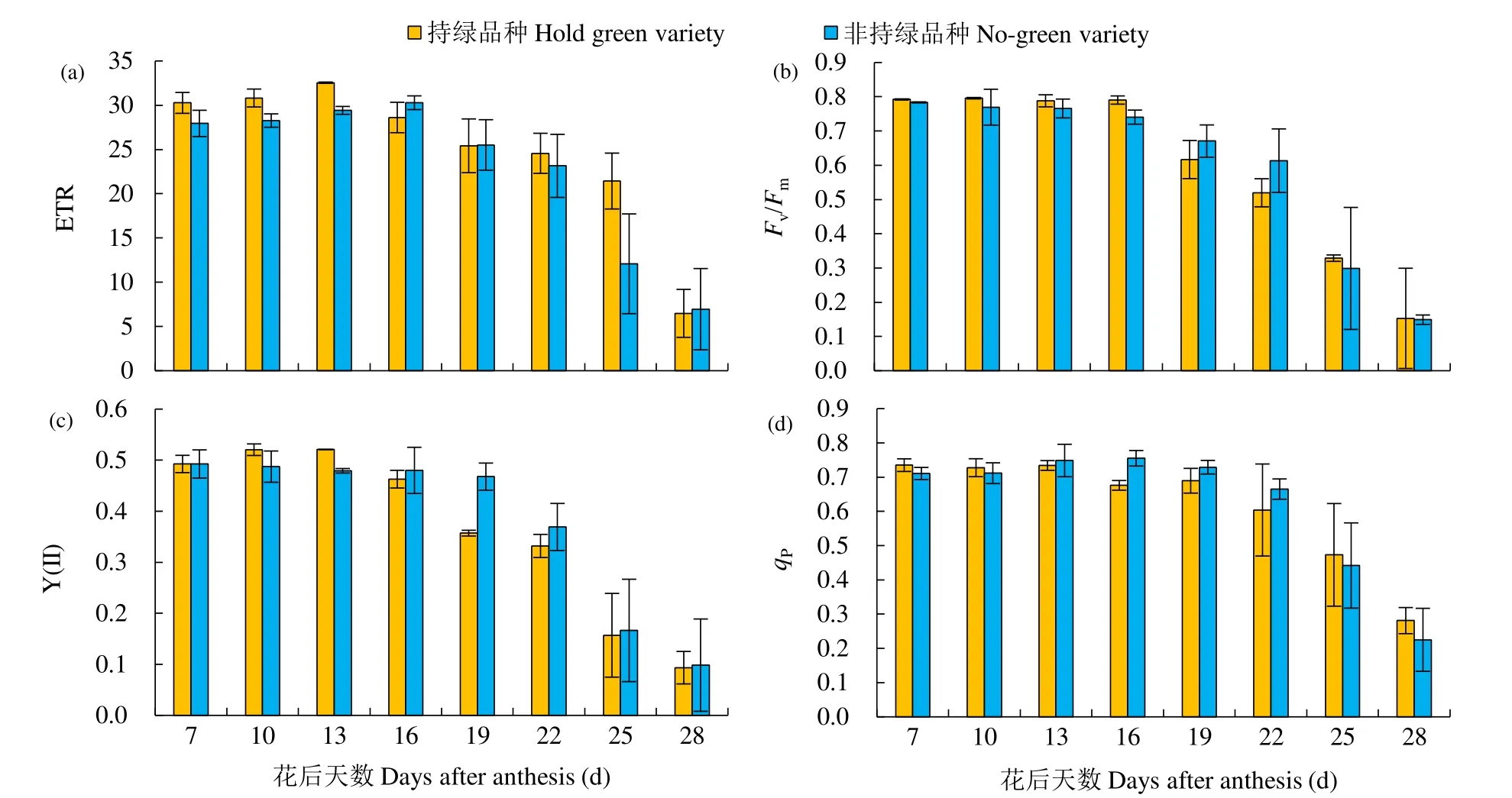
图5 2种持绿类型小麦花后不同阶段旗叶荧光参数的动态变化Fig.5 Dynamic changes of chlorophyll fluorescence parameters of flag leaves in different postanthesis stages of two types of wheats
2.4 不同品种春性小麦旗叶衰老过程中TaCLH和TaPPH的表达分析
从图6可以看出,在10个春性小麦品种花后旗叶不断衰老的过程中,旗叶叶绿素降解过程中与脱植基反应相关的2个基因TaCLH与TaPPH的相对表达量有明显的峰值和差值。TaCLH基因在花后旗叶衰老过程中相对表达量较低,其中品种宁春13号、内麦19号、生选3号、绵阳15号、新春8号和宁春4号经历下降―上升―下降―上升―下降的过程,品种博爱7023、川麦22和青春5号经历下降―上升―下降的过程。TaPPH基因在旗叶衰老过程中相对表达量高于TaCLH基因,整体呈现先升高后下降的趋势,峰值出现在22~25d,相对表达量最高的时段集中在花后16~28d。
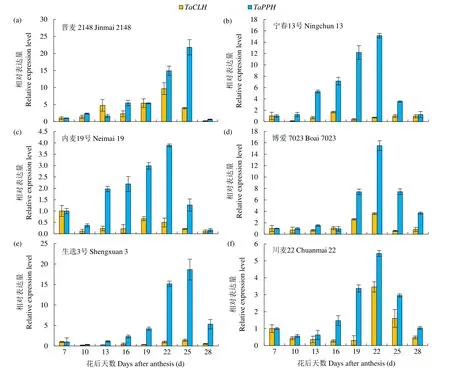
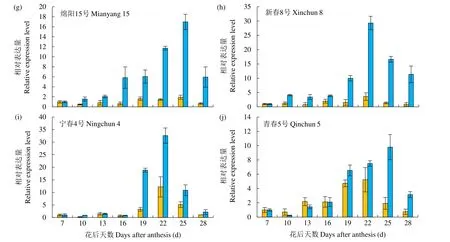
图6 不同品种春性小麦花后不同阶段TaCLH和TaPPH相对表达量的动态变化Fig.6 Dynamic changes of TaCLH and TaPPH gene relative expression level of flag leaves on main stem of different spring wheat varieties after postanthesis
2.5 不同品种春性小麦花后旗叶 TaCLH、TaPPH相对表达量和生理指标的相关性分析
由表3可知,花后小麦旗叶叶绿素荧光参数Y(II)、Fv/Fm和ETR之间以及其与SPAD和GLAD值之间都具有极显著的相关性。TaCLH与多数衰老相关生理指标之间相关性不显著,但是与TaPPH之间的正相关性却达到显著水平;TaPPH与SPAD、GLAD值及叶绿素荧光参数 ETR、Fv/Fm、Y(II)之间存在极显著的负相关关系,即随着花后衰老过程中TaPPH基因的表达这些生理指标值会随之下降。这说明TaCLH与TaPPH在旗叶衰老过程中可能为协同变化,共同影响旗叶的衰老过程。
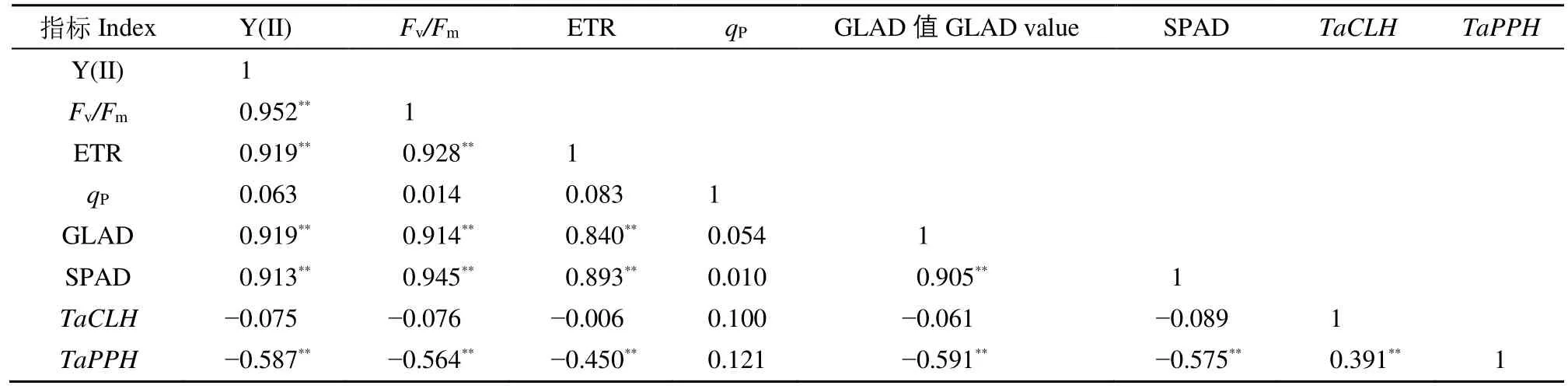
表3 各性状间的相关系数Table 3 Correlation coefficients of traits
3 讨论
叶绿素是植物进行光合作用所需的重要色素,研究[13]显示,全球每年约有一百多吨叶绿素被降解。自20世纪90年代以来,在深入研究了叶绿素降解的产物结构和酶基因后,叶绿素降解的过程才逐渐被人们熟知[14]。一段时间内,叶绿素酶催化的脱植基反应被认为是叶绿素降解的第1步。Takamiya等[15]研究表明,叶绿素首先在CLH的作用下进行脱植基反应,再在MCS的作用下进行脱镁反应,最后生成 Phein a。但这一结论受到广泛争议,Hirschfeld等[16]和Okazawa等[17]研究表明,在柑橘和银杏等中CLH亚细胞定位于叶绿体膜内叶绿素降解底物附近,而有研究[18-20]表明,拟南芥中CLH定位于叶绿体以外的细胞质、液泡或内质网。随着对叶绿素降解途径的深入研究,PPH先后被人们挖掘出来,Schelbert等[8]和Ren等[21]分别运用化学、遗传学手段和聚类分析从拟南芥中鉴定到 PPH基因,Morita等[10]也从水稻中克隆鉴定到AtPPH的同源基因NYC3(NON-YELLOW COLORING 3)。PPH的发现为叶绿素降解代谢研究提供了另一条途径,Chl a首先在MCS的作用下进行脱镁反应,然后在 PPH的作用下进行脱植基反应,最后生成Phein a。
本文通过相关性分析发现,TaPPH的相对表达量与SPAD、GLAD及叶绿素荧光参数ETR、Fv/Fm和Y(II)之间存在极显著的负相关关系,即随着花后衰老过程中TaPPH基因的表达,这些生理指标值下降,说明TaPPH基因在花后旗叶衰老过程中对叶绿素含量、功能绿叶面积的下降及叶绿素荧光参数的变化具有重要影响。而TaCLH与多数衰老相关生理指标之间相关性不显著,但TaCLH与TaPPH的相对表达量之间的相关性却达到了极显著水平。进一步对小麦叶片衰老过程中TaCLH与TaPPH基因表达进行分析,发现叶绿素降解过程中与脱植基反应相关的2个基因TaCLH与TaPPH的表达量都出现了显著的峰值,但TaPPH总体表达显著高于TaCLH。TaCLH在花后旗叶衰老过程中相对表达量较高的时间段集中于花后16~28d,且峰值出现在花后19~25d;TaPPH在旗叶衰老过程中相对表达量较高的时间段集中于花后16~28d,且峰值出现在花后22~25d。从聚类后的衰老特征参数来看,参试小麦品种的衰老起始与终止时间段在花后12~30d,且最大衰老速率时间出现在花后24~26d,这与TaCLH与TaPPH的高表达时间段和峰值出现时间基本一致。所有这些结果表明TaPPH在小麦叶片衰老叶绿素降解的脱植基过程中起主要作用,TaCLH可能与TaPPH通过互作行使功能,这需要进一步研究证实。
最新研究[22]表明,在幼嫩的拟南芥中叶绿素酶1(CLH1)在光系统的自我保护机制中发挥着重要的作用。而CLH1在拟南芥[23]、黑麦[24]和豆类[25]的幼叶中表达量显著,随着叶片成熟基因的表达量逐渐下降,推测叶绿素酶1基因主要是在作物生长发育前期起作用,而在小麦生长发育早期TaCLH是否起作用及如何发挥作用还需要进一步探索。
4 结论
随着花后小麦籽粒灌浆的进行,参试的 10个春性小麦品种旗叶SPAD、GLAD及荧光动力学参数ETR、Fv/Fm、Y(II)和qP随着叶片衰老过程的进行呈逐步降低的趋势,且在各阶段表现出品种间差异。基于花后SPAD和GLAD值的衰老特征参数进行系统聚类,从参试品种中筛选出持绿型和非持绿型品种。参试小麦旗叶衰老过程中TaCLH与TaPPH都出现了显著的高表达时间段,但TaPPH整体表达量显著高于TaCLH。TaPPH表达量与GLAD、SPAD值及叶绿素荧光参数ETR、Fv/Fm和Y(II)等生理指标之间存在极显著负相关,表明TaPPH在春小麦花后旗叶叶绿素降解的脱植基过程中起主要作用。

