静脉用药调配中心成品输液稳定性分析

【摘要】目的:探究静脉用药调配中心(PIVAS)药品调配完成后成品输液稳定时间,保障临床用药安全、有效。方法:参考药品说明书,查阅中国知网、万方、维普等数据库,对我院常用药品(抗菌药物、抗肿瘤药物、中药注射剂)稳定性进行归纳总结。结果:本院PIVAS共有不同品规的静脉用药品160种,其中50种药品说明书有提及药品溶解后稳定时间,110种药品没有提及稳定性问题。30种注射用抗菌药物中有15份药品说明书给予药液的稳定性建议;30种注射用抗肿瘤药物中有16份说明书给予药液稳定性建议;13个中药注射剂中有7份药品说明书给予药液的稳定性建议。结论:完善本院常用静脉药物成品输液稳定性数据,为临床安全、合理用药提供依据。
【关键词】静脉用药调配中心(PIVAS);成品输液;稳定性
【中图分类号】R826.2+6 【文献标识码】A 【文章编号】2026-5328(2022)02--04
【Abstract】Objective Explore the stability time of finished product infusions in pharmacy intravenous admixture service to ensure the safety and effectiveness of clinical drug use. Methods The stability of finished product infusions was summarized referring to the drug instructions and literature databases of CNKI, WanFang and WeiPu. Result There are 160 kinds of intravenous drugs with different specifications in PIVAS, 50 kinds of which mentioned the stability time after dissolution in drug instructions. The stability of solution in the drug instructions was given in 15 of 30 injection antibiotics, 16 of 30 injection anti-tumor drugs and 7 of 13 traditional Chinese medicine injections. Conclusion The stable time of finished product infusions were collected to provide reference for safe and rational medication in clinic.
【Key words】Pharmacy intravenous admixture service (PIVAS); finished product infusions; Stability
我院静脉用药调配中心(Pharmacy intravenous admixture service,PIVAS)目前负责调配全院共43个病区的长期和临时医嘱静脉输液。PIVAS工作模式代替了传统在病房开放式环境中配制输液的工作模式,减少了微生物、外源性微粒污染的风险,保证了药物、人员和环境的安全。本院PIVAS审方药师负责审核静脉用药医嘱的合理性、相容性和稳定性,溶媒的选择与基础输液用量的适宜性;药师和护士共同负责按照审核通过的医嘱混合调配药品,保证输液质量安全。PIVAS成品输液是指按照医师处方或用药医嘱,经药师适宜性审核,并有药学专业技术人员通過无菌操作技术将一种或数种静脉用药品进行混合调配,可供临床直接用于患者静脉输注的药液[1]。成品输液的稳定性和安全性是目前PIVAS需要关注的重要问题之一。药物配制完成后随着放置时间的延长,药物的有效成分含量可能会减少,输液的微粒数可能会增多,甚至发生变色和沉淀等理化性质变化。这些均会影响药物治疗效果,甚至增加药物不良反应发生的可能。由于PIVAS工作特点,从药品调配、复核包装、成品输液送至临床到患者使用输液需要一定时间,不易做到现配现用。因此PIVAS应掌握临床所用药品的稳定性特点,体现药学服务专业价值。
1 资料与方法
收集我院160种静脉用药品说明书,并根据药理机制将药品分为抗菌药物、抗肿瘤药物、中药注射剂和其他类药品四类。参考药品说明书,查阅中国知网、万方、维普等数据库,对关于抗菌药物、抗肿瘤药物和中药注射剂复溶后的溶液稳定性相关资料进行分类整理。
2 结果
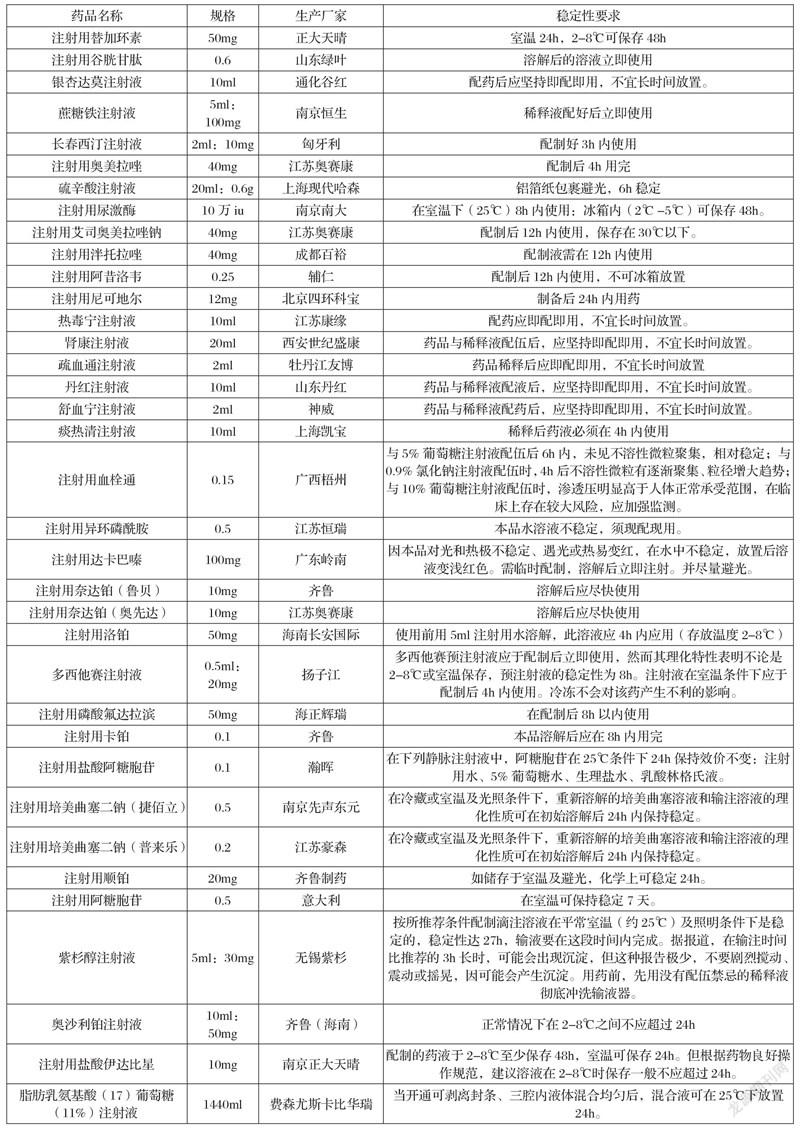
2.1 药品说明书 本院PIVAS共有不同品规的静脉用药品160种,其中50种药品说明书有提及药品溶解后稳定时间,另外110种药品没有提及稳定性问题。说明书中对成品输液有明确使用时间规定的50种药品及其稳定时间详见表1。
2.2抗菌药物 本院使用的不同品规的静脉用抗菌药物有30个,其中15个药品的说明书给予配制溶液的稳定性建议。根据《桑福德抗微生物治疗指南》[2]部分β-内酰胺类药物延长或持续给药方案获得部分抗菌药物的最小稳定性。注射用头孢他定37℃稳定8h,25℃稳定24h,4℃稳定≥24h;注射用美罗培南37℃稳定<4h,25℃稳定4h,4℃稳定24h。注射用哌拉西林钠他唑巴坦钠37℃稳定24h,25℃稳定24h;注射用万古霉素37℃稳定48h,25℃稳定48h,4℃稳定58天。通过查阅文献获得以下抗菌药品配制后稳定性信息。注射用青霉素钠在25℃环境中2.5h稳定,37℃条件下1h稳定[3]。注射用阿莫西林克拉维酸钾在5℃、25℃和37℃时,3h内阿莫西林在0.9%氯化钠注射液中变化不大,但是克拉维酸钾在各条件放置下3内含量下降50%以上,成品输液在最好在配制后30分钟内滴完[4]。注射用美洛西林在0.9%氯化钠注射液、10%葡萄糖注射液、5%葡萄糖注射液以及5%葡萄糖氯化钠注射液中6h内稳定[5]。左氧氟沙星注射液在葡萄糖注射液中5℃、20℃、30℃避光条件下12h含量基本保持稳定[6]。注射用乳糖酸红霉素在酸性(pH小于4)溶液中不稳定,易分解,实验证明仅用葡萄糖注射液溶解的红霉素1h后有明显杂质出现,4h后含量降低10%;加入碳酸氢钠注射液调整pH后,4h仅降低4.4%[7]。克林霉素注射液与维生素C葡萄糖注射液配伍后6h内在25℃和37℃环境中,外观无变化,含量无明显变化[8]。依替米星注射液与10%葡萄糖注射液、0.9%氯化钠注射液、5%葡萄糖氯化钠注射液配伍后8h内药品质量和pH均无明显变化[9]。阿米卡星注射液在0.9%氯化钠注射液中较为稳定,在5%葡萄糖注射液中24h 18℃含量降低6%,36℃含量降低约10%[10]。注射用头孢哌酮钠舒巴坦钠35℃环境中在5%葡萄糖氯化钠注射液、5%葡萄糖注射液和10%葡萄糖注射液中T0.9都小于4 h,稳定性较差[11]。注射用头孢唑林钠在0.9%氯化钠注射液、5%葡萄糖注射液、乳酸钠林格注射液、木糖醇注射液、果糖注射液、转化糖电解质注射液中40℃、25℃下6 h内是稳定的[12]。注射用头孢美唑溶解后室温条件下放置24h,冰箱内存放一周稳定,含量下降为5%左右[13]。注射用哌拉西林钠在5%、10%葡萄糖注射液、0.9%氯化钠注射液在8h内稳定[14]。注射用氟氯西林与转化糖注射液、果糖氯化钠注射液、果糖注射液、5%葡萄糖注射液配伍后在6h 内基本稳定[15]。注射用苯唑西林钠首选0.9%氯化钠注射液配伍6h内稳定,与5%葡萄糖注射液配伍3h内滴完,与10%葡萄糖注射液、5%葡萄糖氯化钠注射液配伍应尽量减少[16]。
2.3抗肿瘤药物 本院30个品规的静脉用抗肿瘤药品中有16个品种说明书提及药品溶液稳定性问题,14个品种的抗肿瘤药品说明书没有提及药物配制后储存时间。对本院常用化疗药物进行药物配制稳定性相关文献检索并汇总以下信息。注射用环磷酰胺在常规光照室溫下,0-6h与5%葡萄糖注射液、5%葡萄糖氯化钠注射液和0.9%氯化钠注射液配伍稳定性好,外观、含量无明显变化[17]。多西他赛注射液24h内与0.9%氯化钠注射液、5%葡萄糖注射液的配伍外观与pH值均无明显变化,但多西他赛注射液的含量在配制后8h均有明显下降[18]。盐酸吉西他滨与0.9%氯化钠注射液和5%葡萄糖注射液配伍后,常温下24h配伍液的pH、主药百分含量相对0h变化小于2%,不溶性微粒符合中国药典规定[19]。氟尿嘧啶注射液在不同温度(4℃、25℃和37℃)下72h内的外观和pH值均无明显改变,不溶性微粒符合输液标准,相对初始含量均大于95%,稳定性良好[20]。注射用奥沙利铂与葡萄糖注射液及果糖注射液配伍8h后含量在95%以上,外观、pH值无明显变化[21]。注射用盐酸表柔比星溶解在0.9%氯化钠注射液中后,在2~8℃ 条件下保存40d或在室温条件下放置1d均保持稳定[22]。注射用盐酸伊立替康与0.9%氯化钠注射液、5%葡萄糖注射液配伍后6h 内颜色、pH 值、有关物质及含量均无变化[23]。替加氟注射液溶解在0.9%氯化钠注射液中,在室温、避光、冷藏3种放置条件下,24 h内外观、pH 值、不溶性微粒数和含量无明显变化[24]。依托泊苷、长春地辛、吡柔比星混合配制于500ml 0.9%氯化钠注射液中,混合溶液在36h内,25℃或4℃放置均稳定,各组分含量变化范围在±5%以内,pH及不溶性微粒无明显差异[25]。注射用雷替曲塞溶解于100ml 0.9%氯化钠注射液和5%葡萄糖注射液中,在24h内不同温度下(4℃冷藏箱内、25℃和37℃)输液的外观、pH 值、不溶性微粒数和含量无明显改变,符合药典规定[26]。
2.4中药注射剂 本院使用的不同品规的中药注射剂(除免混合输液)共有13个。7个药品的说明书给予配制溶液的稳定性建议,其中5份说明书建议“即配即用”。由于“即配即用”时间未详细确定,所以通过查阅文献获知中药注射剂稳定性特点。注射用血塞通在与0.9%氯化钠注射液、5%葡萄糖注射液、10%葡萄糖注射液、葡萄糖氯化钠注射液、复方氯化钠注射液、乳酸钠林格注射液6种输液,在低温、常温及高温下配伍,其外观、可见异物、pH值和有效主药含量在8 h内均稳定,可配伍使用[27]。唐樑等[28]研究发现疏血通注射液在0.9%氯化钠注射液和5%葡萄糖注射液中稳定时间2h,热毒宁注射液在0.9%氯化钠注射液中稳定3h,在5%-10%葡萄糖注射液中稳定2h,艾迪注射液在5%葡萄糖注射液中稳定2h,艾迪注射液在0.9%氯化钠注射液以及丹红注射液、醒脑静注射液在0.9%氯化钠注射液和5%葡萄糖注射液中产生不溶性微粒偏多。舒血宁注射液与0.9%氯化钠注射液、葡萄糖氯化钠注射液、右旋糖酐40注射液、乳酸钠林格注射液、木糖醇注射液及5%葡萄糖注射液加重组人胰岛素注射液的条件下配伍12h后,溶液的颜色、pH值、≥10μm和25μm的不溶性微粒均符合规定,黄酮类、银杏内酯和总内酯含量没有变化[29]。肾康注射液溶解于0.9%氯化钠注射液中原儿茶醛含量下降明显且不溶性微粒最多,2h后明显增加,临床应选择稳定性更好地葡萄糖注射液作为溶媒,尽可能2h内用完[30]。注射用灯盏花素与250ml 0.9%氯化钠注射液、5%葡萄糖注射液、10%葡萄糖注射液、5%葡萄糖氯化钠注射液配伍8h外观、pH值、不溶性微粒、渗透压摩尔浓度、含量、相关物质均无明显变化;但由于说明书规定注射用灯盏花素与pH低于4.2的溶液使用时,可使药物析出,由于葡萄糖注射液pH较低,从安全角度考虑建议使用0.9%氯化钠注射液[31]。注射用益气复脉与0.9%氯化钠注射液在室温、高温、光照、暗处条件下,6h内外观、pH、不溶性微粒及人参皂苷、五味子醇甲含量以及指纹图谱变化不明显,溶液较稳定[32]。
3 分析与讨论
3.1需要更多药品稳定性数据 本院普通药品共计92种,其中10种药品在说明书中给予稳定性推荐意见,82种药品说明书中未提及;本院冷藏药品有12种,其中有3种药品说明书提及稳定性,另外10种药品说明书均未给予相关建议。笔者考虑一方面原因是配制输液稳定性内容不是药品说明书规定必须提供的数据;另一方面原因是生产厂家这方面数据不详。注射用药品在临床使用过程中还存在以下问题:(1)冷处(2-10℃)储存的药品配制成成品输液后可稳定保存的时限;(2)无配伍禁忌的多种药品混合后药品稳定性特点;(3)不同厂家、不同剂型的药品稳定性是否相同,可否互为参考依据,可否参考不同厂家的稳定性实验文献给予用药指导。比如,多西他赛注射液两个生产厂家,一个厂家(扬子江药业)说明书详细描述配制好的多西他赛注射用溶液使用时限,另一个厂家(江苏奥赛康药业)说明书无建议。且参考文献[18]中所选用实验药品是齐鲁制药生产的多西他赛注射液,所得结论与扬子江药业的多西他赛注射液不完全相同。注射用奥沙利铂说明书中无稳定性数据,奥沙利铂注射液说明书中有稳定性建议,且与注射用奥沙利铂参考文献中[21]稳定时限不相同。注射用阿莫西林克拉维酸钾参考文献建议与说明书推荐使用时限不一致。(4)基层医院受限于实验仪器和材料,开展稳定性实验获取数据有难度。综上,建议国家统一给予成品输液稳定性建议标准并规范临床应用,说明书补增成品输液配伍稳定性数据,包括冷处、室温、高温、避光、正常光照等不同环境下药品稳定性数据。
3.2 PIVAS成品输液稳定性因素
3.2.1 从微生物学角度考虑 根据《病区医院感染管理规范》病区治疗室开放的环境中抽出的药液和配制好的静脉输注用无菌液体,放置时间不应超过2h。美国药典(U.S. Pharmacopeia, USP)将无菌配制药品微生物污染危险分为高、中、低三个等级。USP对不同配制危险等级的规定如下:低危和中危等级配制环境是在使用合适机械控制装置的药房中ISO8级洁净室中的ISO5级通风橱中进行;高危等级环境是护士站、急诊中心或病人旁边,无任何机械控制装置。参考《药品生产质量管理规范(2010年修订)》洁净度级别要求,PIVAS一次更衣室为D级(ISO8),二次更衣室和调配间为C级(ISO7),层流洁净台为A级(ISO5),为低、中危配制环境。USP规定低、中危配制的药品在室温的使用期限为30-48h,在冰箱冷藏的使用期限为7-14d,在冷冻≤-20℃使用期限为45d。
3.2.2从主药含量方面考虑 配制后的成品输液如果放置时间过长,有可能会降低主药含量。PIVAS应根据药品性质和临床治疗需要合理分配输液批次,保证输液在临床应用前即配制完成并送达,尽量减少输液放置等待时间。稳定时间较短的药品如抗菌药物(注射用阿莫西林钠克拉维酸钾、注射用青霉素)、注射用谷胱甘肽、蔗糖铁注射液、长春西汀注射液、银杏达莫注射液均分配在不同操作台上在各批次最后时间调配。抗肿瘤药品独立配制,均在各批次长期医嘱和临时医嘱送药前半小时内完成调配,尽量缩短成品输液放置时间。PIVAS负责将稳定时间少于4h的药品目录提供给临床医务人员并进行宣教,保证药品在有效时限内使用。
3.2.3不溶性微粒 不溶性微粒是注射剂产品质量的常规检查项目。根据2020年《中国药典》第四部不溶性微粒检测法(光阻法)规定:标识装量为100ml或100ml以上的静脉用注射液除另有规定外,每1ml中含有10μm及10μm以上的微粒数不得超过25粒,含25μm及25μm以上的微粒数不得超过3粒。输液产品中的不溶性微粒水平受输液产品整个生命周期的影响,包括生产、储存和运输以及临床使用过程的各个环节诸多因素[33]。PIVAS成品输液不溶性微粒的产生及逐渐增加和很多因素有关:药品性质、环境洁净度、室温、载体输液袋材质、药物配伍、存储时间、无菌操作技术(玻璃安瓿折断、橡皮塞穿刺的角度和次数、注射器反复抽吸次数、抽取药液方法、针头污染、玻璃安瓿或胶塞质量)等。不溶性微粒经静脉进入体内,其对心、肺、肝、肾和血管的危害严重。输液配伍导致的不溶性微粒产生,一般中药注射剂影响最大,粉针剂次之,小容量注射剂(安瓿装)再次之[33]。不溶性微粒是中药注射剂产生不良反应的重要原因之一[34]。中药注射剂是饮片经提取、纯化制成,成分复杂,未知物多,易受pH、温度、其他药物成分等因素的影响导致溶解度下降或产生聚合物出现沉淀,以及可能使有效成分破坏或药效降低。根据《中成药临床应用指导原则》规定:中药注射剂应按照药品说明书推荐的剂量、调配要求、给药速度和疗程使用药品;中药注射剂应单独使用,严禁混合配伍,谨慎联合用药。目前本院中药注射剂在临床使用中均单独使用并给予间隔液冲管。中药注射剂溶媒根据药品说明书推荐选择适宜溶媒和剂量,以减少因溶媒不足导致药物溶解不充分或pH、电解质等因素影响药品质量而引起的不良反應。现在中药注射剂在临床使用存在的问题之一是PIVAS成品输液放置稳定性问题。根据说明书要求和文献报道,本院PIVAS将稳定性较差的中药注射剂:热毒宁注射液、肾康注射液、疏血通注射液、丹红注射液、醒脑静注射液、艾迪注射液定置在不同的操作台上在不同批次的最后调配时间内混合加药,尽量缩短临床放置时间,确保输液在1-2h内使用。
4 小结
PIVAS药学服务旨在集中调配工作模式下,为患者提供质量安全、用药合理的成品输液,保护患者用药权益。PIVAS调配过程加强了医嘱审核、核对,防止用药错误;封闭的万级保护下的百级操作环境,减少了各种微粒对输液的影响,提高了输液质量。成品输液稳定性问题是PIVAS最后输液应用环节需要关注的重要问题。本文查阅了本院PIVAS所有药品的说明书并查阅相关文献,总结了抗菌药物、抗肿瘤药物和中药注射剂成品输液的稳定性,为PIVAS调配和临床安全有效用药提供参考依据。
参考文献:
国家卫生健康委. 静脉用药调配中心建设与管理指南(试行)(国卫办医函(2021)598号).2021-12-20.
范洪伟. 桑福德抗微生物治疗指南(新译第46版)[M].中国协和医科大学出版社,2016:119.
段明华,潘艳,马淑飞,等. 注射用青霉素钠方法学研究及溶液稳定性研究[J]. 内蒙古医学院学报,2012,34(4):265-271.
张靖贤,林自中,黄鲜娇. 注射用阿莫西林钠克拉维酸钾与氯化钠注射液配伍稳定性考察[J]. 中国药房,2003,14(12):46-47.
臧治满,李晨晨,谭爱萍. 美洛西林与四种常用输液的配伍稳定性考察[J]. 实用药物与临床,2011,14(5):397-400.
顾洪安,沈浩,张曙华, 等. 左氧氟沙星注射剂的稳定性[J]. 中国临床药学杂志,2007,16(5):311-314.
夏泉,王中新,刘钢,等. pH对红霉素稳定性及抑菌作用的影响[J]. 中国医院药学杂志,2008,28(20):1755-1758.
薛国菊,钱文璟,时涛,等. 盐酸克林霉素注射液与维生素C葡萄糖注射液配伍的稳定性[J]. 中国药师,2005,8(4):302-304.
吕亚萍,陈剑君,罗俊. 依替米星在不同溶媒中的稳定性研究[J]. 浙江工业大学学报,2006,34(3):290-293.
郭清峰,张保中. 阿米卡星注射液在3种输液中的稳定性[J]. 中国医院药学杂志,1996,16(6):269-270.
郑晓娴,夏运岳,金卫坤. 头孢哌酮钠/舒巴坦钠在3种输液中的稳定性考察[J]. 苏州大学学报(医学版),2002,22(6):790-791.
彭燕,张玲莉,沈秉正,等. 注射用头孢唑林钠在不同溶媒中的稳定性研究[J]. 现代药物与临床,2014,29(7):813-817.
朱珠,徐晓薇,诸明,等. 三种含量测定方法对头孢美唑在七种输液剂中的稳定性研究[J]. 抗生素,1988,13(2):113-117.
沈琳. 哌拉西林钠在输液中的配伍稳定性[J]. 辽宁药物与临床,2003,6(1):35-36.
谢兵,吴明钗,林洁,等. 氟氯西林钠与4种输液的配伍稳定性[J]. 海峡药学,2010,22(6):57-59.
张晓景,陈方亮. 苯唑西林钠在4种输液中的稳定性考察[J]. 中国药师,2006,9(7):639-641.
符平. 环磷酰胺注射剂在静脉滴注中的稳定性观察[J].临床合理用药,2017,10(2C):80-81.
刘广宣,赵茜,齐先福,等. 多西他赛注射液与不同溶媒配伍的稳定性考察[J]. 中国医院药学杂志,2015,35(1):76-79.
李博乐,魏淳,王晨. 吉西他滨与氯化钠注射液及不同pH葡萄糖注射液的配伍稳定性[J]. 中国医院药学杂志,2013,33(2):167-168.
张晓璐,张程亮,何光照,等. 氟尿嘧啶配置后输液在输液泵中的稳定性考察[J]. 中国药师,2019,22(12):2352-2353+2365.
孙坚彤,沈云玉,任鹏,等. 注射用奥沙利铂与不同输液配伍的稳定性[J]. 抗感染药学,2005,2(2):87-88.
李晓光,翟所迪,李珍,等. 3种注射用盐酸表柔比星溶液的稳定性考察[J]. 中国药学杂志,2013,48(8):615-620.
路胜. 注射用盐酸伊立替康配伍稳定性研究[J]. 黑龙江科技信息,2015,06:97.
张洁,贺娇. 氟尿嘧啶与0.9%氯化钠注射液配伍的稳定性研究[J]. 现代药物与临床,2013,28(2):224-226.
刘秀兰,裘琳,刘异. 依托泊苷、长春地辛、吡柔比星3种抗肿瘤药物配伍稳定性[J]. 中国医院药学杂志,2018,38(13):1432-1435.
王玲娜,张晓璐,薛宏波,等. 注射用雷替曲塞在输液中的稳定性考察[J]. 中国医院药学杂志,2017,39(18):1847-1849.
王乙鸿,普俊学,王子幼,等. 注射用血塞通(冻干)与临床常用输液配伍稳定性研究[J]. 中医药导报,2015,21(9):51-55.
唐樑,冯哲玺,张登宇,等. 疏血通等10種中药注射剂与不同溶媒配伍的稳定性[J]. 生物加工过程,2018,16(6):63-69.
于芝颖,李玉珍. 舒血宁注射液与临床常用输液的配伍稳定性[J]. 中国药学杂志,2012,47(6):467-470.
朱亚宁,张鹏,李巧如,等. 肾康注射液与5种溶媒配伍的稳定性考察[J]. 中国药师,2015,18(8):1420-1423.
段银,陈学坤,赵成跟,等. 注射用灯盏花素与常用输液的配伍稳定性考察[J]. 中国药师,2019,22(1):181-183.
苏小琴,周学谦,尚献召,等. 注射用益气复脉(冻干)与氯化钠注射液配伍稳定性考察[J]. 药物评价研究,2020,43(8):1554-1558.
彭姝,李慧芬,任重远,等. 影响输液不溶性微粒的相关因素[J]. 中国药品标准,2019,20(2):101-109.
刘文清,王玥,杜守颖,等. 不溶性微粒引发中药注射剂不良反应的原因及分析[J]. 药物评价研究,2019,42(3):575-578
作者简介:李锋,副主任药师,研究方向:医院药学 Tel:(0538)7269332 E-mail: lifengpivas@163.com

